资料中包含下列文件,点击文件名可预览资料内容





还剩10页未读,
继续阅读
所属成套资源:2024-2025鲁科版化学选择性必修1PPT课件全册
成套系列资料,整套一键下载
鲁科版选择性必修一 第3章 微项目 探索索尔维制碱法和侯氏制碱法 课件
展开
这是一份鲁科版选择性必修一 第3章 微项目 探索索尔维制碱法和侯氏制碱法 课件,文件包含第3章微项目探索索尔维制碱法和侯氏制碱法-2022-2023学年高二化学同步精品课堂鲁科版2019选择性必修1pptx、实验室模拟索尔维制碱法mp4等2份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
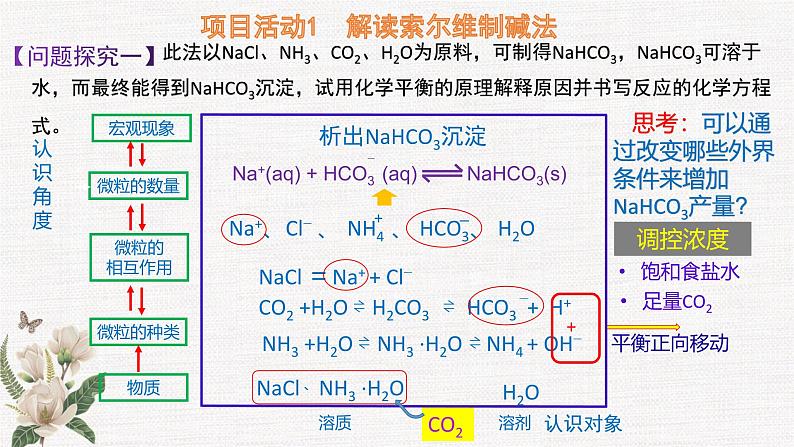
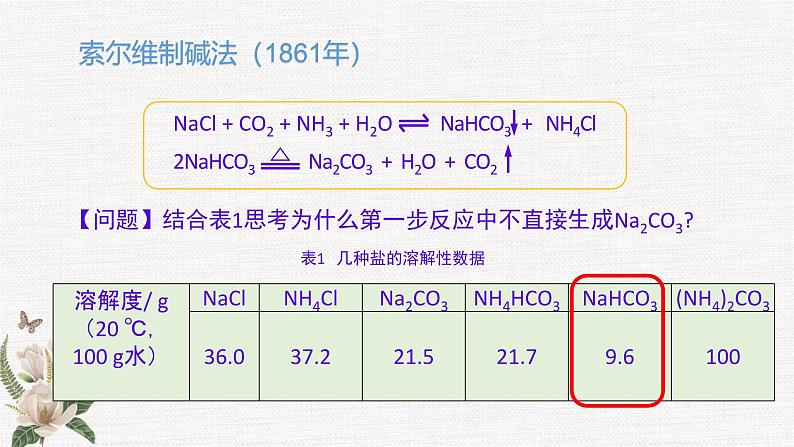
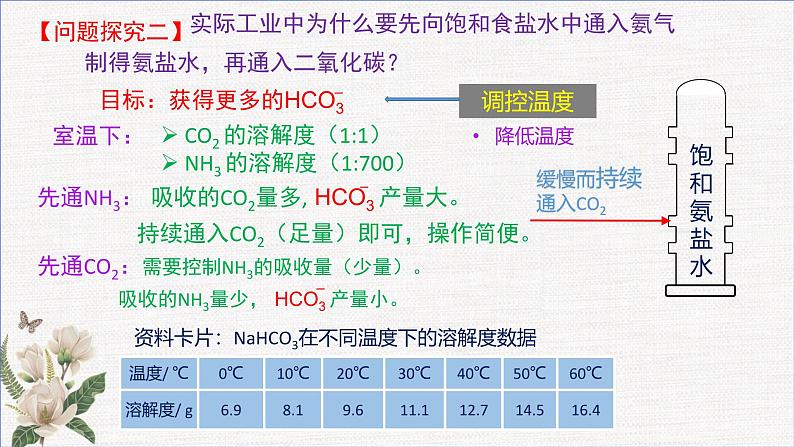
微项目 揭秘索尔维法和 侯氏制碱法 化学平衡思想的创造性应用 纯碱是一种重要的无机化工原料,其产量和消费量通常作为衡量一个国家工业发展水平的指标。 主要用于平板玻璃、玻璃制品和陶瓷釉的生产;还广泛用于生活洗涤、酸类中和以及食品加工等。 纯碱制造的历史E. Ernest Solvay (1838-1922)比利时工业化学家Nicolas Leblanc(1742~1806)法国化学家侯德榜(1890-1974)中国化工专家,中央研究院院士 1789年,法国奥尔良地区封建主公爵的侍从医生路布兰成功地创造了一种制碱的方法,1791年获得专利,路布兰制碱法所用的原料为食盐、硫酸、木炭和石灰石。 比利时工程师索尔维以食盐、石灰石和氨为原料制得碳酸钠和氯化钙,1867年这种方法被命名为索尔维制碱法。 1921年,侯德榜带领团队,经过五年摸索,用索尔维法制得了高质量的纯碱,并于1933年出版巨著《纯碱制造》,打破了技术垄断,对社会的发展作出了巨大的贡献。索尔维法的食盐利用率低,根据实际情况,侯德榜对索尔维法进行了创新,创造性地提出了侯氏制碱法。项目活动1 解读索尔维制碱法实验步骤:用如图所示装置模拟索尔维法。锥形瓶中装有碳酸钙粉末,分液漏斗中装有稀硫酸,试管中装有氨盐水,并滴有酚酞溶液。用冰水浴降低试管内的温度。打开分液漏斗,观察二氧化碳通入氨盐水的现象。1.模拟实验:实验现象:随CO2的不断通入,溶液的红色逐渐褪去后,溶液中出现白色沉淀。项目活动1 解读索尔维制碱法【问题探究一】 此法以NaCl、NH3、CO2、H2O为原料,可制得NaHCO3,NaHCO3可溶于水,而最终能得到NaHCO3沉淀,试用化学平衡的原理解释原因并书写反应的化学方程式。认识角度认识对象物质溶质溶剂CO2H2O微粒的相互作用微粒的种类微粒的数量宏观现象析出NaHCO3沉淀NaCl =Na+ + Cl−NaCl 、NH3 ·H2O 思考:可以通过改变哪些外界条件来增加NaHCO3产量?调控浓度饱和食盐水足量CO2索尔维制碱法(1861年)表1 几种盐的溶解性数据【问题】结合表1思考为什么第一步反应中不直接生成Na2CO3?饱和氨盐水缓慢而持续通入CO2【问题探究二】 CO2 的溶解度(1:1) NH3 的溶解度(1:700)室温下: 实际工业中为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入二氧化碳?降低温度调控温度从平衡角度对索尔维法原理分析总结——形成解决实际问题的思路。(1)优点:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。(2)缺点:原料食盐的利用率低,且生成了没有多大用途的氯化钙(CaCl2)。Ca2+ 、Na+、 Cl− (大量)OH− (少量)(1)索尔维法的食盐利用率低,增加生产成本。(2)我国的纯碱工业陷入困境。项目活动2 体会侯氏制碱法的创新1.侯氏制碱法出现的背景高浓度的Cl−会使补加的食盐难以溶解2.核心目标:从母液中分离出NH4Cl3.侯氏制碱法工艺流程NH4Cl是优质氮肥4.平衡思想在侯氏制碱法中的应用课堂练习D1.了解化学反应原理,学会健康生活。下列对有关现象及事实的解释不正确的是( )A2.某溶液离子及浓度如下表则Mn+、a可能为( )A.NH4+、2 B.Ba2+、1 C.Al3+、2 D.Fe2+、13、纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“侯氏制碱法”两种工艺,请按要求回答问题:(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_________________________________________。(2)写出“侯氏制碱法”有关反应的化学方程式:_____________________________________________________,_____________________________________________________。(3)CO2是制碱工业的重要原料,“侯氏制碱法”与“氨碱法”中CO2的来源有何不同?_____________________________________________________________________________________________________________;2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2ONH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl 2NaHCO3 Na2CO3+CO2↑+H2O“氨碱法”的CO2来源于石灰石煅烧,“侯氏制碱法”的CO2来源于合成氨工业的废气4.我国化学家侯德榜改革国外的纯碱生产工艺,探索出了一种生产纯碱的方法,其生产流程可简要表示如下:(1)上述生产纯碱的方法称 ,副产品的一种用途为 。 (2)沉淀池中发生反应的化学方程式是 。 (3)写出上述流程中X物质的分子式为 。 (4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环 (填上述流程中的编号)过程,从沉淀池中得到沉淀的操作是 。 (5)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。 a.增大NH4+的浓度,使NH4Cl更多地析出 b.使NaHCO3更多地析出c.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。 侯氏制碱法(或联合制碱法)用做农作物的化肥NH3+CO2+H2O+NaCl === NaHCO3↓+NH4ClCO2Ⅰ过滤ac硝酸酸化的硝酸银溶液
微项目 揭秘索尔维法和 侯氏制碱法 化学平衡思想的创造性应用 纯碱是一种重要的无机化工原料,其产量和消费量通常作为衡量一个国家工业发展水平的指标。 主要用于平板玻璃、玻璃制品和陶瓷釉的生产;还广泛用于生活洗涤、酸类中和以及食品加工等。 纯碱制造的历史E. Ernest Solvay (1838-1922)比利时工业化学家Nicolas Leblanc(1742~1806)法国化学家侯德榜(1890-1974)中国化工专家,中央研究院院士 1789年,法国奥尔良地区封建主公爵的侍从医生路布兰成功地创造了一种制碱的方法,1791年获得专利,路布兰制碱法所用的原料为食盐、硫酸、木炭和石灰石。 比利时工程师索尔维以食盐、石灰石和氨为原料制得碳酸钠和氯化钙,1867年这种方法被命名为索尔维制碱法。 1921年,侯德榜带领团队,经过五年摸索,用索尔维法制得了高质量的纯碱,并于1933年出版巨著《纯碱制造》,打破了技术垄断,对社会的发展作出了巨大的贡献。索尔维法的食盐利用率低,根据实际情况,侯德榜对索尔维法进行了创新,创造性地提出了侯氏制碱法。项目活动1 解读索尔维制碱法实验步骤:用如图所示装置模拟索尔维法。锥形瓶中装有碳酸钙粉末,分液漏斗中装有稀硫酸,试管中装有氨盐水,并滴有酚酞溶液。用冰水浴降低试管内的温度。打开分液漏斗,观察二氧化碳通入氨盐水的现象。1.模拟实验:实验现象:随CO2的不断通入,溶液的红色逐渐褪去后,溶液中出现白色沉淀。项目活动1 解读索尔维制碱法【问题探究一】 此法以NaCl、NH3、CO2、H2O为原料,可制得NaHCO3,NaHCO3可溶于水,而最终能得到NaHCO3沉淀,试用化学平衡的原理解释原因并书写反应的化学方程式。认识角度认识对象物质溶质溶剂CO2H2O微粒的相互作用微粒的种类微粒的数量宏观现象析出NaHCO3沉淀NaCl =Na+ + Cl−NaCl 、NH3 ·H2O 思考:可以通过改变哪些外界条件来增加NaHCO3产量?调控浓度饱和食盐水足量CO2索尔维制碱法(1861年)表1 几种盐的溶解性数据【问题】结合表1思考为什么第一步反应中不直接生成Na2CO3?饱和氨盐水缓慢而持续通入CO2【问题探究二】 CO2 的溶解度(1:1) NH3 的溶解度(1:700)室温下: 实际工业中为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入二氧化碳?降低温度调控温度从平衡角度对索尔维法原理分析总结——形成解决实际问题的思路。(1)优点:原料(食盐和石灰石)便宜;产品纯碱的纯度高;副产品氨和二氧化碳都可以回收循环使用;制造步骤简单,适合于大规模生产。(2)缺点:原料食盐的利用率低,且生成了没有多大用途的氯化钙(CaCl2)。Ca2+ 、Na+、 Cl− (大量)OH− (少量)(1)索尔维法的食盐利用率低,增加生产成本。(2)我国的纯碱工业陷入困境。项目活动2 体会侯氏制碱法的创新1.侯氏制碱法出现的背景高浓度的Cl−会使补加的食盐难以溶解2.核心目标:从母液中分离出NH4Cl3.侯氏制碱法工艺流程NH4Cl是优质氮肥4.平衡思想在侯氏制碱法中的应用课堂练习D1.了解化学反应原理,学会健康生活。下列对有关现象及事实的解释不正确的是( )A2.某溶液离子及浓度如下表则Mn+、a可能为( )A.NH4+、2 B.Ba2+、1 C.Al3+、2 D.Fe2+、13、纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“侯氏制碱法”两种工艺,请按要求回答问题:(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_________________________________________。(2)写出“侯氏制碱法”有关反应的化学方程式:_____________________________________________________,_____________________________________________________。(3)CO2是制碱工业的重要原料,“侯氏制碱法”与“氨碱法”中CO2的来源有何不同?_____________________________________________________________________________________________________________;2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2ONH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl 2NaHCO3 Na2CO3+CO2↑+H2O“氨碱法”的CO2来源于石灰石煅烧,“侯氏制碱法”的CO2来源于合成氨工业的废气4.我国化学家侯德榜改革国外的纯碱生产工艺,探索出了一种生产纯碱的方法,其生产流程可简要表示如下:(1)上述生产纯碱的方法称 ,副产品的一种用途为 。 (2)沉淀池中发生反应的化学方程式是 。 (3)写出上述流程中X物质的分子式为 。 (4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环 (填上述流程中的编号)过程,从沉淀池中得到沉淀的操作是 。 (5)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。 a.增大NH4+的浓度,使NH4Cl更多地析出 b.使NaHCO3更多地析出c.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。 侯氏制碱法(或联合制碱法)用做农作物的化肥NH3+CO2+H2O+NaCl === NaHCO3↓+NH4ClCO2Ⅰ过滤ac硝酸酸化的硝酸银溶液
相关资料
更多









