






- 水与水溶液(2)-课件 课件 0 次下载
- 沉淀溶解平衡(1)-课件 课件 0 次下载
- 盐类的水解(1)-课件 课件 0 次下载
- 盐类的水解(2)-课件 课件 0 次下载
- 离子反应(1)-课件 课件 2 次下载
化学鲁科版 (2019)第3节 沉淀溶解平衡一等奖课件ppt
展开钡餐造影是指用BaSO4作为造影剂,病人服下BaSO4后,在X射线照射下显示消化道有无病变的一种检查方法。由于Ba2+有剧毒,水溶性钡盐不能用作造影剂,但BaSO4和BaCO3都难溶于水,为什么选用BaSO4作为造影剂而不用选用BaCO3呢?
一、沉淀溶解平衡的应用——钡餐
1.关注两种物质的溶解性差异
BaSO4(s) Ba2+(aq)+ SO(aq) Ksp=1.1×10-10 ml2L-2
BaCO3(s) Ba2+(aq)+ CO(aq) Ksp=5.1×10-9 ml2L-2
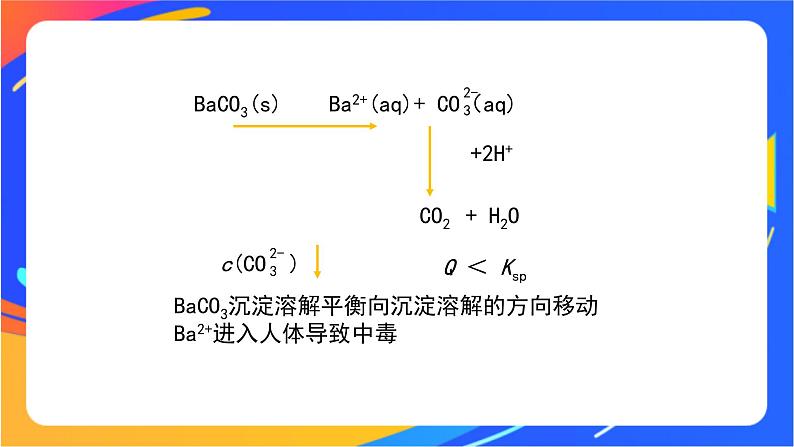
由溶度积可知,它们在饱和溶液中电离出的Ba2+ 的浓度相差并不是很大,但是 BaCO3 不可用作钡餐,这是为什么呢?
病人服下钡盐后进入胃部,胃酸的酸性很强(pH为0.9 ~1.5),含有大量 H+
3.分析物质体系对平衡的影响
BaSO4(s) Ba2+(aq)+ SO(aq) SO 是强酸的酸根离子在溶液中难以与H+结合成硫酸分子
BaCO3(s) Ba2+(aq)+ CO(aq)
BaCO3沉淀溶解平衡向沉淀溶解的方向移动Ba2+进入人体导致中毒
沉淀溶解平衡在钡餐中的应用对我们的启示:
要使沉淀溶解平衡向着沉淀溶解的方向移动,必要条件是 Q < Ksp 。可以加入某种离子,降低难溶电解质沉淀溶解平衡系统中有关离子的浓度,使沉淀溶解。
BaCl2(aq) Ba2+(aq)+ 2Cl-(aq)
二、沉淀溶解平衡的应用——钡盐中毒的治疗方法
如果误食可溶性钡盐如BaCl2,造成钡中毒,如何选用解毒药呢?
1.如何去除Ba2+? 将Ba2+沉淀下来,排出体外
2.选用哪种离子与Ba2+结合成沉淀呢?
选用不受胃酸影响的SO ,使其形成BaSO4的沉淀
Q(BaSO4) > Ksp(BaSO4)
BaSO4沉淀溶解平衡向沉淀生成的方向移动
BaSO4(s) Ba2+(aq)+ SO (aq)
3.确定选用SO 后,对其浓度有何要求呢?
选用5.0% 的Na2SO4溶液给患者洗胃
利用沉淀溶解平衡处理钡中毒的应用对我们的启示:
要使沉淀溶解平衡向着沉淀生成的方向移动,必要条件是 Q > Ksp 。可以增大难溶电解质沉淀溶解平衡系统中有关离子的浓度,使沉淀生成。
北京房山有美丽的石花洞,洞内的自然景观玲珑剔透、绚丽多彩,溶洞是如何形成的呢?
三、沉淀溶解平衡的应用——溶洞的形成
二氧化碳溶解在雨水中使雨水呈酸性。雨水降落到石灰岩土地上,与石灰岩的主要成分碳酸钙发生反应,形成碳酸氢钙。
CaCO3 + H2O + CO2 Ca(HCO3)2
CaCO3(s) Ca2+(aq)+ CO(aq)
如何用沉淀溶解平衡的原理解释?
溶有碳酸氢钙的水从溶洞顶向下滴落时,水分蒸发、二氧化碳压强减小及温度的变化都会使二氧化碳溶解量减小,致使碳酸钙沉淀析出,堆积起来。
Ca2+ + 2HCO CaCO3 + H2O + CO2
大自然经过长期、多次的重复上述两个过程,从而形成各种奇特壮观的溶洞。
四、沉淀溶解平衡的应用——珊瑚的形成
珊瑚的形状千姿百态,颜色鲜艳美丽,不仅可以作装饰品,并且还有很高的药用价值。珊瑚是如何形成的呢?
Ca2+ + 2HCO CaCO3 + H2O + CO2
人口增长人类大规模砍伐森林燃烧煤和其他化石燃料
Ca2+ + 2HCO CaCO3 + H2O + C02
珊瑚死亡面临消失的危机
五、沉淀溶解平衡的应用——工业废水处理
工业上可用难溶的FeS作为沉淀剂除去废水中的Cu2+、Hg2+、Pb2+等重金属离子
为什么可以用难溶物做沉淀剂? 一种难溶性盐可以生成另一种难溶性盐?
我们选用实验室常见的ZnS来进行实验验证
现象:向白色ZnS沉淀中加入CuSO4溶液有黑色的CuS沉淀生成提出疑问:黑色CuS沉淀是如何生成的呢?
1.预测黑色CuS沉淀产生的原因
不成立,加入CuSO4前ZnS沉淀用蒸馏水洗涤2-3次,已经洗去 溶液中过量的S2-及沉淀表面残留的S2-
ZnS(s) Zn2+(aq) + S2-(aq)
+ Cu2+(aq)
预测②:ZnS沉淀溶解产生的S2-与Cu2+生成黑色CuS沉淀
2.ZnS沉淀转化为CuS的定量计算
ZnS(s) Zn2+(aq) + S2-(aq)
Ksp(ZnS)= c(Zn2+)c(S2-)
ZnS沉淀中的硫离子浓度为: c(S2-)=c(Zn2+)=(Ksp)1/2=(1.6×10-24)1/2我们估算一下,硫离子浓度的数量级约为10-12
Ksp=1.6×10-24 ml2L-2
向ZnS中加入0.1ml·L-1的CuSO4
Q(CuS) >> Ksp(CuS)
Q = c(Cu2+)c(S2-)
CuS(s) Cu2+(aq) + S2-(aq) Ksp=1.3×10-36 ml2L-2
Cu2+和S2-的浓度商的数量级约为10-13
ZnS(s) Zn2+(aq) + S2-(aq)
Q > Ksp(CuS生成)
Q < Ksp(ZnS溶解)
ZnS(s)+ Cu2+(aq) CuS(s)+ Zn2+(aq)
通过定量分析我们发现:
小结1.沉淀转化的实质:沉淀溶解平衡的移动。2.沉淀转化的规律:通常,一种沉淀可以转化为更难溶的沉淀两种难溶物的溶解能力差别越大,转化趋势越大。
请运用所学知识判断,向 1 mL 0.1 mlL -1 AgNO3 溶液中依次滴加 1 mL 0.1 mlL -1 的NaCl、NaBr、KI 溶液时会发生什么变化?
1.判断题目中所给物质之间可能存在的化学反应
AgNO3 + NaCl AgCl↓ + NaNO3AgNO3 + NaBr AgBr↓ + NaNO3AgNO3 + KI AgI ↓ + KNO3
2.定量分析水溶液中可能发生的反应
1 mL 0.1 mlL -1 AgNO3 + 1 mL 0.1 mlL -1 NaCl
n(AgNO3):n(NaCl) = 1:1
AgNO3 + NaCl AgCl↓ + NaNO3
预测:AgNO3完全反应,只有白色AgCl生成
3.沉淀转化的原理分析
Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)
通常,一种沉淀可以转化为更难溶的沉淀
Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)
六、水垢中的Mg(OH)2 是怎样生成的
MgCO3和Mg(OH)2中阴、阳离子的个数比不同,属于不同类型的难溶电解质,它们的溶解能力不能直接用Ksp来比较,但可以通过计算各自处于沉淀溶解平衡状态的饱和溶液中的共同离子——Mg2+的浓度来比较。
Mg(OH)2饱和溶液中的 Mg2+ 浓度比 MgCO3饱和溶液中的小,表明 Mg(OH)2更难溶。
天然水中含有 Ca(HCO3)2、Mg(HCO3)2、MgSO4 、CaSO4 、CaCl2、MgCl2 等钙盐和镁盐,在煮沸过程中可发生以下反应:
Ca(HCO3)2 CaCO3 ↓ + CO2 ↑ + H2OMg(HCO3)2 MgCO3 ↓ + CO2 ↑ + H2O
反应生成的MgCO3在水中建立起以下平衡
MgCO3(s) Mg2+ (aq) + CO (aq)
弱酸酸根离子CO 发生水解反应
CO + H2O HCO + OH-
使水中OH-浓度增大,对于 Mg(OH)2 的沉淀溶解平衡 Mg(OH)2 (s) Mg2+ (aq) + 2OH- (aq) Q > Ksp Mg(OH)2生成
因此,持续加热可以使碳酸镁逐渐转化为更难溶的氢氧化镁。这样,水垢的主要成分就成为碳酸钙和氢氧化镁的混合物。 通常家用的自来水在受热过程中会形成水垢,可用食醋除去。食醋的主要成分CH3COOH能与CaCO3和Mg(OH)2分别电离出的CO 和 OH- 发生反应,降低CO 和 OH- 的浓度,使CaCO3 和Mg(OH)2 的沉淀溶解平衡向沉淀溶解的方向移动,使水垢逐渐溶解而将其除去。
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡优秀课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡优秀课件ppt,共21页。PPT课件主要包含了核心素养发展目标,了解沉淀的转化,学习目标,课前导入,交流讨论,沉淀的生成,随堂反馈,实验探究一,沉淀的转化,原理解释等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡试讲课ppt课件: 这是一份苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡试讲课ppt课件,共26页。PPT课件主要包含了课前导入,沉淀溶解平衡,溶度积的应用,溶度积的计算,课堂小结等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖课件ppt,共60页。PPT课件主要包含了内容索引,沉淀转化原理,沉淀转化的应用,课时对点练,AgCl>,AgI>Ag2S,解的AgI,的方向移动,沉淀溶解平衡的移动,溶解能力相对较强等内容,欢迎下载使用。













