





高中鲁科版 (2019)第2节 化学反应的限度优秀ppt课件
展开解:设PCl5的起始浓度为x
在工业生产和实验室中,人们会遇到各种各样的可逆反应,如合成氨的反应:
该反应在一定条件下存在一定的限度。但是在实际生产中,用平衡常数K表示反应限度有时不够直观,不知道反应物到底反应了多少,同时生成了多少产物。因此在实际应用中,常用平衡转化率α来表示一定条件下的反应限度。
平衡时已转化了的某反应物的量(物质的量或浓度)与转化前该反应物的量之比。平衡转化率描述化学反应的限度。
1.平衡转化率的概念:
2.平衡转化率计算公式
物质的平衡转化率越大,表示反应程度越大。对于溶液体系和恒容的气态反应体系,可以用物质的量浓度进行计算。
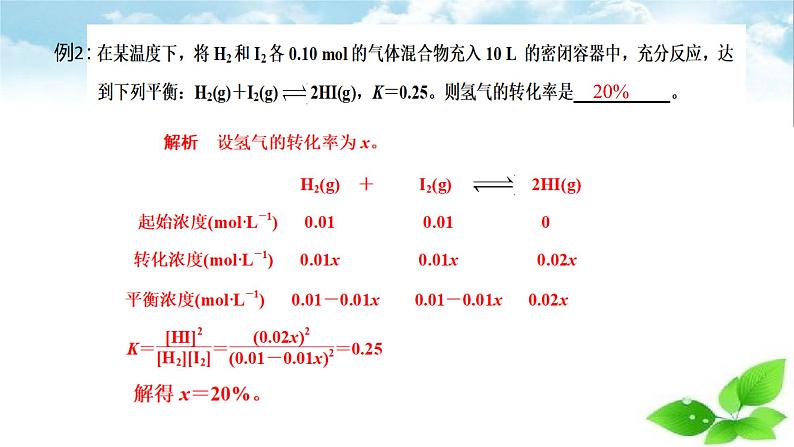
例1:1200℃时测得反应H2(g)+CO2(g)⇌H2O(g)+CO(g)的平衡常数K为2.25。若反应从H2(g)和CO2(g)开始,且H2(g)和CO2(g)的初始浓度均为0.0100ml•L-1时,计算各物质的平衡浓度及H2和CO2的平衡转化率。
解析:设平衡时生成的H2O(g)的浓度为x。 H2(g) + CO2(g) ⇌ H2O(g) + CO(g)初始浓度/(ml·L-1) 0.0100 0.0100 0 0 转化浓度/(ml·L-1) x x x x平衡浓度/(ml·L-1)0.0100-x 0.0100-x x x
K = =
c平(H2) c平(CO2)
(0.0100 ml·L-1-x)2
c平(H2O)c平(CO)
解方程得:x1=0.0060ml·L-1,x2=0.0300ml·L-1x2>c始(H2)不合理,应舍去,则:c平(H2)=c平(CO2)=0.0100ml·L-1-x=0.0100ml·L-1-0.0060ml·L-1=0.0040ml·L-1
α(CO2)= ×100% =
0.0100 ml·L-1-0.0040 ml·L-1
0.0100 ml·L-1
答: c平(H2)和c平(CO2)都是0.0040ml-1·L,c平(H2O)和c平(CO)都是0.0060ml-1·L,H2和CO2的平衡转化率都是60%。
c平(H2O)=c平(CO)=x=0.0060ml·L-1
α(H2)= ×100% =
c始(H2)-c平(H2)
c始(CO2)-c平(CO2)
【点击】 解答化学平衡计算题,要注意构建解题模式,熟练掌握有关物质的量、物质的量浓度、转化率、产率、某组分百分含量、化学平衡常数等各种计算关系式。
平衡浓度的求算 在有关化学平衡的计算中,平衡浓度的求算始非常关键的环节。通常将反应物转化的量设为x,利用已知条件找到关于x的等量关系,然后列方程求解。例如,本题的解题思路为:①设反应物转化的量为x;②用含x的式子表示出各物质的平衡浓度;③通过平衡常数表达式列出方程式;④求解所列方程式。
有关于化学平衡问题的计算,可按一定步骤建立模式,确定各个量之间的关系进行计算。我们把这种方法称为“三段法”。
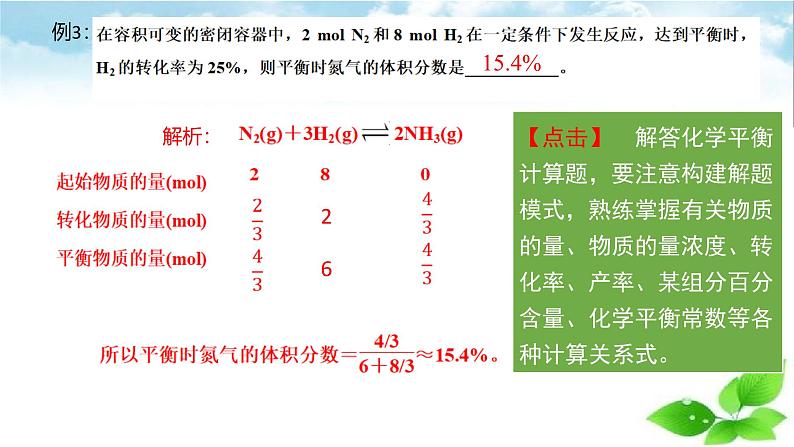
如:可逆反应mA(g)+nB(g) ⇌pC(g)+qD(g),假定反应物A、B的起始加入的物质的量分别为a ml、b ml,达到平衡时,设A物质转化的物质的量为mx ml。(1) mA(g) + nB(g) ⇌ pC(g)+qD(g)初始物质的量/ml a b 0 0转化物质的量/ml mx nx px qx平衡物质的量/ml a-mx b-nx px qx对于反应物:n平=n始-n变对于生成物:n平=n始+n变转化物质的量之比等于化学方程式中各物质系数之比。
③解题设问题:明确了“始”、“变”、“平”三个量的具体数值,再根据相应关系求反应物转化率、平衡时某成分的浓度、反应物转化率等,得出题目答案。
①巧设未知数:具体题目要具体分析,灵活设立,一般设某物质的转化量为x。
②确定三个量:根据反应物、生成物及变化量三者的关系代入未知数确定平衡体系中各物质的起始量、变化量、平衡量并按(1)中“模式”列表。
在1 200 ℃时测得反应CO2(g)+H2(g)⇌CO(g)+H2O(g)达平衡时,K=2.25。试计算CO2(g)和H2(g)的初始浓度分别为下列三种情况下的CO2、H2的平衡转化率,填写下表: 分析上表计算结果,可得出的结论是(1)同一化学反应,不同物质的平衡转化率 。(2)增大H2的浓度,CO2转化率的变化是 ,H2转化率的变化是 。(3)减小H2的浓度,CO2转化率的变化是 ,H2转化率的变化是 。
(3)对任意化学反应aA(g)+bB(g)cC(g)+dD(g),若A、B的起始浓度之比为a∶b,则α(A)=α(B)。
(1)平衡常数和平衡转化率都能定量表示化学反应的限度。平衡常数只与温度有关,而平衡转化率的影响因素有温度、浓度、压强等。
(2)对某一个具体反应,在温度一定时,只有一个化学平衡常数;但不同反应物的平衡转化率可能不同。故必须指明是哪一反应物的平衡转化率。
(2)C0(NO2)=0.3ml/L
化学选择性必修1第2节 化学反应的限度完美版ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4002581_t3/?tag_id=26" target="_blank">第2节 化学反应的限度完美版ppt课件</a>,文件包含22化学反应的限度第4课时压强对化学平衡的影响2019鲁科版选修1化学反应原理pptx、压强对化学平衡的影响mp4等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率第2节 化学反应的限度评优课ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002581_t3/?tag_id=26" target="_blank">第2章 化学反应的方向、 限度与速率第2节 化学反应的限度评优课ppt课件</a>,文件包含22化学反应的限度第3课时浓度温度对化学平衡的影响2019鲁科版选修1化学反应原理pptx、浓度对化学平衡的影响mp4、温度对化学平衡的影响mp4等3份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
鲁科版 (2019)选择性必修1第2节 化学反应的限度完美版课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002581_t3/?tag_id=26" target="_blank">第2节 化学反应的限度完美版课件ppt</a>,共17页。PPT课件主要包含了温故知新,v正=v逆≠0,联想•质疑,交流•研讨,相同是个常数,学习探究,化学平衡常数,交流•讨论,互为倒数单位不同,夯实基础等内容,欢迎下载使用。













