




人教版 (新课标)选修4 化学反应原理第二节 化学电源精品课件ppt
展开第四章 电化学基础
[单位:(w·h/kg),(w·h/L)]
指电池单位质量或单位体积所能输出电能的多少。
[单位:(W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小。
③ 电池的可储存时间的长短
一般情况,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
Zn+2MnO2+2NH4Cl =2MnOOH+ZnCl2+2NH3
Zn-2e- =Zn2+ (氧化反应)
2MnO2+2NH4+ +2e- =2MnOOH+2NH3 (还原反应)
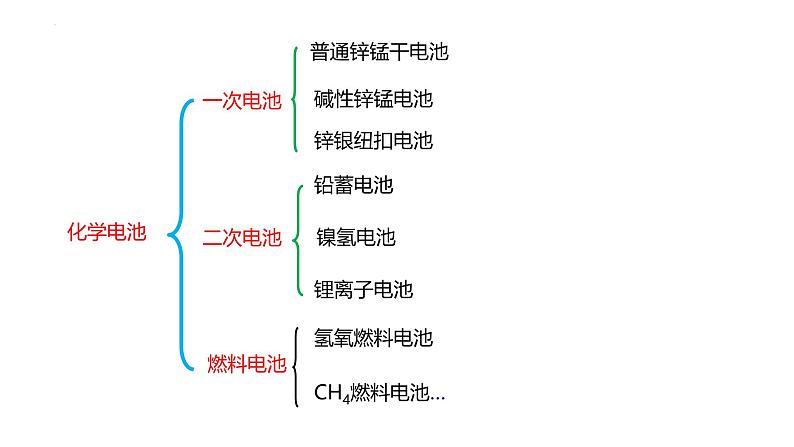
活性物质(发生氧化还原反应的物质)消耗到一定程度,就不能使用的电池叫一次电池,也叫干电池。
优点:制作简单,价格便宜;缺点:放电时间短,电压下降快;容易漏液(锌外壳变薄)
Zn+2OH- -2e- =Zn(OH)2
2MnO2+2H2O+2e-=2MnOOH+2OH-
碱性锌锰电池构造示意图
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
多数只能一次使用,不能充电;价格较贵
比能量和储存时间有所提高,适用于大电流和连续放电
【资料】1.锌银纽扣电池
Zn为负极,Ag2O为正极
Zn+2OH- -2e-=Zn(OH)2
Ag2O+2e-+H2O=2Ag+2OH-
Zn+Ag2O+H2O=Zn(OH)2+2Ag
优点:比能量大、电压稳定,储存时间长,适宜小电流连续放电。广泛用于电子手表、照相机、计算器和其他微型电子仪器。
2.锂电池 锂电池是负极为Li的电池(正极可以是MnO2、CuO、FeS2等)。锂电池的比能量高、电压高、工作温度宽,可储存时间长。
【小试牛刀】微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为: Zn+2OH--2e-=Zn(OH)2 Ag2O+H2O+2e-=2Ag+2OH- 总反应为Ag2O+Zn+H2O=Zn(OH)2+2Ag 根据上述反应式,判断下列叙述中正确的是( ) A.在使用过程中,电池负极区溶液的pH增大 B.在使用过程中,电子由Ag2O经外电路流向Zn极 C.Zn是负极,Ag2O是正极 D.Zn极发生还原反应,Ag2O极发生氧化反应
电解质:H2SO4溶液
铅蓄电池为典型的可充电电池,其电极反应分为放电和充电两个过程
Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
Pb(s)+SO42- (aq)-2e- =PbSO4 (s)
PbO2(s)+4H+(aq)+SO42- (aq)+2e-=PbSO4 (s)+2H2O(l)
铅蓄电池充电的反应则是上述反应的逆过程
PbSO4 (s)+2e- =Pb(s)+SO42- (aq)
2PbSO4 (s)+2H2O(l)-2e-=PbO2(s)+H+(aq)+SO42-(aq)
2PbSO4(s)+2H2O(l)=Pb(s)+PbO2(s)+2H2SO4(aq)
铅蓄电池的充放电过程:
比能量低、笨重、废弃电池污染环境
可重复使用、电压稳定、使用方便、安全可靠、价格低廉
充电时,铅酸蓄电池正极与直流电源正极相连,负极与直流电源负极相连。即“负极接负极,正极接正极”。
【小试牛刀】铅酸电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程式为: Pb+PbO2+2H2SO4=2PbSO4+2H2O 按要求回答下列问题: (1)负极材料是____,正极材料是______,电解质溶液是_______。 (2)工作时,电解质溶液中的H+移向___________极。 (3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。
2H2-4e-=4H+
O2+4H++4e- =2H2O
2H2+4OH-+4e-=4H2O
O2+2H2O+4e-=4OH-
2H2-4e-+2O2-=2H2O
O2+4e-=2O2-
【小试牛刀】据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢为燃料,空气为氧化剂,铂做催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( ) ①正极反应为:O2 + 4H+ + 4e- = 2H2O ②负极反应为:2H2-4e- = 4H+ ③总的化学反应为:2H2 + O2 = 2H2O ④氢离子通过电解质向正极移动 A.①②③ B.②③④ C.①②④ D.①②③④
CH4 + 2O2 = CO2+ 2H2O
CH4 - 8e- + 2H2O = CO2 +8H+
2O2 + 8e- + 8H+ = 4H2O
CH4 + 2O2 + 2OH- = CO32- + 3H2O
CH4 + 10OH- - 8e- = CO32- + 7H2O
2O2 + 4H2O + 8e- = 8OH-
CH4 - 8e-+ 4O2- = CO2 + 2H2O
2O2 + 8e- = 4O2-
CH4 - 8e-+ 4CO32- = 5CO2 + 2H2O
2O2 + 8e- + 4CO2 = 4CO32-
【小试牛刀】书写甲醇(CH3OH)燃料电池的酸性、碱性环境下的电极反应式
酸性总反应:2CH3OH + 3O2=2CO2+4H2O正极:3O2 + 12e-+12H+ =6H2O负极:2CH3OH - 12e- +2H2O=12H+ +2CO2
碱性总反应:2CH3OH + 3O2 +4OH-=2CO32-+6H2O正极:3O2 + 12e-+6H2O=12OH-负极:2CH3OH - 12e- +16OH-=2CO32-+12H2O
①氧化剂与还原剂在工作时不断补充②反应产物不断排出③能量转化率高(超过80%),普通的只有30%,有利于节约能源缺点:体积较大、附属设备较多优点:能量转换率高、清洁、对环境好
3.燃料电池与前几种电池的区别
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
【小试牛刀】航天技术上使用的氢氧燃料电池具有高能、轻便、无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的总反应都可以表示为2H2+O2=2H2O,酸式电池中电解质是酸,其负极反应可表示为2H2-4e-=4H+ ,则其正极反应式为 。碱式电池的电解质是碱,其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应可表示为 。
O2+4e-+4H+=2H2O
2H2-4e-+4OH-=4H2O
①燃料做负极,助燃剂氧气为正极②电极材料一般不参加化学反应,只起传导电子的作用
用于“神六”的太阳能电池
减 少 污 染节 约 资 源
1.下列有关电池的说法不正确的是( ) A.手机上用的锂离子电池属于二次电池 B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 C.甲醇燃料电池可把化学能转化为电能 D.锌锰干电池中,锌电极是负极
2.(双选)一种新型燃料电池,一极通入空气,另一极通入CO气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该燃料电池说法正确的是( ) A.电池的总反应是:2CO+O2=2CO2 B.在熔融电解质中,O2-由负极移向正极 C.通入空气一极是正极,电极反应为:O2+4e- = 2O2- D.通入CO—极是正极,电极反应为:2CO -4e- +O2- = 2CO2
3.一种新型的二次电池锌—空气燃料电池,以KOH溶液为电解液,放电时的总反应为:2Zn+O2+4OH-+2H2O=2Zn(OH)42-。关于该装置的说法正确的是( ) A.充电时,锌电极接外电源的负极 B.充电时,电解质溶液中c(OH-)逐渐减小 C.放电时,负极反应为:Zn-2e-+4H2O=Zn(OH)42-+4H+ D.放电时,电路中每通过4ml电子,则消耗氧气22.4 L
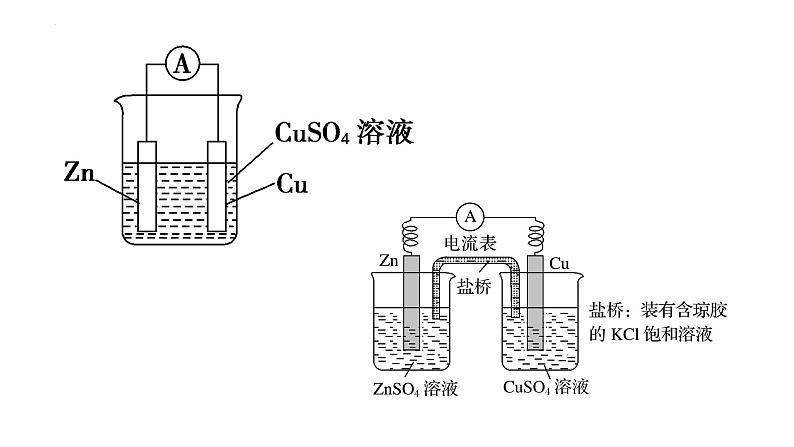
高中化学人教版 (新课标)选修4 化学反应原理第一节 原电池精品ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理<a href="/hx/tb_c22176_t3/?tag_id=26" target="_blank">第一节 原电池精品ppt课件</a>,文件包含41原电池-2022-2023学年高二化学同步精品课堂人教版选修4原卷版docx、41原电池-2022-2023学年高二化学同步精品课堂人教版选修4解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第一节 原电池一等奖ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理<a href="/hx/tb_c22176_t3/?tag_id=26" target="_blank">第一节 原电池一等奖ppt课件</a>,共24页。PPT课件主要包含了形形色色的电池,种类繁多的用电器,组织建设,第一节原电池,发生氧化反应,铜锌原电池,电解质溶液,发生还原反应,阴离子移向,阳离子移向等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第四节 化学反应进行的方向优秀ppt课件: 这是一份人教版 (新课标)选修4 化学反应原理<a href="/hx/tb_c22167_t3/?tag_id=26" target="_blank">第四节 化学反应进行的方向优秀ppt课件</a>,共20页。PPT课件主要包含了组织建设,ΔG=ΔH-TΔS,课堂小结等内容,欢迎下载使用。













