



高中人教版 (新课标)第三节 电解池精品ppt课件
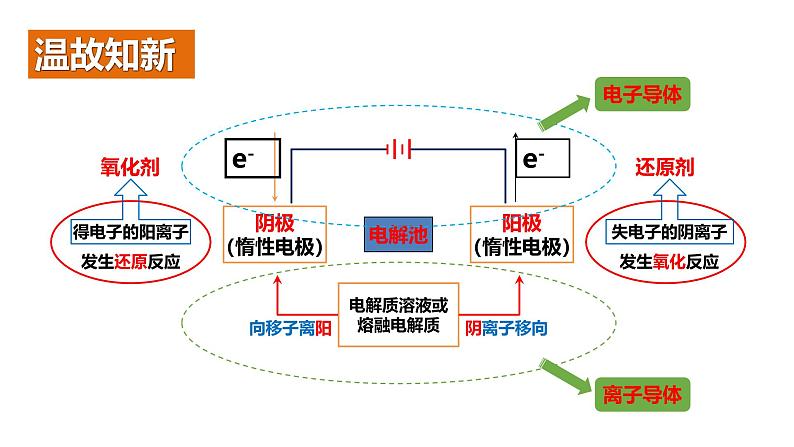
展开电解质溶液或熔融电解质
第三节 电解池(第2课时 电解原理的运用)
第四章 电化学基础
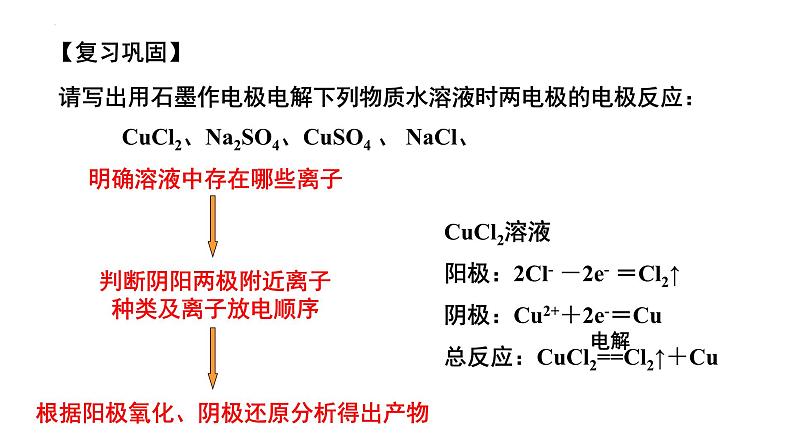
2Cl—-2e—=Cl2 ↑
2H++2e —=2H2 ↑
2 NaCl+2H2O ===2NaOH+H2↑+Cl2 ↑
电解饱和食盐水:制烧碱、氯气和氢气
阴极——产生H2 和酚酞变红
(使湿润的KI-淀粉试纸变蓝)
或:2H2O+2e- =H2↑+2OH-
问题:电解一段时间后,溶液浓度、pH如何变化?如何恢复?
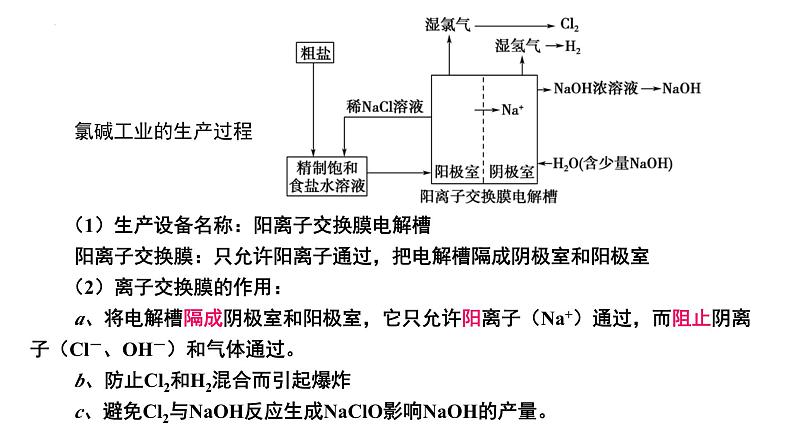
1.电解饱和食盐水制烧碱、氯气和氢气
(1)生产设备名称:阳离子交换膜电解槽 阳离子交换膜:只允许阳离子通过,把电解槽隔成阴极室和阳极室 (2)离子交换膜的作用: a、将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和气体通过。 b、防止Cl2和H2混合而引起爆炸 c、避免Cl2与NaOH反应生成NaClO影响NaOH的产量。
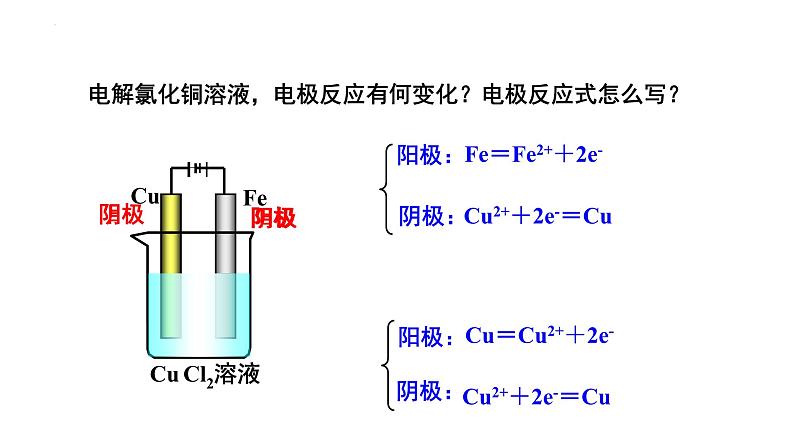
Fe=Fe2++2e-
Cu2++2e-=Cu
电解氯化铜溶液,电极反应有何变化?电极反应式怎么写?
Cu=Cu2++2e-
利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的过程
电镀材料的选择(电镀铜)
电镀液——含有镀层金属离子的溶液
使金属增强抗腐蚀的能力,增加美观和表面硬度
阳极本身参加电极反应;电解质溶液的浓度保持不变
Cu-2e-=Cu2+
Cu2+ +2e-=Cu
电解精炼铜后CuSO4溶液的浓度略有减小
阳极: Zn-2e-=Zn2+ Fe-2e-=Fe2+ Ni-2e-=Ni2+ Cu-2e-=Cu2+ Ag、Au(不放电,形成阳极泥)阴极:Cu2++2e-=Cu
阳极:粗铜 (Zn、Fe、Ni、Cu、Ag、Au等) 阴极:纯铜电解液: CuSO4溶液(或CuCl2)
——用电镀的方法把铜镀到纯铜板上
利用电解熔融盐或氧化物的方法来冶炼活泼金属Na、Ca、Mg、Al等。
4.电冶金:电解法冶炼活泼金属 K~Al
【小结】K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
【小试牛刀】工业上采用Fe、C为电极电解K2MnO4溶液制KMnO4。电解时应以 作阴极,电解过程中阴极附近溶液pH将会 ,阳极反应式为 ,总电解反应式为 。
MnO42-→MnO4- + e-
——制烧碱、H2、Cl2——保护金属、增强其抗腐蚀能力——制高纯度的铜——制较活泼的金属
1.下列关于图示四个装置的叙述不正确的是( )
A.装置甲是可以在铁钉上镀铜的装置B.若装置乙为电解精炼铜装置,则X电极为精铜C.装置丙的a端产生的气体能使湿润的淀粉碘化钾试纸变蓝D.装置丁接通电源后可以观察到白色沉淀迅速变成灰绿色,最终变红褐色
2.下图所示装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色。下列说法正确的是( )
A.X是负极,Y是正极B.Pt是阴极,Cu是阳极C.CuSO4溶液的pH逐渐减小D.CuSO4溶液的pH不变
3.粗铜中含有杂质,用下图装置精炼铜。下列有关说法正确的是( )A.a 是粗铜、b 是纯铜B.反应前后CuSO4 电解液的浓度保持不变C.阴极电极反应为:Cu2++2e-=CuD.电解过程中,a、b两极质量的变化量一直相等
阴极:Ag++e-→Ag
阳极:2Cl-→Cl2↑+2e-
4.通电5min后,电极5质量增加2.16g,请回答: (1)a 为 极 C池 池电极2反应: 电极5反应: (2)若B槽中共收集到224mL气体(标况),且溶液体积为200mL(设电解过程中溶液体积不变),则通电前溶液中的Cu2+物质的量浓度为 。 (3)若A池溶液体积为200mL,且电解过程中溶液体积不变,则电解后,溶液pH为 。
0.025ml·L-1
化学选修4 化学反应原理第四节 难溶电解质的溶解平衡获奖课件ppt: 这是一份化学选修4 化学反应原理<a href="/hx/tb_c22173_t3/?tag_id=26" target="_blank">第四节 难溶电解质的溶解平衡获奖课件ppt</a>,文件包含34难溶电解质的溶解平衡第2课时沉淀反应的应用-2022-2023学年高二化学同步精品课堂人教版选修4原卷版docx、34难溶电解质的溶解平衡第2课时沉淀反应的应用-2022-2023学年高二化学同步精品课堂人教版选修4解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中人教版 (新课标)第四节 难溶电解质的溶解平衡优质课件ppt: 这是一份高中人教版 (新课标)<a href="/hx/tb_c22173_t3/?tag_id=26" target="_blank">第四节 难溶电解质的溶解平衡优质课件ppt</a>,共27页。PPT课件主要包含了组织建设,沉淀法,沉淀的生成,1加沉淀剂,工业废水,3同离子效应法,沉淀反应的应用,沉淀的溶解,常用方法,H2S等内容,欢迎下载使用。
高中人教版 (2019)第二节 电解池背景图课件ppt: 这是一份高中人教版 (2019)第二节 电解池背景图课件ppt,共43页。PPT课件主要包含了目录索引等内容,欢迎下载使用。













