






- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第3课时 中和反应的反应热及其测量) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.1 化学反应速率 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.2 影响化学反应速率的因素(第1课时 有效碰撞理论 浓度、压强对化学反应速率的影响) 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.2 影响化学反应速率的因素(第1课时 有效碰撞理论 浓度、压强对化学反应速率的影响) 课后练习 试卷 0 次下载
- 人教版 (新课标)选修4 化学反应原理 2.2 影响化学反应速率的因素(第2课时 温度、催化剂对化学反应速率的影响) 课件 0 次下载
高中化学人教版 (新课标)选修4 化学反应原理第一节 化学反应速率获奖课件ppt
展开你知道下列化学变化进行得快还是慢?
你了解了以下反应进行的快慢吗?
化学反应的快慢是相对的!
反应物本身的性质决定了这些化学反应速率的相对大小!
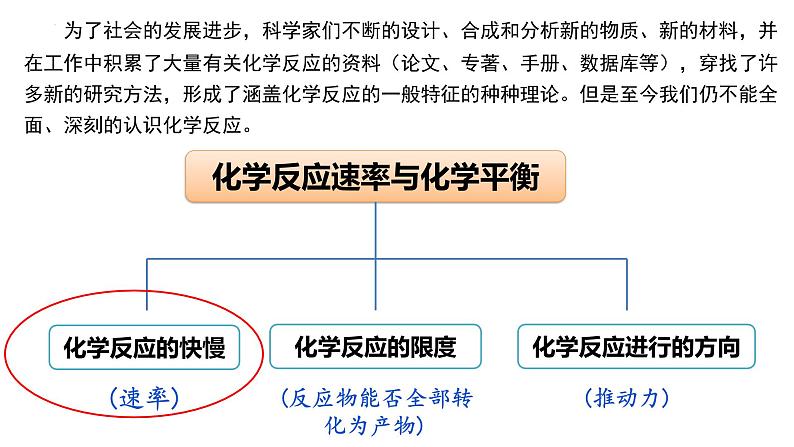
第二章 化学反应速率与化学平衡
不同的化学反应快慢是不一样的。怎样比较和描述不同反应的快慢呢?
“化学反应速率”是用来衡量化学反应进行快慢程度的一个物理量。
用单位时间内反应物浓度的减小或生成物浓度的增大来表示
1、含义:用来衡量化学反应进行快慢的物理量。
ml/(L·s)
理解化学反应速率的表示方法时应注意的几个问题:
1.上述化学反应速率是平均速率,而不是瞬时速率。
2.无论浓度的变化是增加还是减少,一般都取正值,所以化学反应速率一般为正值。
3.由于在反应中固体和纯液体的浓度是恒定不变的,因此对于有纯液体或固体参加的反应一般不用纯液体或固体来表示化学反应速率。
4.对于同一个反应来说,用不同的物质来表示该反应的速率时,其数值不一定相同,但每种物质都可以用来表示该反应的快慢。因此,表示化学反应速率时,必须指明是用反应体系中的哪种物质做标准。
5.在同一个反应中,各物质的反应速率之比等于方程式中的系数比。
【再来一刀】向4L容器中充入0.7mlSO2和0.4mlO2,4s末测得剩余SO2是0.3ml,则v(SO2)=____________.
【小试牛刀】在某一化学反应里,反应物A的浓度在10s内从4.0ml/L变成1.0ml/L,在这10s内A的化学反应速率为___________.
计算化学反应速率的步骤:
起始浓度c(起始)变化浓度Δ c终了浓度c(终了) ---- 三部曲
计算中注意以下量的关系:①对反应物:c(起始)-c(转化)=c(某时刻)
②对生成物:c(起始)+c(转化)=c(某时刻)
【再来一刀】在密闭容器中,合成氨的反应,刚开始时氮气为8ml/L与氢气的浓度为20ml/L,5min后,测得容器内生成的氮气的浓度为6ml/L。用N2、H2、NH3的浓度变化表示的反应速率。
8 20 0
6 4
v(N2)=△c/△t= 2ml/L/5min = 0.4ml/(L·min)v(H2) =△c/△t = 6ml/L / 5min = 1.2ml/(L·min)v(NH3) =△c/△ t = 4ml/L / 5min = 0.8 ml/(L·min)
vml/(L·min)
0.4 1.2 0.8
【思考】以上三者数值是否相等?是否矛盾?有何规律?
在同一个反应中,各物质的反应速率之比等于方程式中的化学计量数(系数)之比,即: v(N2): v(H2): v(NH3)=1 :3 :2
【小试牛刀】(双选)反应4NH3+5O2=4NO+6H2O 在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3ml,则此反应的平均速率可表示为 ( ) A、v(O2)=0.01 ml/(L·s) B、v(NO)=0.008 ml/(L·s) C、v(H2O)=0.003 ml/(L·s ) D、v(NH3)=0.002 ml/(L·s )
v(NO)=0.3/(5×30)=0.002 ml/(L·s)
反应速率之比等于化学计量数之比
【再来一刀】在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是( ) A、v(H2)=0.1 ml·L-1·min-1 B、v(N2)=0.2 ml·L-1·min-1 C、v(NH3)=0.15 ml·L-1·s-1 D、v(H2)=0.3 ml·L-1·min-1
【温馨提示】比较时需要统一物质、统一单位
二、化学反应速率的测量
1、化学反应测量的基本思路化学反应速率是通过实验测得的。化学反应中发生变化的是体系中的化学物质,故与其中任何一种化学物质的浓度或质量相关的性质在测量反应速率时都可以加以利用。
2、用与化学反应速率测量的物质的性质●可直接观察的性质:释放出气体的体积、体系的压强●依靠仪器测量的性质:如颜色的深浅、光的吸收、光的发射●在溶液中,当反应物或产物本身有比较明显的颜色时,可以利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应速率。
【实验2-1】按图安装两套装置,在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL 1ml/L和40mL 4ml/L的硫酸,比较二者收集10mLH2所用的时间。把实验结果填入下表:
1、测量溶液中的H+的浓度的变化2、测量溶液中的Zn2+的浓度变化3、测量氢气的体积或氢气的质量的变化4、测量体系的压强的变化5、测量锌粒的质量的变化6、测量溶液的导电能力的变化7、测量反应体系的热量变化
你还能根据反应速率相关量的哪些变化来测定反应的反应速率?
1、某温度下,浓度都是1ml/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过tmin后,测得物质的量浓度分别为:c(X2)=0.4ml/L,c(Y2)=0.8ml/L;且t min后容器内的压强变为原来的4/5,则该反应的反应方程式可表示为:
3X2 + Y2 = 2Z
2、某温度时,在2L容器中,x、y、z三种物质随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式是:_________,反应开始至2min,z的平均速率是 。
0.05ml/(L·min)
3、一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
A、反应开始到10 s,用Z表示的反应速率为 0.158 ml·L-1·s-1B、反应开始到10 s,X的物质的量浓度减少了0.79 ml·L-1C、反应开始到10 s时,Y的转化率为79.0%D、反应的化学方程式为:X(g)+Y(g)Z(g)
4、某温度时,在密闭容器中,A、B、C三种气体物质的物质的量随时间变化的曲线图。
②2min内A、B、C三者的反应速率之比_________化学方程式是_____________
3A+2B 3C
①反应物是______ 生成物是______。
③2min内A的转化率______
高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池集体备课ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池集体备课ppt课件,共35页。PPT课件主要包含了探究一,探究二,探究三等内容,欢迎下载使用。
高中人教版 (新课标)第二节 影响化学反应速率的因素评课课件ppt: 这是一份高中人教版 (新课标)第二节 影响化学反应速率的因素评课课件ppt,共25页。PPT课件主要包含了探究一,探究二等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第三节 电解池课文课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第三节 电解池课文课件ppt,共32页。PPT课件主要包含了第1课时电解原理,探究一,探究二等内容,欢迎下载使用。













