



还剩17页未读,
继续阅读
成套系列资料,整套一键下载
人教版 (新课标)选修4 化学反应原理 第三章 水溶液中的离子平衡 章末归纳与整理
展开
这是一份人教版 (新课标)选修4 化学反应原理 第三章 水溶液中的离子平衡 章末归纳与整理,共25页。
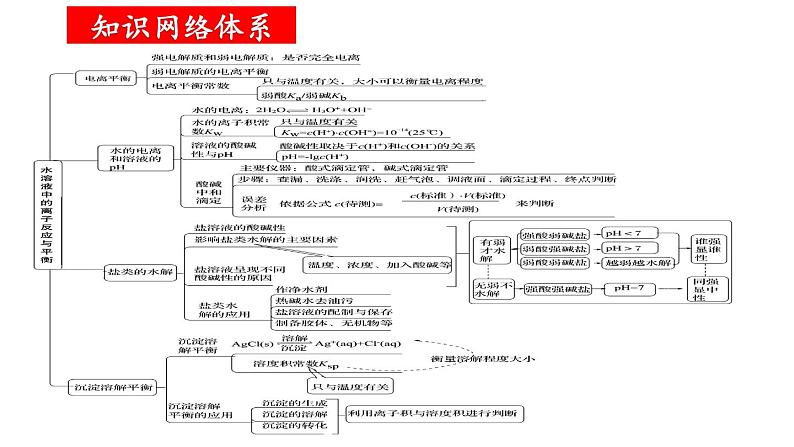
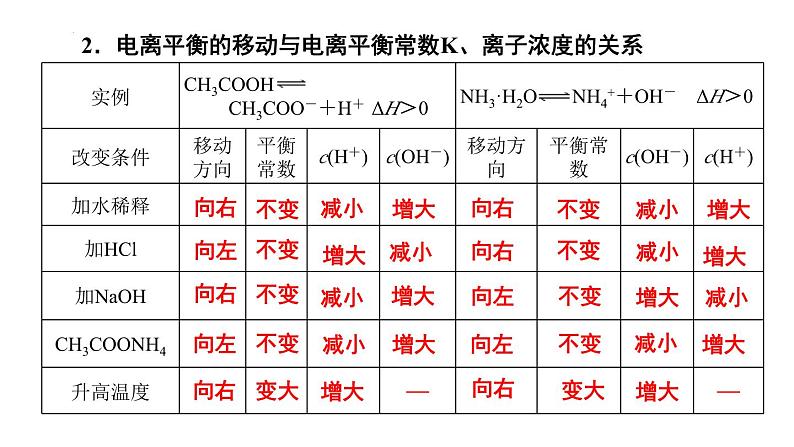
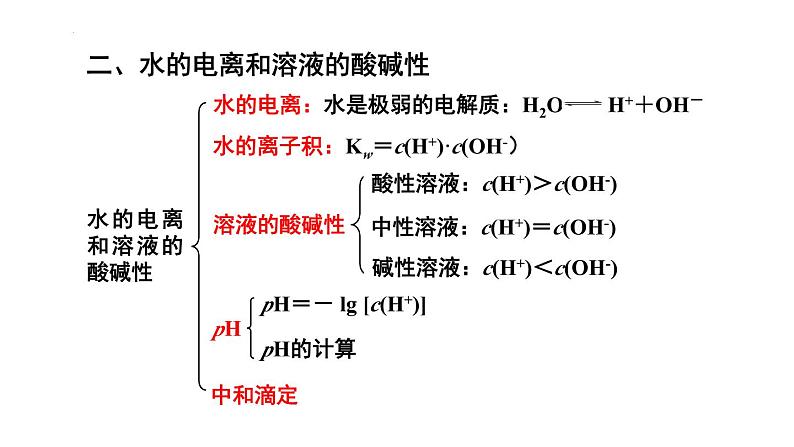
组织建设第三章 水溶液中的离子平衡章末归纳与整理知识网络体系重点知识探究一、弱电解质的电离 1.弱电解质的电离平衡特点及外界条件的影响规律 (1)电离平衡也是一种动态平衡,当溶液的温度、浓度改变时,电离平衡都会发生移动,符合勒夏特列原理,其规律是 (2)外界条件的影响规律: ①浓度:浓度越大,电离程度越小。在稀释溶液时,电离平衡向右移动,而离子浓度一般会减小; ②温度:温度越高,电离程度越大。因电离是吸热过程,升温时平衡向右移动; ③同离子效应:如向醋酸溶液中加入醋酸钠晶体,增大了CH3COO-的浓度,平衡左移,电离程度减小;加入稀盐酸,平衡也会左移。 ④能反应的物质:如向醋酸溶液中加入锌或NaOH溶液,平衡右移,电离程度增大。 (3)电离平衡常数:以CH3COOH为例,K=c(CH3COO-)·c(H+)/c(CH3COOH),K 的大小可以衡量弱电解质电离的难易,K只与温度有关。对多元弱酸(以H3PO4为例)而言,它们的电离是分步进行的,电离常数分别为K1、K2、K3,它们的关系是K1≫K2≫K3,因此多元弱酸的强弱主要由K1的大小决定。2.电离平衡的移动与电离平衡常数K、离子浓度的关系向右向左向右向左向右不变不变不变变大减小增大减小减小增大增大减小增大增大向右向右向左向左向右不变不变不变不变变大减小减小增大减小增大增大增大减小增大不变 【例题1】(2022·北京·人大附中高二阶段练习)下列实验事实或数据可以说明次氯酸为弱电解质的是( ) A.次氯酸具有漂白性 B.25℃时,次氯酸的水溶液的pH<7 C.用HClO溶液做导电实验时,灯泡很暗 D.0.001mol∙L-1的HClO溶液的pH=5.6 D 【对应训练】下列事实能说明亚硝酸是弱电解质的是( ) ①亚硝酸溶液中存在HNO2分子,呈酸性;②用HNO2溶液做导电性实验,灯泡很暗;③HNO2溶液不与Na2SO4溶液反应;④0.1 mol·L-1HNO2溶液中,c(H+)=0.015 mol·L-1;⑤相同浓度时,HNO2的导电能力比HCl弱 A. ①②③ B. ②③④ C. ①④⑤ D. ①②④⑤C二、水的电离和溶液的酸碱性1.溶液的酸碱性规律:取决于溶液中c(H+)和c(OH-)的相对大小:2.酸碱中和滴定过程中的溶液的pH变化规律:在中和反应中,溶液pH发生很大的变化,在滴定过程中会因pH突变而使指示剂发生颜色变化(滴定曲线如图)。 通过溶液的颜色变化判断反应终点,测出消耗酸(或碱)溶液的体积,根据化学方程式中酸与碱物质的量之比求出未知溶液的浓度。对于一元酸碱,则有:c酸·V酸=c碱·V碱。 【例题2】(2022·全国·高二课时练习)以酚酞试液作指示剂,对某新制NaOH溶液进行中和滴定实验,数据记录如下表:则该新制的NaOH溶液的浓度c(mol·L-1)计算合理的是( )A.c=0.01×(V1+V2+V3)/(3×20)B.c=0.01×(V1+V2)/(2×20)C.c=0.01×(V1+V3)/(2×20)D.c=0.01×V1/20 B 【对应训练】室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lgc(OH-)。下列说法正确的是( ) A.M点所示溶液中: c(NH4+)+c(NH3·H2O)=c(Cl-) B.N点所示溶液中溶质一定含NH4Cl,可能还含HCl C.Q点消耗盐酸的体积等于氨水的体积 D.Q点所示溶液中c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)B三、盐类的水解1.盐溶液的酸碱性规律: 2.盐类水解规律: ①有弱才水解--必须含有弱酸或弱碱的离子才能发生水解; ②无弱不水解--强酸强碱盐不发生水解; ③谁弱谁水解--发生水解的是弱碱阳离子或弱酸根阴离子; ④谁强显谁性--组成盐的酸根阴离子(碱性阳离子)是强酸根(强碱的阳离子),则显酸(碱)性; ⑤都弱都水解--弱酸弱碱盐因阴、阳离子都能发生水解且两水解过程可相互促进,所以水解程度较大,少数可以完全水解,称为双水解反应; ⑥越弱越水解--组成盐的酸根对应的酸(即水解生成的酸)酸性越弱(或阳离子对应的碱的碱性越弱),水解程度就越大,此即“越弱越水解”规律。 【例题3】(2022·广东斗门一中期中)常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )A.等浓度的CH3COOH 和HClO溶液,pH小的是HClOB.Na2CO3和NaHCO3溶液中粒子种类不同C.溶液水的电离程度:①>②>④>③D.NaHCO3溶液中:c(Na+)=c(CO32- )+c(HCO3- )+c(H2CO3) D【对应训练】今有室温下四种溶液,下列有关叙述不正确的是( )A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 B.②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-) C.分别加水稀释10倍,四种溶液的pH:①>②>④>③ D.V1 L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2D四、难溶电解质的溶解平衡 1.难溶电解质的溶解平衡:难溶电解质在水中会建立如下平衡:MmAn(s) mMn+(aq)+nAm-(aq)。因此,难溶电解质的溶解度虽然很小,但不可能为零(完全不溶解),溶液中的离子结合成难溶电解质时,也不可能完全进行到底。勒夏特列原理同样适用于溶解平衡。 2.溶度积[MmAn(s) mMn+(aq)+nAm-(aq)为例]: ①固体纯物质不列入平衡常数,其溶度积为Ksp=[c(Mn+)]m·[c(Am-)]n,AgCl的Ksp=c(Ag+)·c(Cl-)。对于相同类型的物质,Ksp的大小反映了难溶电解质在溶液中溶解能力的大小,也反映了该物质在溶液中沉淀的难易。与平衡常数一样,Ksp与温度有关。不过温度改变不大时,Ksp变化也不大,常温下的计算可不考虑温度的影响。 ②通过比较溶度积Ksp与溶液中有关离子的离子积Qc的相对大小,可以判断难溶电解质在给定条件下能否生成沉淀或溶解。如AgCl溶液的Qc=c(Ag+)·c(Cl-),该计算式中的离子浓度不一定是平衡浓度,而Ksp计算式中的离子浓度一定是平衡浓度。 若Qc>Ksp,则溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。 若Qc=Ksp,则溶液饱和,沉淀与溶解处于平衡状态。 若Qc<Ksp,则溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。 (3)沉淀溶解平衡的应用: ①化学上通常认为溶液中的剩余离子浓度小于1×10-5 mol·L-1时就沉淀完全。 ②根据溶度积规则,使沉淀溶解的必要条件是Qc<Ksp,因此创造条件使溶液中有关离子的浓度降低,就能达到此目的。途径一是使相关离子生成弱电解质,如要使ZnS溶解,可以加盐酸;途径二是使相关离子被氧化,如CuS在盐酸中不能溶解,但在HNO3中可以溶解。反应的离子方程式为3CuS+2NO3-+8H+=3Cu2++2NO↑+3S↓+4H2O。 ③若一种沉淀剂可使溶液中多种离子沉淀时,则可以控制条件,使这些离子先后分别沉淀,这种现象称为分步沉淀。 【规律】A.同一类型的沉淀,Ksp越小越先沉淀,且Ksp相差越大分步沉淀越完全,如AgCl、AgBr、AgI。B.不同类型的沉淀,其沉淀的先后顺序要通过计算才能确定,如AgCl和Ag2CrO4。 ④若难溶电解质类型相同,则Ksp较大的沉淀易于转化为Ksp较小的沉淀。但要注意的是通过改变外界条件,利用勒夏特列原理也可以使溶解度小的沉淀转化成溶解度大的沉淀。 A.易溶物向难溶物转化:如向BaCO3沉淀中加入Na2CrO4溶液,将会发现白色的BaCO3沉淀逐渐转化成黄色的BaCrO4沉淀。 B.难溶物向易溶物转化:如BaSO4沉淀转化为BaCO3沉淀的反应为BaSO4(s)+CO32- BaCO3(s)+SO42-,K=c(SO42-)/c(CO32-)=Ksp(BaSO4)/Ksp(BaCO3)=(1.07×10-10)/2.58×10-9≈1/24,虽然平衡常数小,转化不彻底,但只要c(CO32-)比c(SO42-)大24倍以上,经多次转化,即能将BaSO4转化为BaCO3。 【例题4】常温下,用AgNO3溶液分别滴定浓度均为0.0lmol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。巳知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( ) A.n点表示Ag2C2O4的不饱和溶液 B.图中X线代表的AgCl C.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为109.04 D.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 D 【对应训练】下列说法不正确的是( ) A.Ksp只与难溶电解质的性质和温度有关 B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 C.其他条件不变,离子浓度改变时,Ksp不变 D.难溶电解质的Ksp越小,溶解度越小D
组织建设第三章 水溶液中的离子平衡章末归纳与整理知识网络体系重点知识探究一、弱电解质的电离 1.弱电解质的电离平衡特点及外界条件的影响规律 (1)电离平衡也是一种动态平衡,当溶液的温度、浓度改变时,电离平衡都会发生移动,符合勒夏特列原理,其规律是 (2)外界条件的影响规律: ①浓度:浓度越大,电离程度越小。在稀释溶液时,电离平衡向右移动,而离子浓度一般会减小; ②温度:温度越高,电离程度越大。因电离是吸热过程,升温时平衡向右移动; ③同离子效应:如向醋酸溶液中加入醋酸钠晶体,增大了CH3COO-的浓度,平衡左移,电离程度减小;加入稀盐酸,平衡也会左移。 ④能反应的物质:如向醋酸溶液中加入锌或NaOH溶液,平衡右移,电离程度增大。 (3)电离平衡常数:以CH3COOH为例,K=c(CH3COO-)·c(H+)/c(CH3COOH),K 的大小可以衡量弱电解质电离的难易,K只与温度有关。对多元弱酸(以H3PO4为例)而言,它们的电离是分步进行的,电离常数分别为K1、K2、K3,它们的关系是K1≫K2≫K3,因此多元弱酸的强弱主要由K1的大小决定。2.电离平衡的移动与电离平衡常数K、离子浓度的关系向右向左向右向左向右不变不变不变变大减小增大减小减小增大增大减小增大增大向右向右向左向左向右不变不变不变不变变大减小减小增大减小增大增大增大减小增大不变 【例题1】(2022·北京·人大附中高二阶段练习)下列实验事实或数据可以说明次氯酸为弱电解质的是( ) A.次氯酸具有漂白性 B.25℃时,次氯酸的水溶液的pH<7 C.用HClO溶液做导电实验时,灯泡很暗 D.0.001mol∙L-1的HClO溶液的pH=5.6 D 【对应训练】下列事实能说明亚硝酸是弱电解质的是( ) ①亚硝酸溶液中存在HNO2分子,呈酸性;②用HNO2溶液做导电性实验,灯泡很暗;③HNO2溶液不与Na2SO4溶液反应;④0.1 mol·L-1HNO2溶液中,c(H+)=0.015 mol·L-1;⑤相同浓度时,HNO2的导电能力比HCl弱 A. ①②③ B. ②③④ C. ①④⑤ D. ①②④⑤C二、水的电离和溶液的酸碱性1.溶液的酸碱性规律:取决于溶液中c(H+)和c(OH-)的相对大小:2.酸碱中和滴定过程中的溶液的pH变化规律:在中和反应中,溶液pH发生很大的变化,在滴定过程中会因pH突变而使指示剂发生颜色变化(滴定曲线如图)。 通过溶液的颜色变化判断反应终点,测出消耗酸(或碱)溶液的体积,根据化学方程式中酸与碱物质的量之比求出未知溶液的浓度。对于一元酸碱,则有:c酸·V酸=c碱·V碱。 【例题2】(2022·全国·高二课时练习)以酚酞试液作指示剂,对某新制NaOH溶液进行中和滴定实验,数据记录如下表:则该新制的NaOH溶液的浓度c(mol·L-1)计算合理的是( )A.c=0.01×(V1+V2+V3)/(3×20)B.c=0.01×(V1+V2)/(2×20)C.c=0.01×(V1+V3)/(2×20)D.c=0.01×V1/20 B 【对应训练】室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lgc(OH-)。下列说法正确的是( ) A.M点所示溶液中: c(NH4+)+c(NH3·H2O)=c(Cl-) B.N点所示溶液中溶质一定含NH4Cl,可能还含HCl C.Q点消耗盐酸的体积等于氨水的体积 D.Q点所示溶液中c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)B三、盐类的水解1.盐溶液的酸碱性规律: 2.盐类水解规律: ①有弱才水解--必须含有弱酸或弱碱的离子才能发生水解; ②无弱不水解--强酸强碱盐不发生水解; ③谁弱谁水解--发生水解的是弱碱阳离子或弱酸根阴离子; ④谁强显谁性--组成盐的酸根阴离子(碱性阳离子)是强酸根(强碱的阳离子),则显酸(碱)性; ⑤都弱都水解--弱酸弱碱盐因阴、阳离子都能发生水解且两水解过程可相互促进,所以水解程度较大,少数可以完全水解,称为双水解反应; ⑥越弱越水解--组成盐的酸根对应的酸(即水解生成的酸)酸性越弱(或阳离子对应的碱的碱性越弱),水解程度就越大,此即“越弱越水解”规律。 【例题3】(2022·广东斗门一中期中)常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )A.等浓度的CH3COOH 和HClO溶液,pH小的是HClOB.Na2CO3和NaHCO3溶液中粒子种类不同C.溶液水的电离程度:①>②>④>③D.NaHCO3溶液中:c(Na+)=c(CO32- )+c(HCO3- )+c(H2CO3) D【对应训练】今有室温下四种溶液,下列有关叙述不正确的是( )A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 B.②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-) C.分别加水稀释10倍,四种溶液的pH:①>②>④>③ D.V1 L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2D四、难溶电解质的溶解平衡 1.难溶电解质的溶解平衡:难溶电解质在水中会建立如下平衡:MmAn(s) mMn+(aq)+nAm-(aq)。因此,难溶电解质的溶解度虽然很小,但不可能为零(完全不溶解),溶液中的离子结合成难溶电解质时,也不可能完全进行到底。勒夏特列原理同样适用于溶解平衡。 2.溶度积[MmAn(s) mMn+(aq)+nAm-(aq)为例]: ①固体纯物质不列入平衡常数,其溶度积为Ksp=[c(Mn+)]m·[c(Am-)]n,AgCl的Ksp=c(Ag+)·c(Cl-)。对于相同类型的物质,Ksp的大小反映了难溶电解质在溶液中溶解能力的大小,也反映了该物质在溶液中沉淀的难易。与平衡常数一样,Ksp与温度有关。不过温度改变不大时,Ksp变化也不大,常温下的计算可不考虑温度的影响。 ②通过比较溶度积Ksp与溶液中有关离子的离子积Qc的相对大小,可以判断难溶电解质在给定条件下能否生成沉淀或溶解。如AgCl溶液的Qc=c(Ag+)·c(Cl-),该计算式中的离子浓度不一定是平衡浓度,而Ksp计算式中的离子浓度一定是平衡浓度。 若Qc>Ksp,则溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。 若Qc=Ksp,则溶液饱和,沉淀与溶解处于平衡状态。 若Qc<Ksp,则溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。 (3)沉淀溶解平衡的应用: ①化学上通常认为溶液中的剩余离子浓度小于1×10-5 mol·L-1时就沉淀完全。 ②根据溶度积规则,使沉淀溶解的必要条件是Qc<Ksp,因此创造条件使溶液中有关离子的浓度降低,就能达到此目的。途径一是使相关离子生成弱电解质,如要使ZnS溶解,可以加盐酸;途径二是使相关离子被氧化,如CuS在盐酸中不能溶解,但在HNO3中可以溶解。反应的离子方程式为3CuS+2NO3-+8H+=3Cu2++2NO↑+3S↓+4H2O。 ③若一种沉淀剂可使溶液中多种离子沉淀时,则可以控制条件,使这些离子先后分别沉淀,这种现象称为分步沉淀。 【规律】A.同一类型的沉淀,Ksp越小越先沉淀,且Ksp相差越大分步沉淀越完全,如AgCl、AgBr、AgI。B.不同类型的沉淀,其沉淀的先后顺序要通过计算才能确定,如AgCl和Ag2CrO4。 ④若难溶电解质类型相同,则Ksp较大的沉淀易于转化为Ksp较小的沉淀。但要注意的是通过改变外界条件,利用勒夏特列原理也可以使溶解度小的沉淀转化成溶解度大的沉淀。 A.易溶物向难溶物转化:如向BaCO3沉淀中加入Na2CrO4溶液,将会发现白色的BaCO3沉淀逐渐转化成黄色的BaCrO4沉淀。 B.难溶物向易溶物转化:如BaSO4沉淀转化为BaCO3沉淀的反应为BaSO4(s)+CO32- BaCO3(s)+SO42-,K=c(SO42-)/c(CO32-)=Ksp(BaSO4)/Ksp(BaCO3)=(1.07×10-10)/2.58×10-9≈1/24,虽然平衡常数小,转化不彻底,但只要c(CO32-)比c(SO42-)大24倍以上,经多次转化,即能将BaSO4转化为BaCO3。 【例题4】常温下,用AgNO3溶液分别滴定浓度均为0.0lmol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。巳知Ksp(AgCl)数量级为10-10。下列叙述不正确的是( ) A.n点表示Ag2C2O4的不饱和溶液 B.图中X线代表的AgCl C.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为109.04 D.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀 D 【对应训练】下列说法不正确的是( ) A.Ksp只与难溶电解质的性质和温度有关 B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 C.其他条件不变,离子浓度改变时,Ksp不变 D.难溶电解质的Ksp越小,溶解度越小D
相关资料
更多









