




人教版 (2019)选择性必修1第二节 化学平衡集体备课课件ppt
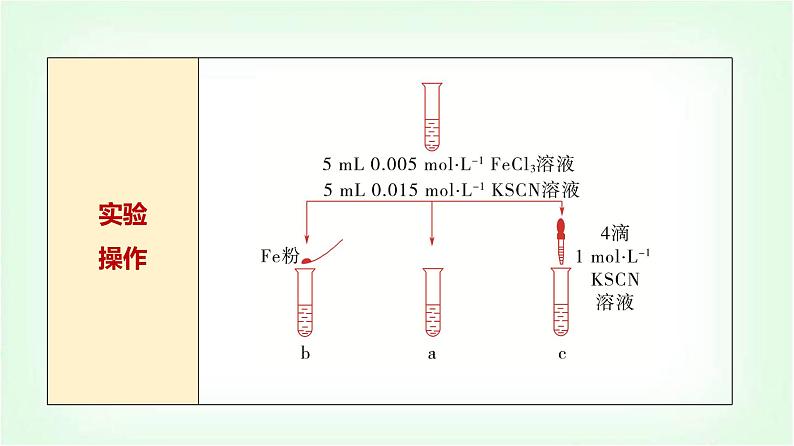
展开知识点一 浓度对化学平衡的影响
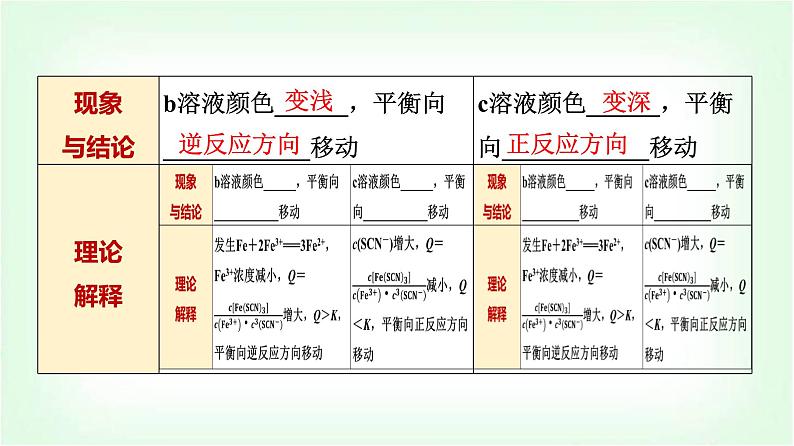
1.实验探究浓度对化学平衡的影响按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
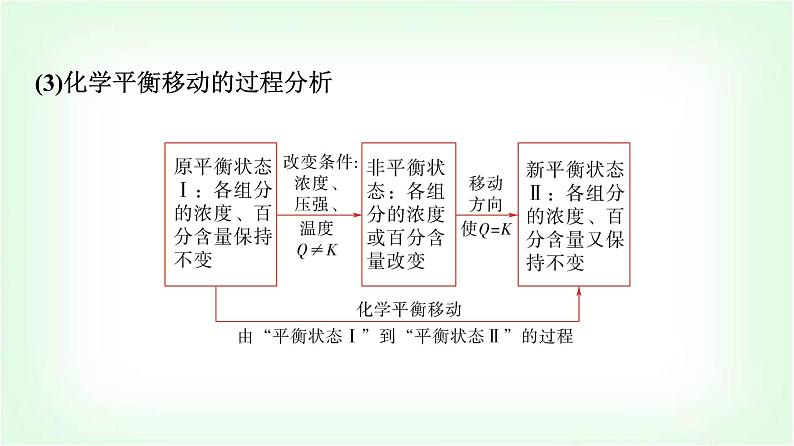
2.化学平衡移动(1)概念:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着______,直至达到新的平衡状态。这种由________________达到__________ ____的过程叫做化学平衡的移动。(2)化学平衡移动的特征新平衡与原平衡相比,平衡混合物中各组分的浓度、百分含量发生改变。
(3)化学平衡移动的过程分析
(4)化学平衡移动方向的判断当Q=K时:可逆反应处于______状态,v(正)____v(逆);当Q<K时:化学平衡向____________移动,v(正)____v(逆);当Q>K时:化学平衡向____________移动,v(正)____v(逆)。
3.浓度对化学平衡的影响规律及解释(1)浓度对化学平衡移动的影响规律当其他条件不变时:①c(反应物)增大或c(生成物)减小,平衡向________方向移动。②c(反应物)减小或c(生成物)增大,平衡向________方向移动。
(3)用v-t图像分析浓度对化学平衡移动的影响①增大反应物的浓度或减小生成物的浓度,可瞬间增大v(正)或减小v(逆),使得v(正)>v(逆),化学平衡向正反应方向移动:
②减小反应物的浓度或增大生成物的浓度,可瞬间减小v(正)或增大v(逆),使得v(正)<v(逆),化学平衡向逆反应方向移动:
4.工业应用工业生产中,适当增大廉价的反应物浓度,使化学平衡向________方向移动,可以提高价格较高的原料的________,从而降低成本。
一定温度下,在容积不变的密闭容器中,加入一定量C(s)和H2O(g)发生反应:C(s)+H2O(g)⥫⥬CO(g)+H2(g),建立化学平衡状态。回答下列问题:(1)平衡时,再向容器中加入少量C(s)或H2O(g),平衡如何移动?(2)平衡时,向容器中加入少量Na,平衡如何移动?(3)平衡时,减小CO(g)浓度,平衡如何移动?试用v(正)、v(逆)的变化特点解释。
1.判断正误(正确的打“√”,错误的打“×”)。(1)合成氨反应中,增加N2的浓度,可使平衡正向移动,提高H2的转化率,降低成本。( )(2)化学平衡向正反应方向移动,v逆一定比v正小。( )(3)反应混合物各组分百分含量发生改变,化学平衡一定发生了移动。( )
下列说法不正确的是( )A.对比试管①和②,为了证明增大反应物浓度,平衡正向移动B.对比试管①和③,为了证明增大反应物浓度,平衡逆向移动C.对比试管①和④,为了证明增大反应物浓度,平衡正向移动D.对比试管①和⑤,为了证明减小反应物浓度,平衡逆向移动
3.如图是恒温条件下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符的是( )
A.反应达到平衡时,正反应速率和逆反应速率相等B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态ⅡC.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态ⅡD.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
C [条件改变后,v′(正)>v′(逆),根据图像分析应是增大了反应物的浓度。]
知识点二 压强对化学平衡的影响
1.实验探究压强对化学平衡的影响按表中实验操作步骤完成实验,观察实验现象,将有关实验现象及其结论填入表中:
2.压强对化学平衡的影响规律及解释(1)在其他条件不变时①增大压强,化学平衡向______________的方向移动。②减小压强,化学平衡向______________的方向移动。③对于反应前后气体分子数目不变的反应,改变压强平衡________。
(2)用v-t图像分析压强对化学平衡的影响
特别提醒 ①压强对平衡移动的影响:只适用于有气体参与的反应。对于只涉及固体或液体的反应,压强的影响不予考虑。②改变压强影响平衡的实质是改变浓度,压强能否使化学平衡发生移动,要看压强改变是否使浓度发生改变,从而使v′正≠v′逆。
在容积可变的甲、乙两密闭容器中分别发生反应2NO2(g)⥫⥬N2O4(g)和H2(g)+Br2(g)⥫⥬2HBr(g)达到化学平衡。若平衡时,缩小甲、乙两容器的容积,回答下列问题:(1)两容器中化学平衡如何移动?反应物的转化率如何变化?(2)两容器中气体的颜色如何变化?
[提示] (1)甲容器中,平衡向正反应方向移动,NO2的转化率升高;乙容器中,平衡不移动,反应物H2、Br2的转化率均不变。(2)甲容器中气体颜色先变深后变浅,但比之前颜色深;乙容器中气体颜色变深。
[教材·思考与讨论]在密闭容器中进行如下反应:CO2(g)+C(s)⥫⥬2CO(g) ΔH>0,达到平衡后,若改变下列条件,则指定物质的浓度、速率、平衡如何变化。(1)增加C(s)的量,则平衡__________(填“逆移”“正移”或“不移动”,下同),v(CO2)_______ (填“增大”“减小”或“不变”,下同)。
(2)恒温条件下,增大反应容器的容积,则平衡_______,c(CO) ______。(3)保持反应容器的容积和温度不变,通入氦气,则平衡____________,v(CO2)_______。(4)保持反应容器的压强和温度不变,通入氩气,则平衡__________,c(CO2)_______。(5)温度不变,将容器的体积缩小一半,其正反应速率_______,平衡_______,
画出其反应速率的变化曲线图:
_________________________。
1.只改变一个影响因素,下列关于化学平衡的说法错误的是( )A.平衡常数改变后,化学平衡一定发生移动B.化学平衡移动后,平衡常数不一定改变C.平衡正向移动,反应物的转化率一定增大D.正反应速率大于逆反应速率,平衡一定正向移动
C [A.平衡常数只与温度有关,平衡常数发生了改变,说明温度发生了改变,则平衡一定发生移动,A正确; B.若是改变浓度或压强使平衡发生移动,而温度不变,则平衡常数K不变,B正确;C.平衡正向移动,反应物的转化率不一定增大,如:向该容器中加入的反应物,其转化率降低,C错误;D.可逆反应中,当正反应速率大于逆反应速率时,平衡一定正向移动,D正确。]
2.(教材互鉴:改编自苏教版教材)一定温度下改变反应容器体积使压强变化,但不会使下列化学反应的平衡发生移动的是( )A.2SO2(g)+O2(g)⥫⥬2SO3(g)B.2NH3(g)+CO2(g)⥫⥬CO(NH2)2(l)+H2O(l)C.C(s)+CO2(g)⥫⥬2CO(g)D.Fe2O3(s)+3CO(g)⥫⥬2Fe(s)+3CO2(g)
D [A.反应物中气体的化学计量数之和不等于生成物中气体的化学计量数之和,压强改变,化学平衡移动,故A、B、C不符合题意,D符合题意。]
3.在一密闭容器中,反应aM(g)⥫⥬bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,N的浓度变为原来的60%,则下列说法不正确的是( )A.平衡向正反应方向移动B.物质M的转化率增大C.反应的化学平衡常数不变D.a、b的大小关系是a>b
D [在一密闭容器中,反应aM(g)⥫⥬bN(g)达到平衡后,保持温度不变,将容器体积增加一倍,此时N的浓度变为原来的50%,当达到新的平衡时,N的浓度变为原来的60%,则表明平衡向生成N的方向移动。A.增大体积,减小压强,平衡向生成N的方向移动,则平衡向正反应方向移动,A正确;B.减小压强,平衡向正反应方向移动,物质M的转化率增大,B正确;C.在压强减小过程中,温度保持不变,则反应的化学平衡常数不变,C正确;D.减小压强,平衡向气体分子数增大的方向(正反应方向)移动,则a、b的大小关系是a<b,D不正确。]
5.一定条件下,某可逆反应在密闭容器中建立化学平衡,在t1时刻改变某一个条件,建立新的平衡,其v-t图像如下:
A B
C D
(1)对于反应2SO2(g)+O2(g)⥫⥬2SO3(g),t1时刻缩小容器体积,其图像为_______(填字母),平衡_________________(填“向正反应方向”“向逆反应方向”或“不”)移动。(2)对于反应2NH3(g)⥫⥬N2(g)+3H2(g),t1时刻增大容器体积,其图像为______(填字母),平衡______________(填“向正反应方向”“向逆反应方向”或“不”)移动。(3)对于反应H2(g)+I2(g)⥫⥬2HI(g),t1时刻缩小容器体积,其图像为_____(填字母),平衡_____(填“向正反应方向”“向逆反应方向”或“不”)移动。
人教版 (2019)必修 第一册第三节 物质的量教学课件ppt: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第三节 物质的量教学课件ppt</a>,共60页。PPT课件主要包含了物质的量浓度,玻璃棒,mL容量瓶,mB或V,无影响,随堂评估·知能落实,mol·L-1,搅拌和引流,abc,防止引起误差等内容,欢迎下载使用。
化学选择性必修1第二节 化学平衡教案配套ppt课件: 这是一份化学选择性必修1<a href="/hx/tb_c4002420_t3/?tag_id=26" target="_blank">第二节 化学平衡教案配套ppt课件</a>,共37页。PPT课件主要包含了逆反应方向,正反应方向,原有的平衡状态,新的平衡状态,正反应,逆反应,转化率,气体体积缩小,气体体积增大,不移动等内容,欢迎下载使用。
化学选择性必修1第二节 化学平衡教学演示ppt课件: 这是一份化学选择性必修1第二节 化学平衡教学演示ppt课件,共45页。PPT课件主要包含了目录索引等内容,欢迎下载使用。













