






人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用公开课课件ppt
展开一、化学平衡移动1.定义在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直到达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。2.化学平衡移动的过程
v(正) v(逆) v(正) v(逆) v'(正) v'(逆)
3.平衡移动与反应速率的关系外界条件对化学平衡移动的影响是通过改变反应速率来实现的。条件改变时:(1)若v(正) v(逆),平衡 移动; (2)若v(正)>v(逆),平衡向 反应方向移动; (3)若v(正)
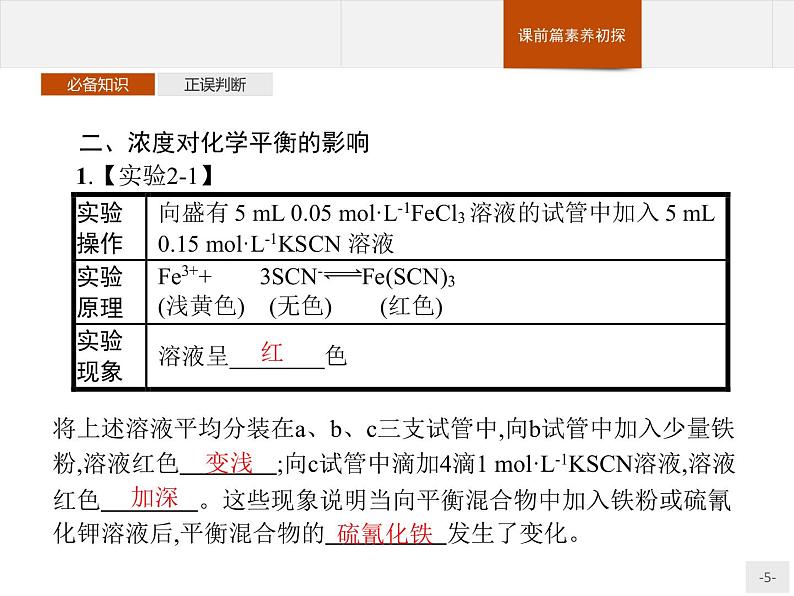
将上述溶液平均分装在a、b、c三支试管中,向b试管中加入少量铁粉,溶液红色 ;向c试管中滴加4滴1 ml·L-1KSCN溶液,溶液红色 。这些现象说明当向平衡混合物中加入铁粉或硫氰化钾溶液后,平衡混合物的 发生了变化。
2.结论在可逆反应达到平衡时,在其他条件不变的情况下:(1)c(反应物)增大或c(生成物)减小,平衡向 方向移动。 (2)c(反应物)减小或c(生成物)增大,平衡向 方向移动。 3.理论解释浓度的改变导致 的改变,但K ,使Q K,从而导致平衡移动。但浓度的改变不一定会使化学平衡发生移动。
三、压强对化学平衡的影响1.【实验2-2】(1)实验操作:用50 mL注射器吸入20 mL NO2与N2O4的混合气体,并将细管端用橡皮塞封闭。然后将活塞向外拉,观察管内混合气体颜色的变化。当反复推拉活塞时,观察管内混合气体颜色的变化。(2)实验现象与结论:
2.压强对化学平衡的影响对于有气体参加的可逆反应来说,当达到化学平衡时,在其他条件不变的情况下:
(1)若为反应前后气体体积不等的反应,如N2+3H2 2NH3:增大压强后,平衡向 的方向移动; 减小压强后,平衡向 的方向移动。
改变压强后,平衡 。
【微思考2】对于只有固体或液体参加的反应,体系压强的改变会使化学平衡状态发生变化吗?
提示:压强的改变只影响有气体参加或生成的可逆反应。
(1)化学平衡发生移动时,化学反应速率一定改变;化学反应速率改变时,化学平衡也一定发生移动。 ( )(2)平衡时,其他条件不变,分离出固体生成物,v(正)减小。 ( )
(5)改变压强后,平衡一定发生移动。 ( )(6)改变外界条件使平衡正向移动的原因是v(正)增大,v(逆)减小。 ( )
答案:(1)× (2)× (3)× (4)× (5)× (6)×
浓度对化学平衡的影响问题探究1.某一可逆反应,一定条件下达到了化学平衡。(1)若化学反应速率改变,化学平衡是否发生移动?(2)若化学平衡发生移动,化学反应速率是否一定发生改变?2.有固体(或纯液体)参加的反应,达到平衡后,增加或减少固体(或纯液体)的量,平衡是否会发生移动?
答案:(1)若v(正)、v(逆)依然相等,则平衡不移动,否则移动。(2)只要平衡发生移动,则反应速率一定发生改变。
答案:不会移动,改变固体(或纯液体)的量,不会改变固体(或纯液体)的浓度,平衡不会发生移动。
深化拓展浓度改变对化学平衡的影响1.影响规律:
3.注意事项:若改变固体或纯液体反应物的用量,化学反应速率不变,平衡不移动。
素能应用典例1体积一定的恒温密闭容器中加入等物质的量的X、Y,进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0。下列叙述正确的是( )A.若继续充入X,平衡向正反应方向移动,Y的转化率增大B.若继续充入Z,平衡逆向移动,Z的体积分数减小C.若移走部分W,平衡正向移动D.平衡后移走X,上述反应的ΔH减小
答案:A 解析:B项,通入Z,平衡逆向移动,Z的体积分数增大。C项,W为固体,改变其用量,平衡不移动。D项,ΔH的大小与方程式中各物质的化学计量数及状态有关,与加入反应物的量无关。
变式训练1合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。反应达到平衡后,为提高CO的转化率,下列措施中不正确的是( )A.容器容积不变,再充入COB.容器的容积不变,及时移走CO2C.增大H2O的浓度D.减小H2的浓度
答案:A 解析:一般来说,有两种及两种以上反应物的可逆反应中,在其他条件不变时,增大其中一种反应物的浓度,能使其他反应物的转化率升高,但其本身的转化率反而降低,故A项错误;及时移走CO2可减小CO2的浓度,使平衡正向移动,提高CO的转化率;增大H2O的浓度,平衡正向移动,可提高CO的转化率;减小产物浓度,平衡正向移动,可提高CO的转化率。
压强对化学平衡的影响问题探究1.有气体参加的反应,增大体系的压强后,平衡一定会移动吗?2.反应A(g)+B(g)=C(g)达到平衡后,增加A的量使平衡向正反应方向移动,A、B的转化率如何改变?
答案:反应前后气体体积未发生改变的可逆反应,改变压强后平衡不会移动,如H2+I2 2HI。
答案:A的转化率降低,B的转化率升高。
深化拓展压强对化学平衡的影响1.影响规律:
3.特别注意:(1)恒容时,通入稀有气体,压强增大,平衡不移动;恒压时,通入稀有气体,体积增大,平衡向气体体积增大的方向移动。(2)在恒容容器中,改变其中一种气态物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析。(3)同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
A.反应向逆反应方向移动B.Y可能是固体或液体C.系数n>mD.Z的体积分数减小
答案:C 解析:反应已达平衡,此时c(X)=0.3 ml·L-1,其他条件不变,将容器缩小到原来的 ,若此时平衡不移动,c(X)=0.6 ml·L-1,但平衡移动之后c(X)=0.5 ml·L-1,说明加压使平衡向正反应方向移动,正反应为气体体积减小的反应,若Y为固体或液体,则需要满足m>2m,A、B项错误;Y应是气体,则m+n>2m,所以n>m,C项正确;平衡正向移动,产物Z的体积分数应该增大,D项错误。
变式训练2在密闭容器中,反应xA(g)+yB(g) zC(g),在一定条件下达到平衡状态,试回答下列问题。(1)若x+y>z,缩小体积,增大压强,则平衡向 方向移动。 (2)若保持体积不变,通入He,则平衡 移动。 (3)若保持压强不变,通入He,平衡向正反应方向移动,则x、y、z的关系为 。 (4)若x+y=z,缩小体积,增大压强,则平衡 移动。
答案:(1)正反应 (2)不 (3)x+y
A.反应达到平衡时,正反应速率和逆反应速率相等B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态ⅡC.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态ⅡD.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
解析:条件改变后,v'(正)>v'(逆),根据图像分析应是增大了反应物的浓度。
2.可以作为判断化学平衡发生移动的标志的是( )A.反应混合物中各组分的浓度发生改变B.正、逆反应速率发生改变C.反应物的转化率发生改变D.体系的压强发生改变
解析:对于反应H2(g)+I2(g) 2HI(g),压缩体积增大压强,混合物中各组分的浓度发生改变,正、逆反应速率发生改变,但平衡不发生移动。反应物的转化率发生改变,平衡一定移动。
3.(双选)在一恒容密闭容器中,反应A(g)+B(g) C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )A.A的浓度一定比原平衡大B.A的转化率增大C.C的体积分数一定大于原平衡C的体积分数D.B的转化率一定增大
解析:增大A的浓度,尽管平衡右移,但A的转化率减小,平衡时A的浓度一定比原平衡大。增大A的浓度,反应物B的转化率升高。由于A的浓度增大,故平衡时C的体积分数不一定增大。
4.对于密闭容器中的可逆反应mX(g)+nY(s) pZ(g)ΔH<0,达化学平衡后,改变条件,下列说法不正确的是 ( )A.增大压强,化学平衡不一定发生移动B.通入氦气,化学平衡不一定发生移动C.增加X或Y的物质的量,化学平衡一定发生移动D.其他条件不变,升高温度,化学平衡一定发生移动
解析:由于Y为固体,改变其用量不影响化学平衡,C项不正确;D项,该反应的正反应是放热反应,升高温度,化学平衡向逆反应方向移动。
人教版 (2019)选择性必修1第二节 化学平衡优质习题课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡优质习题课件ppt,文件包含22第3课时浓度压强对化学平衡的影响课件新教材人教版2019高中化学选择性必修一共29张PPTpptx、22第3课时浓度压强对化学平衡的影响课后习题新教材人教版2019高中化学选择性必修一docx等2份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量教学演示ppt课件: 这是一份鲁科版 (2019)必修 第一册第3节 化学中常用的物理量——物质的量教学演示ppt课件,共60页。PPT课件主要包含了胶头滴管,托盘天平,玻璃棒,点击右图进入等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三节 盐类的水解评课课件ppt: 这是一份人教版 (2019)选择性必修1第三节 盐类的水解评课课件ppt,共38页。













