




还剩15页未读,
继续阅读
所属成套资源:【新课标】人教版2019高中化学必修一课件及作业
成套系列资料,整套一键下载
人教版 (2019)必修 第一册第二节 元素周期律评优课课件ppt
展开
这是一份人教版 (2019)必修 第一册第二节 元素周期律评优课课件ppt,共23页。PPT课件主要包含了半径规律,化合价规律等内容,欢迎下载使用。
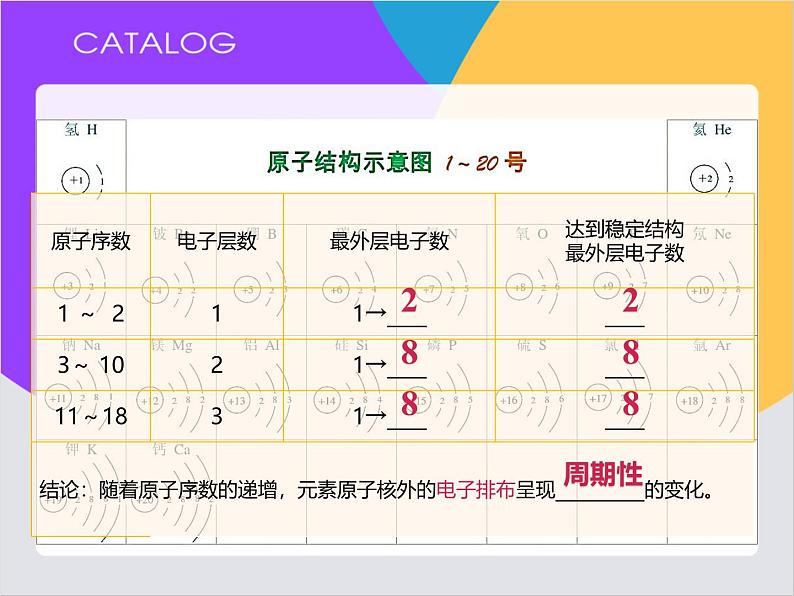
原子核外电子排布周期性变化。
原子结构的周期性变化(结构决定性质)
半径、化合价、金属性/非金属性
元素的性质随着原子序数的递增而呈____________的规律。
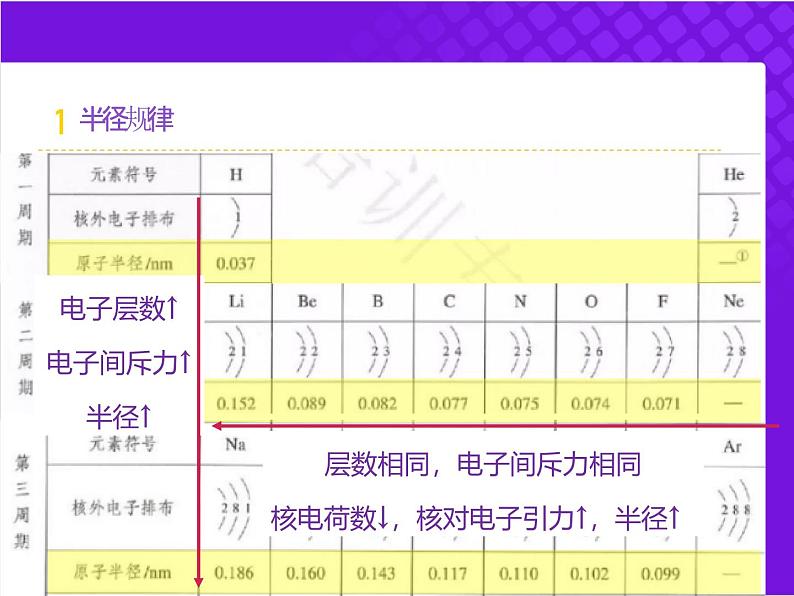
电子层数↑电子间斥力↑半径↑
层数相同,电子间斥力相同核电荷数↓,核对电子引力↑,半径↑
原子序数↓,核对电子引力↓,半径↑
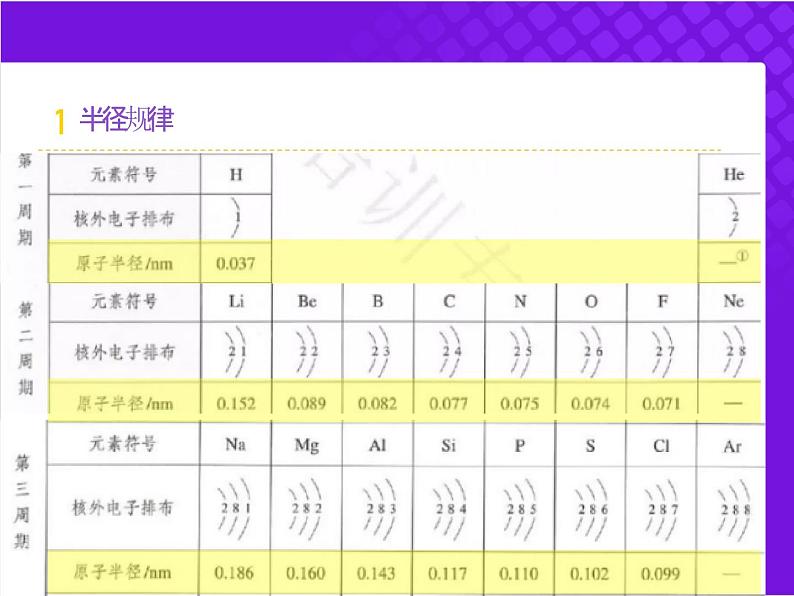
1、看电子层数(层大径大)
3、看最外层电子数(层同序同,数大径大)
2、看原子序数(层同,序大径小)
离子:写出前20号元素离子结构示意图
阴离子>原子>阳离子阴盛阳衰,越阴越大
结论:化合价由最外层电子决定
(2)主族元素(除O、F):最高正价=最外层电子数=主族序数;
(3)除H、O、F: 最低负价= 最高正价 - 8
(1)金属无负价,O无最高正价,F无正价
某元素的最高正价与负价的代数和4,则该元素的最外层电子数为( )A、4 B、5 C、6 D、7
某元素X的气态氢化物为H2X,该元素最高价含氧酸的分子式可能为( )A、 H2XO3 B、 H2XO4 C、 H4XO4 D、 H4XO4
原子核外电子排布周期性变化。
原子结构的周期性变化(结构决定性质)
半径、化合价、金属性/非金属性
元素的性质随着原子序数的递增而呈____________的规律。
电子层数↑电子间斥力↑半径↑
层数相同,电子间斥力相同核电荷数↓,核对电子引力↑,半径↑
原子序数↓,核对电子引力↓,半径↑
1、看电子层数(层大径大)
3、看最外层电子数(层同序同,数大径大)
2、看原子序数(层同,序大径小)
离子:写出前20号元素离子结构示意图
阴离子>原子>阳离子阴盛阳衰,越阴越大
结论:化合价由最外层电子决定
(2)主族元素(除O、F):最高正价=最外层电子数=主族序数;
(3)除H、O、F: 最低负价= 最高正价 - 8
(1)金属无负价,O无最高正价,F无正价
某元素的最高正价与负价的代数和4,则该元素的最外层电子数为( )A、4 B、5 C、6 D、7
某元素X的气态氢化物为H2X,该元素最高价含氧酸的分子式可能为( )A、 H2XO3 B、 H2XO4 C、 H4XO4 D、 H4XO4














