


还剩52页未读,
继续阅读
成套系列资料,整套一键下载
【新课标】人教版(2019)高中化学选择性必修二 第二章《分子结构与性质》单元复习课件
展开
这是一份【新课标】人教版(2019)高中化学选择性必修二 第二章《分子结构与性质》单元复习课件,共60页。
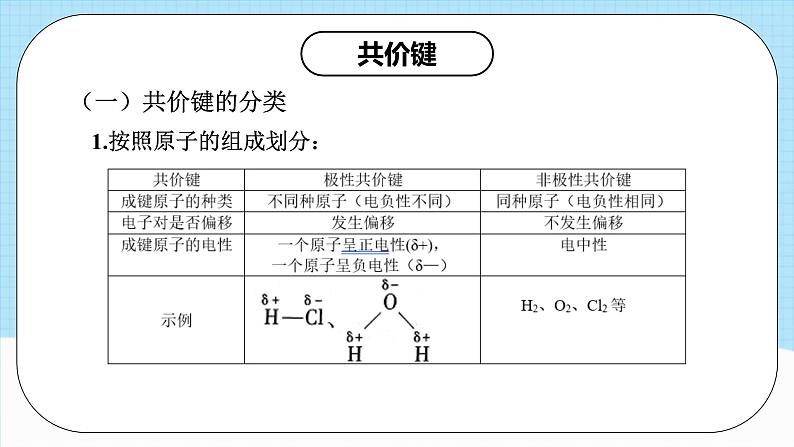
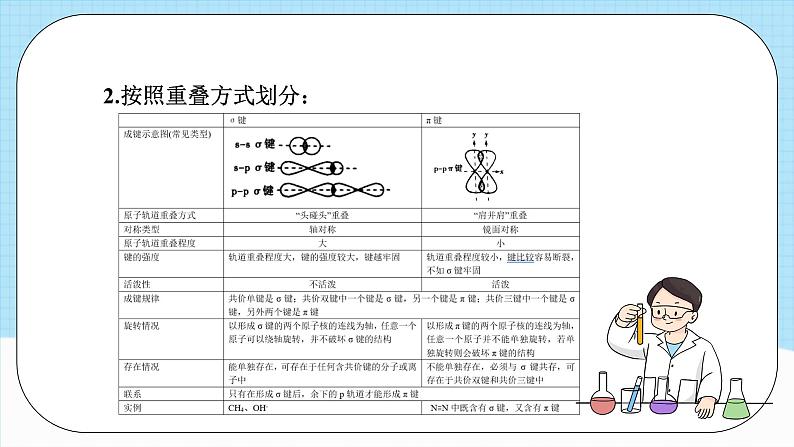
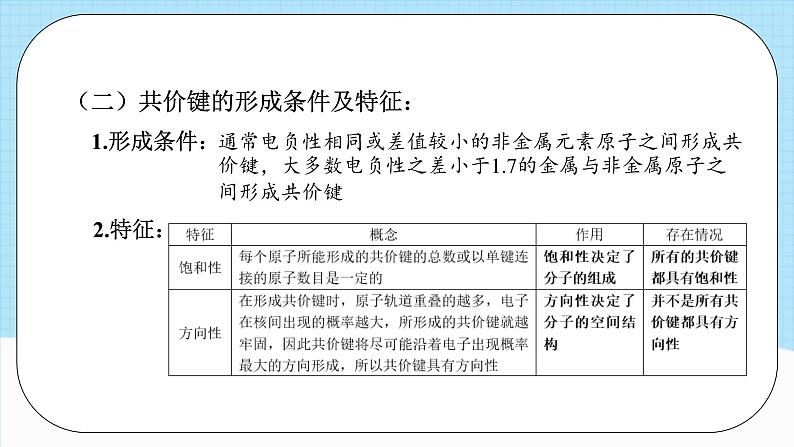
单元复习第二章知识导引分子结构与性质分子的结构 共价键成键原子之间形成共用电子对,原子轨道或电子云重叠决定分子的空间结构(s-s σ 键无方向性)分子的性质分子的极性键的极性对化学性质的影响影响因素共价键的极性和分子空间结构范德华力正负电荷中心是否重合相对分子质量越大,极性越大,范德华力越大分子间作用力相似相溶原理表达方式、特征、类型、对熔沸点和溶解性的影响手性异构体与手性分子、手性分子的成因和判断方法 本质 特征 类型 方向性 饱和性决定分子的组成 σ 键 π 键头碰头肩并肩 键参数 键能、键长决定共价键稳定性,键能计算反应热 键能、键角决定分子空间结构,键角决定共价键方向 分子的空间结构 价层电子对互斥模型 杂化轨道理论中心原子上的孤电子对数=sp、sp2、sp3 杂化类型判断方法极性分子和非极性分子氢键分子的手性共价键(一)共价键的分类1.按照原子的组成划分:共价键2.按照重叠方式划分:(二)共价键的形成条件及特征:1.形成条件:通常电负性相同或差值较小的非金属元素原子之间形成共价键,大多数电负性之差小于1.7的金属与非金属原子之间形成共价键2.特征:(三)键参数——键能、键长与键角1.键参数对分子性质的影响:相同类型的共价化合物分子,成键原子半径越小,键长越短,键能越大,分子越稳定2.常见分子的键角及分子空间结构【典例1】甲醛是家庭装修常见的污染物。一种催化氧化甲醛的反应为HCHO+O2 H2O+CO2。下列有关叙述正确的是 ( )A.H2O分子中存在p-p σ键B.HCHO分子中σ键和π键的数目之比为2:1 C.CO2分子形成时其轨道的一种重叠方式是D.CO2分子中σ键和π键的电子云的对称性不同对应训练【解析】答案:D。H原子p轨道上不含电子,故H2O分子中不可能存在p-pσ键,A项错误;1个HCHO分子中含两个C-H键和一个C=O键,单键全是σ键,双键含一个σ键和一个π键,所以HCHO分子中含σ键和π键的数目之比应为3:1,B项错误;CO2分子中含σ键和π键,其轨道的重叠方式分别为“头碰头”和“肩并肩”,没有互相垂直的重叠方式,C项错误;σ键的电子云呈轴对称,π键的电子云呈镜面对称,D项正确。【典例2】某物质可溶于水和乙醇,熔点为209.5℃,其分子的结构简式如图所示。下列说法不正确的是 ( )A.该分子中含有极性共价键B.该分子中σ键和π键的个数比为3:1C.该分子中原子最外层达到8电子稳定结构的为C、ND.电负性:C>N【解析】答案:D。该分子中含有N-H、C-N等极性共价键,故A项正确;单键为σ键,每个双键含有1个σ键和1个π键,每个三键含有1个σ键和2个π键,则该分子中σ键和π键的个数比为9:3=3:1,故B项正确;该物质分子中C和N最外层都达到了8电子稳定结构,H达到了2电子稳定结构,故C项正确;一般来说,同周期主族元素从左到右,电负性逐渐增大,故D项错误。【典例3】SiF4与SiCl4分子都是正四面体结构。下列判断正确的是 ( )A.键长:Si-F>Si-Cl B.键能:Si-F>Si-ClC.沸点:SiF4>SiCl4 D.共用电子对偏移程度:Si-Cl>Si-F【解析】答案:B。原子半径:C1>F,原子半径越大,其形成的化学键的键长就越长,所以键长:Si-FF,所以键能:Si-F>Si-C1,B正确;SiF4、SiCl4都是由分子构成的物质,结构相似,物质的相对分子质量越大,分子间作用力就越大,物质的沸点越高,所以沸点:SiF4< SiCl4,C错误;元素的非金属性越强,与同种元素的原子形成的共价键的极性就越强,共用电子对偏移程度就越大,元素的非金属性:F> Cl,所以共用电子对偏移程度:Si-ClO>C>B【解析】答案:B。化合物A中存在的化学键均为单键,不存在π键, A项正确;由CH4变为CO2,碳原子的杂化类型由sp3转化为sp,反应前后碳原子的杂化类型发生改变,B项错误。【典例4】分子或离子中的大π键可表示为 ,其中x表示参与形成大π键的原子总数,y表示参与形成大π键的电子数,已知参与形成大键的电子数=价电子总数-(σ键电子对数+孤电子对数)×2。SO2和SO3的结构如图所示: 下列关于SO2和SO3的说法正确的是( )A. SO2的大π键的电子数为6B. SO3的大π键可表示为C. SO3的中心原子采取sp3杂化D. SO2和SO3的空间结构相同【解析】答案:B。由题图可知,SO2中σ键电子对数为2,孤电子对数为5,则SO2的大π键的电子数=价层电子总数-(σ键电子对数+孤电子对数)×2=18-(2+5)×2=4,A项错误。由题图可知, SO3中σ键电子对数为3,孤电子对数为6,则, SO3的大π键的电子数=24-(3+6)×2= 6,大π键可表示为 ,B项正确。由题图可知, SO3中心原子S上无孤电子对, SO3中心原子S的价层电子对数= σ键电子对数+中心原子上的孤电子对数=3+0=3,则SO3中心原子S的杂化轨道类型为sp2, SO3的空间结构为平面三角形;由题图可知, SO2中心原子S上有1对孤电子对, SO2中心原子S的价层电子对数=σ键电子对数+中心原子上的孤电子对数=2+1=3, SO2的空间结构为V形,C、D项错误。分子结构与物质的性质(一)共价键的极性和分子的极性1、影响共价键极性的因素:(1)电负性差值越大的两原子形成的共价键的极性越强(2)共用电子对偏移程度越大,键的极性越强分子结构与物质的性质2、分子极性的判断方法(1)可依据分子中化学键的极性的向量和进行判断(2)可根据分子中的正电中心和负电中心是否重合判断(3)利用键的极性和空间构型一起判断分子的极性(4)化合价法注:一般情况下,单质分子为非极性分子,但O3是V形分子,其空间结构不对称,故O3为极性分子。(二)键的极性对物质化学性质的影响1、电负性越大,极性越大,酸性越强2、卤族元素越多,极性越大,酸性越强3、烃基越长,推电子效应越大,羧酸的酸性越小4、键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大(三)分子间的作用力及其对物质性质的影响1、范德华力及其对物质性质的影响(1)范德华力的存在范围范德华力存在于由共价键形成的多数共价化合物、绝大多数非金属单质及没有化学键的稀有气体中但像二氧化硅晶体、金刚石等由共价键形成的物质中不存在范德华力(2)范德华力的特征①范德华力广泛存在于分子之间,但只有分子间充分接近时才有分子间的相互作用力。②范德华力很弱,比化学键的键能小1~2个数量级。③范德华力没有方向性和饱和性。(3)影响范德华力的因素①组成和结构相似的物质,相对分子质量越大,范德华力越大②分子的极性越大,范德华力越大③分子组成相同,但结构不同的物质(即互为同分异构体),分子的对称性越强,范德华力越小(4)范德华力对物质性质的影响范德华力主要影响物质的熔、沸点等物理性质。一般规律:范德华力越大,物质的熔、沸点越高。2、氢键及其对物质性质的影响(1)形成条件它是由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力(2)氢键的表达方式X—H…Y—。X、Y为N、O、F,“—”表示共价键,“…”表示形成的氢键在X—H … Y中,X、Y的电负性越大,氢键越强;Y原子的半径越小,氢键越强(3)氢键的特征①氢键是一种分子间作用力,但不同于范德华力,也不属于化学键。 ②氢键是一种较弱的作用力,比化学键的键能小1~2个数量级,与范德华力数量级相同,但比范德华力明显的强。 ③氢键具有方向性(X—H … Y尽可能在同一条直线上)和饱和性(一个X—H只能和一个Y原子结合),但本质上与共价键的方向性和饱和性不同。(4)氢键的键长表达式一般定义为A—H … B的长度,而不是H … B的长度(5)氢键的存在范围氢键不仅存在于分子间,有时也存在于分子内(6)氢键对物质性质的影响①对物质溶沸点的影响:I.存在分子间氢键的物质,具有较高的熔、沸点。II.互为同分异构体的物质,能形成分子内氢键的,其熔、沸点比能形成分子间氢键的物质的低。②对物质溶解度的影响:溶质与溶剂之间若能形成分子间氢键,则溶质的溶解度明显的增大注:化学键影响物质的化学性质。(四)溶解性1、“相似相溶”规律的内容?非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂说明:(1)“相似”指的是分子的极性相似 (2)这是一条经验规律,也会有不符合规律的例子,如CO、NO等极性分子均难溶于水,不少盐类(如AgCl、PbSO4、BaCO3等)也难溶于水,H2、N2难溶于水也难溶于苯等2、影响溶解度的因素(1)内因①如果溶剂和溶质之间存在氢键,则溶质在溶剂中的溶解度较大②物质自身的结构。“相似相溶”还适用于分子结构的相似性③溶质与溶剂发生反应可增大其溶解度(2)外因①温度:一般地,温度升高,固体物质的溶解度增大,气体物质的溶解度减小②压强:一般地,压强越大,气体的溶解度越大注:I、影响固体溶解度的主要因素是温度。常见物质中,Ca(OH)2的溶解度随温度的升高而减小。受热易分解的物质的溶解情况需考虑温度因素。II、影响气体溶解度的主要因素是温度和压强。(五)分子的手性手性分子的判断有机物分子具有手性是由于其分子中含有手性碳原子。如果1个碳原子所连接的4个原子或基团各不相同,那么该碳原子为手性碳原子,用*C来表示。如 ,R1、R2、R3、R4是互不相同的原子或基团。所以,判断一种有机物是否为手性分子,就看其含有的碳原子是否连有4个不同的原子或基团。【典例1】科学家最近研制出有望成为高效火箭推进剂的N(NO2)3,其结构简式如图所示。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )A.该分子中所有共价键均为非极性键B.该分子中4个氮原子共平面C.该分子属于极性分子 D.该分子中的4个氮原子构成正四面体对应训练【解析】答案:C。N与N之间形成非极性键,N与O之间形成极性键,A项错误;该分子中N-N-N键角都是108.1°,结合其结构可知,中心N原子还含有孤电子对,该分子的空间结构为三角锥形,分子中4个氮原子不可能共平面,正、负电荷中心不重合,属于极性分子,B、D项错误,C项正确。【典例2】下列物质中,酸性最强的是( )A.HCOOH B.HOCOOH C.CH3COOH D.C6H13COOH【解析】答案: A。推电子效应-C6H13>-CH3>-H,HOCOOH是碳酸,故酸性:HCOOH>CH3COOH>HOCOOH>C6H13COOH。【典例3】已知三种硝基苯酚的性质如表所示:下列关于三种硝基苯酚的叙述不正确的是( )A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚B.间硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高D.三种硝基苯酚都不能与水分子形成氢键,所以在水中的溶解度小【解析】答案: D。邻硝基苯酚能形成分子内氢键,分子内氢键使其熔、沸点较低,间硝基苯酚、对硝基苯酚形成分子间氢键,分子间氢键使其熔、沸点较高,A、C项正确;三种硝基苯酚分子中均含有-OH、-NO2,均可与H2O分子形成氢键,B项正确,D项错误。【典例4】物质在不同溶剂中的溶解性一般都遵循“相似相溶规律。下列装置不宜用于HC1尾气吸收的是( )【解析】答案: C。HCl是极性分子,易溶于水而难溶于CCl4。C项装置易发生倒吸,而A、D项装置均能防止倒吸。B项装置中HC1气体先通过CCl4,由于HCl难溶于CCl4,HC1经过CCl4后再被上层的水吸收,也可以有效防止倒吸。【典例5】下列化合物中,含有3个手性碳原子的是 ( )【解析】答案: A。 含有3个手性碳原子,故A正确; 含有1个手性碳原子,故B错误; 含有2个手性碳原子,故C错误: 含有1个手性碳原子,故D错误。课程结束
单元复习第二章知识导引分子结构与性质分子的结构 共价键成键原子之间形成共用电子对,原子轨道或电子云重叠决定分子的空间结构(s-s σ 键无方向性)分子的性质分子的极性键的极性对化学性质的影响影响因素共价键的极性和分子空间结构范德华力正负电荷中心是否重合相对分子质量越大,极性越大,范德华力越大分子间作用力相似相溶原理表达方式、特征、类型、对熔沸点和溶解性的影响手性异构体与手性分子、手性分子的成因和判断方法 本质 特征 类型 方向性 饱和性决定分子的组成 σ 键 π 键头碰头肩并肩 键参数 键能、键长决定共价键稳定性,键能计算反应热 键能、键角决定分子空间结构,键角决定共价键方向 分子的空间结构 价层电子对互斥模型 杂化轨道理论中心原子上的孤电子对数=sp、sp2、sp3 杂化类型判断方法极性分子和非极性分子氢键分子的手性共价键(一)共价键的分类1.按照原子的组成划分:共价键2.按照重叠方式划分:(二)共价键的形成条件及特征:1.形成条件:通常电负性相同或差值较小的非金属元素原子之间形成共价键,大多数电负性之差小于1.7的金属与非金属原子之间形成共价键2.特征:(三)键参数——键能、键长与键角1.键参数对分子性质的影响:相同类型的共价化合物分子,成键原子半径越小,键长越短,键能越大,分子越稳定2.常见分子的键角及分子空间结构【典例1】甲醛是家庭装修常见的污染物。一种催化氧化甲醛的反应为HCHO+O2 H2O+CO2。下列有关叙述正确的是 ( )A.H2O分子中存在p-p σ键B.HCHO分子中σ键和π键的数目之比为2:1 C.CO2分子形成时其轨道的一种重叠方式是D.CO2分子中σ键和π键的电子云的对称性不同对应训练【解析】答案:D。H原子p轨道上不含电子,故H2O分子中不可能存在p-pσ键,A项错误;1个HCHO分子中含两个C-H键和一个C=O键,单键全是σ键,双键含一个σ键和一个π键,所以HCHO分子中含σ键和π键的数目之比应为3:1,B项错误;CO2分子中含σ键和π键,其轨道的重叠方式分别为“头碰头”和“肩并肩”,没有互相垂直的重叠方式,C项错误;σ键的电子云呈轴对称,π键的电子云呈镜面对称,D项正确。【典例2】某物质可溶于水和乙醇,熔点为209.5℃,其分子的结构简式如图所示。下列说法不正确的是 ( )A.该分子中含有极性共价键B.该分子中σ键和π键的个数比为3:1C.该分子中原子最外层达到8电子稳定结构的为C、ND.电负性:C>N【解析】答案:D。该分子中含有N-H、C-N等极性共价键,故A项正确;单键为σ键,每个双键含有1个σ键和1个π键,每个三键含有1个σ键和2个π键,则该分子中σ键和π键的个数比为9:3=3:1,故B项正确;该物质分子中C和N最外层都达到了8电子稳定结构,H达到了2电子稳定结构,故C项正确;一般来说,同周期主族元素从左到右,电负性逐渐增大,故D项错误。【典例3】SiF4与SiCl4分子都是正四面体结构。下列判断正确的是 ( )A.键长:Si-F>Si-Cl B.键能:Si-F>Si-ClC.沸点:SiF4>SiCl4 D.共用电子对偏移程度:Si-Cl>Si-F【解析】答案:B。原子半径:C1>F,原子半径越大,其形成的化学键的键长就越长,所以键长:Si-F
相关资料
更多









