

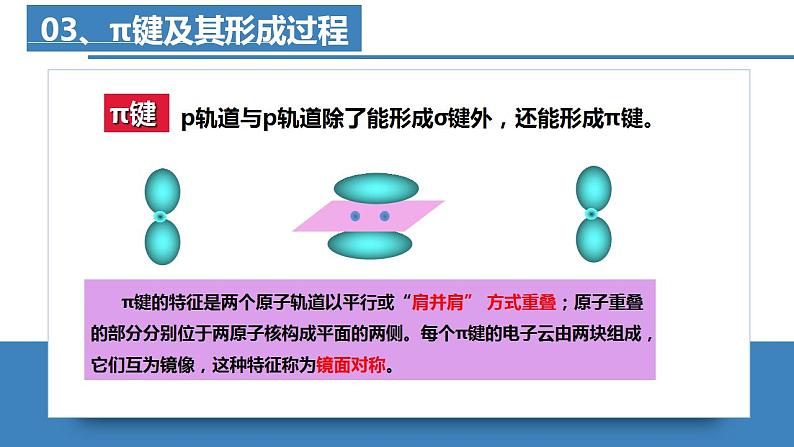
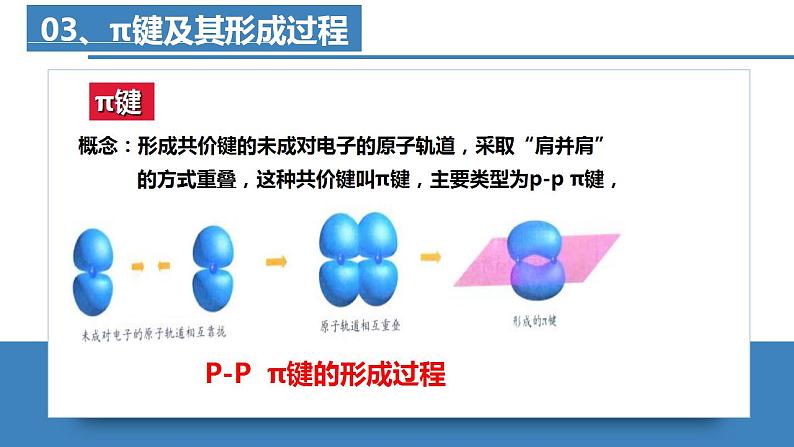


- 高二化学人教版2019选择性必修二2.3.4分子结构与物质的性质(第4课时 氢键及其对物质性质的影响) 课件+练习含解析 课件 14 次下载
- 高二化学人教版2019选择性必修二 2.3.5分子结构与物质的性质(第5课时 溶解度 手性) 课件(含视频)+练习含解析 课件 13 次下载
- 高二化学人教版2019选择性必修二3.1.1物质的聚集状态与晶体的常识(第1课时 物质的聚集状态 课件(含视频)+练习含解析 课件 12 次下载
- 高二化学人教版2019选择性必修二3.1.2物质的聚集状态与晶体的常识(第2课时 晶胞)课件+练习含解析 课件 11 次下载
- 高二化学人教版2019选择性必修二3.2.1分子晶体与共价晶体(第1课时 分子晶体)课件+练习含解析 课件 11 次下载
高二化学人教版2019选择性必修二第二章 章末复习 课件+练习含解析
展开第二章 分子结构与性质
章末复习
一、单选题
Ⅰ.夯实基础篇
1.(湖南省益阳市2022-2023学年高二上学期期末质量检测化学试题)是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的页面上。下列关于的说法正确的是
A.是非极性分子
B.分子中含有σ键、π键、氢键
C.在中的溶解度小于在中的溶解度
D.的电子式:
2.(2023秋·湖南长沙·高二长沙市实验中学校考期末)下列关于键和键的说法中,不正确的是
A.键和键能同时存在于同一个分子中
B.键是原子轨道“头碰头”重叠形成的,键是原子轨道“肩并肩”重叠形成的
C.乙烯分子中含有5个键和1个键
D.分子中只存在键,分子中只存在键
3.(2023春·湖南湘潭·高三湘潭一中校考开学考试)设为阿伏加德罗常数的值,下列叙述正确的是
A.中键的数目为
B.标准状况下,中所含质子总数为
C.中S的价层电子对数为
D.常温下,与足量浓硫酸反应,转移电子的数目为
4.(2023·广东·高一学业考试)氯气通入碳酸氢钠溶液中发生反应Cl2+NaHCO3=NaCl+CO2+HClO,下列有关化学用语正确的是
A.Na+的结构示意图: B.CO2的结构式:O—C—O
C.HClO的电子式: D.NaHCO3既含离子键又含共价键
5.(2023春·北京海淀·高三校考开学考试)下列化学用语或图示表达正确的是
A.的电子式 B.砷原子的简化电子排布式为:
C.的模型 D.中的键电子云轮廓图
6.(2023秋·辽宁辽阳·高二校联考期末)下列说法错误的是
A.键的电子云重叠程度比键大,稳定性强
B.N与3个H结合形成分子,体现了共价键的饱和性
C.第三周期主族元素中第一电离能介于和P之间的有3种
D.短周期主族元素中位于s区的有5种
7.(2022秋·湖南长沙·高三长沙一中校考阶段练习)下列表示不正确的是
A.绿矾的化学式为 B.氧原子的核外电子轨道表示式:
C.为极性分子 D.的VSEPR模型:
8.(2023·山东济南·统考一模)冠醚是由多个二元醇分子之间脱水形成的环状化合物。18-冠-6可用作相转移催化剂,其与形成的螯合离子结构如图所示。下列说法错误的是
A.该螯合离子中碳与氧原子具有相同的杂化类型
B.该螯合离子中所有非氢原子可以位于同一平面
C.该螯合离子中极性键与非极性键的个数比为7∶1
D.与二甲醚()相比,该螯合离子中“C-O-C”键角更大
Ⅱ.能力提升篇
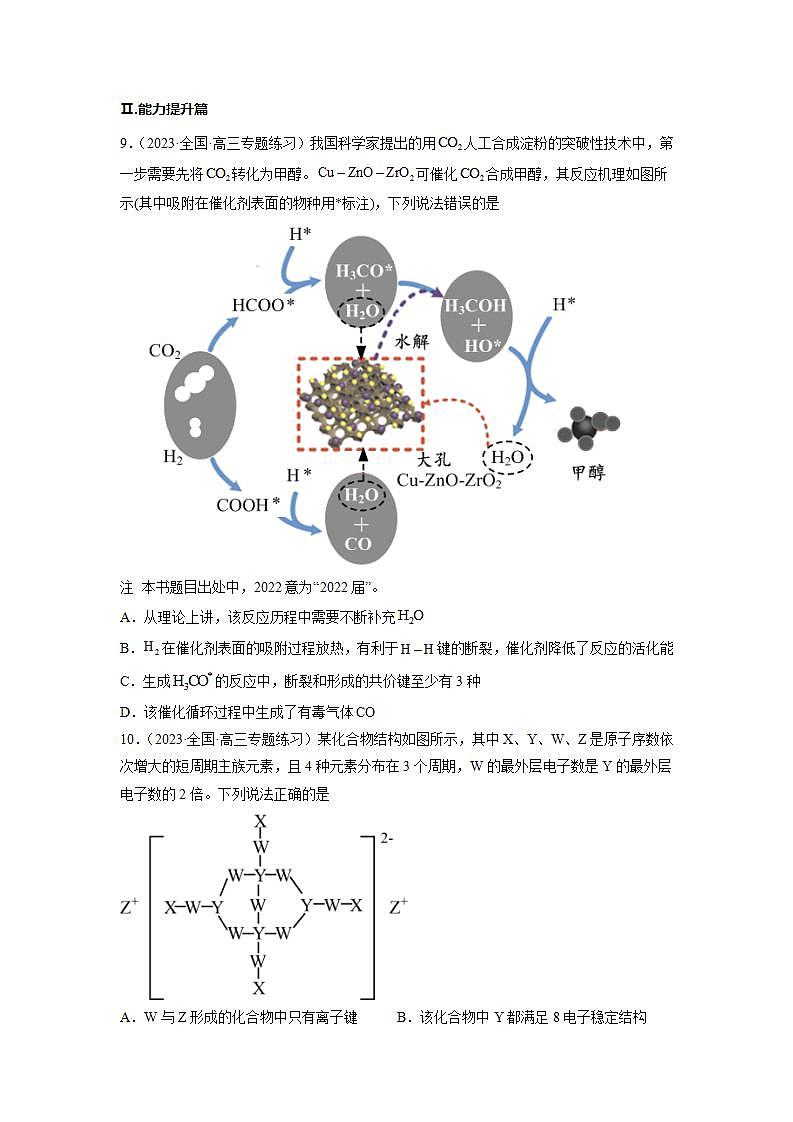
9.(2023·全国·高三专题练习)我国科学家提出的用人工合成淀粉的突破性技术中,第一步需要先将转化为甲醇。可催化合成甲醇,其反应机理如图所示(其中吸附在催化剂表面的物种用*标注),下列说法错误的是
注 本书题目出处中,2022意为“2022届”。
A.从理论上讲,该反应历程中需要不断补充
B.在催化剂表面的吸附过程放热,有利于键的断裂,催化剂降低了反应的活化能
C.生成的反应中,断裂和形成的共价键至少有3种
D.该催化循环过程中生成了有毒气体
10.(2023·全国·高三专题练习)某化合物结构如图所示,其中X、Y、W、Z是原子序数依次增大的短周期主族元素,且4种元素分布在3个周期,W的最外层电子数是Y的最外层电子数的2倍。下列说法正确的是
A.W与Z形成的化合物中只有离子键 B.该化合物中Y都满足8电子稳定结构
C.原子半径:Z>W>Y D.X3YW3是弱酸
11.(2023春·辽宁·高三校联考阶段练习)下列有关说法错误的是
A.基态Ti原子中能量最高的能级有3个空轨道
B.以双聚分子形式存在的FeCl3中Fe的配位数为4
C.乙醇比甲醚的沸点高是因为乙醇分子间能形成氢键
D.价电子排布为5s25p1的元素位于第五周期第IA族,属于s区元素
12.(2023秋·湖北黄冈·高二统考期末)我国科学家研倒出单层(如图所示)半导体,其进一步转化为具有金属性的双层,双层作纳米电子学等领域有巨大潜力。下列说法正确的是
A.单层与互为同素异形体 B.单层中既含极性键又含非极性键
C.双层属新型合金 D.第一电离能,C>N
13.(2023秋·山东菏泽·高二菏泽一中校考开学考试)1,3-唑( )是淡黄色液体,常作为荧光增白剂。下列说法错误的是
A.第一电离能:N>O>C
B.基态氧原子核外电子有8种空间运动状态
C.1mol分子中含有8molσ键
D.分子中C、N原子的杂化方式均为sp2
14.(2023秋·山东菏泽·高二菏泽一中校考开学考试)短周期主族元素X、Y、Z、W、Q形成的化合物结构如图所示。其中Z、W相邻且与Q同周期,Y、Q同主族,X、Z同主族且Z原子半径小。下列说法错误的是
A.X、Y、Z、W四种元素可形成离子化合物
B.原子半径:
C.电负性:
D.X与Z形成的两种常见化合物中,X原子杂化方式相同
15.(2023秋·山东菏泽·高二菏泽一中校考开学考试)第24届冬奥会在北京、张家口两地举办。国家速滑馆“冰丝带”里屡破奥运会纪录,该冰场是冬奥史上“最快冰面”,冰层表面结构如图所示。下列有关说法错误的是
A.冰熔化是吸热的熵增过程
B.第一层固态冰中,水分子间通过氢键形成空间网状结构,密度比液态水小
C.固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性水分子”,使冰面变滑
16.(2023秋·江苏南京·高二南京师大附中校考期末)石灰氮(CaCN2)是一种氮肥,与土壤中的H2O反应生成氰胺(H2N-C≡N),氰胺可进一步转化为尿素[CO(NH2)2]。下列有关说法不正确的是
A.H2O为极性分子 B.中子数为20的钙原子的质量数为40
C.CO(NH2)2属于有机化合物 D.1个H2N-C≡N分子中含3个σ键
17.(2023秋·河北邯郸·高三统考期末)芳樟醇具有铃兰香气,可从香菜中提取,是目前世界上用量最大的香料,其结构简式如图。关于该化合物,下列说法正确的是
A.芳樟醇分子结构中含有手性碳原子
B.分子中C原子有sp、sp2、sp3三种杂化方式
C.与Br2的CCl4溶液反应可能得到2种加成产物(不考虑立体异构)
D.既可发生加聚反应也可发生缩聚反应
18.(2022秋·湖南怀化·高二统考期末)X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大:X原子核外有6种不同运动状态的电子:Y最外层电子数比次外层电子数多3个;Z基态原子的能级成对电子数与未成对电子数相等;Q电子总数是最外层电子的3倍;R是用量最大使用最广泛的金属。下列说法正确的是
A.的价电子排布式为 B.第一电离能
C.的分子空间构型为直线型 D.最简单氢化物分子键角:
二、填空题
Ⅰ.夯实基础篇
19.(2023·全国·高三专题练习)根据要求回答下列问题:
(1)是有机合成中常用的还原剂,中阴离子的空间构型是_______,中心原子的杂化类型为_______,中,存在_______(填标号)。
A.离子键 B.键 C.键 D.配位键
(2)碳氧化物、氨氧化物、二氧化硫的处理和应用是世界各国研究的热点问题。的VSEPR模型为_______;的中心原子的杂化类型为_______;与互为等电子体,且中O只与一个N相连,则的空间构型为_______,分子中的键和键数目之比是_______。
(3)某研究小组将平面形的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。
①“分子金属”可以导电,是因为_______能沿着其中的金属原子链流动。
②“分子金属”中,铂原子不是采取杂化,其理由是_______。
20.(2023·全国·高三专题练习)根据要求回答下列问题:
(1)药物法匹拉韦的主要成分中氮原子的杂化轨道类型为_______。
(2)磷酸根离子的空间构型为_______,其中P的杂化轨道类型为_______;与互为等电子体的阴离子有_______(写出一种离子符号)。
(3)在500~600℃的气相中,氯化铍以二聚体的形式存在,在该二聚体中的杂化方式是_______,中含有配位键的数目为_______(用含的代数式表示,设为阿伏加德罗常数的值)。
21.(2023·全国·高三专题练习)回答下列小题
(1)分子的空间结构为___________,其中的杂化轨道类型为___________。
(2)乙醛中碳原子的杂化轨道类型为___________。
(3)在硅酸盐中,四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构形式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化轨道类型为___________,与O的原子数之比为___________,化学式为___________。
Ⅱ.能力提升篇
22.(2023·全国·高三专题练习)回答下列问题
(1)比较下列分子或离子中的键角大小(填“>”“<”或“=”):
①___________,___________。
②______________________,___________。
③___________,___________。
④___________,___________。
(2)在分子中,键角___________(填“>”“<”或“=”)。理由是___________。
23.(2023秋·山东济宁·高二统考期末)2022年9月,中国科学家首次在嫦娥五号带回的月壤中发现新矿物,并命名为“嫦娥石”。“嫦娥石”属于陨磷钠镁钙石族,其中一种物质的化学式为。请回答下列问题:
(1)钠在火焰上灼烧的黄光是一种_______(填字母)。
a.吸收光谱 b.发射光谱
(2)某同学把O原子价电子的轨道表示式写成了以下形式: ,这种写法违背了_______。
(3)P原子最高能级电子的电子云轮廓形状为_______,其价电子排布式为_______,电负性P_______O(填“>”或“<”)。
(4)PCl3分子空间结构为_______,PCl3与Cl2反应生成PCl5,PCl5结构为 ,PCl5是_______分子(填“极性”或“非极性”),其中P原子的杂化类型是_______(填字母序号)。
a.sp b.sp2 c.sp3 d.sp3d
24.(2023秋·内蒙古通辽·高二开鲁县第一中学校考期末)回答下列问题
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_______(填标号)。
A.[Ne] B.[Ne] C.[Ne] D.[Ne]
(2)Fe成为阳离子时首先失去_______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为_______。
(3)Cu2+基态核外电子排布式为_______。
(4)Mn位于元素周期表中第四周期_______族,基态Mn原子核外未成对电子有_______个。
(5)基态Cl原子有_______种空间运动状态的电子,基态原子价电子排布式_______,属于_______区(填“s”或“p”或“d”或“f”)
(6)LiBH4由Li+和BH构成,与BH互为等电子体的分子为_______,Li、Be、B元素的电离能由大到小排列顺序为_______。
(7)1 mol HCHO分子中含有σ键的数目为_______NA,CS2分子中,存在_______个键和_______个键。
25.(2023·全国·高三专题练习)写出下列微粒的等电子体。
(1)和是等电子体的阴离子有_______、阳离子有_______。
(2)和是等电子体的阴离子是_______。
(3)和是等电子体的分子有_______,阴离子有_______,阳离子有_______。
(4)和是等电子体的阴离子是_______。
(5)和是等电子体的阳离子是_______。
(6)和是等电子体的阴离子是_______。
(7)和是等电子体的阴离子是_______。
(8)和是等电子体的阳离子是_______。
(9)和是等电子体的阴离子是_______。
第二章 分子结构与性质
章末复习
三、单选题
Ⅰ.夯实基础篇
1.(湖南省益阳市2022-2023学年高二上学期期末质量检测化学试题)是常用的氧化剂,其分子结构如下图所示,两个氢原子犹如在半展开的书的页面上。下列关于的说法正确的是
A.是非极性分子
B.分子中含有σ键、π键、氢键
C.在中的溶解度小于在中的溶解度
D.的电子式:
【答案】D
【详解】A.是由极性键和非极性键构成的极性分子,A错误;
B.分子中只含有σ键,B错误;
C.过氧化氢为极性分子,水为极性溶剂而四氯化碳为非极性溶剂,根据相似相溶原理极性分子能溶于极性溶剂知,在中的溶解度大于在中的溶解度,C错误;
D.为共价化合物,各原子达到稳定结构,其电子式为,D正确;
故选D。
2.(2023秋·湖南长沙·高二长沙市实验中学校考期末)下列关于键和键的说法中,不正确的是
A.键和键能同时存在于同一个分子中
B.键是原子轨道“头碰头”重叠形成的,键是原子轨道“肩并肩”重叠形成的
C.乙烯分子中含有5个键和1个键
D.分子中只存在键,分子中只存在键
【答案】D
【详解】A.键和键能同时存在于同一个分子中,如N2分子中含有1个键和2个键,故A正确;
B.键是原子轨道“头碰头”重叠形成的,键是原子轨道“肩并肩”重叠形成的,故B正确;
C.单键为键,双键中有1个键和1个键,乙烯分子的结构式为,含有5个键和1个键,故C正确;
D.分子的结构式为H-H,单键为键,分子中只存在键,N2分子中含有1个键和2个键,故D错误;
选D。
3.(2023春·湖南湘潭·高三湘潭一中校考开学考试)设为阿伏加德罗常数的值,下列叙述正确的是
A.中键的数目为
B.标准状况下,中所含质子总数为
C.中S的价层电子对数为
D.常温下,与足量浓硫酸反应,转移电子的数目为
【答案】C
【详解】A.中与之间有四个配位键是键,分子内有三个键,所以键的数目为,故A错误;
B.在标况下不是气态,无法计算1.12L SO3的物质的量和其所含质子数,故B错误;
C.中S的价层电子对数为,所以中S的价层电子对数为,故C正确;
D.常温下,与足量浓硫酸发生钝化,无法计算转移电子的数目,故D错误;
故选C。
4.(2023·广东·高一学业考试)氯气通入碳酸氢钠溶液中发生反应Cl2+NaHCO3=NaCl+CO2+HClO,下列有关化学用语正确的是
A.Na+的结构示意图: B.CO2的结构式:O—C—O
C.HClO的电子式: D.NaHCO3既含离子键又含共价键
【答案】D
【详解】A.Na+核内有11个质子,A错误;
B.CO2分子中应为碳氧双键,B错误;
C.HClO的电子式应为,C错误;
D.NaHCO3既含有Na+和形成的离子键,又含有 各原子间形成的共价键,D正确;
故选D。
5.(2023春·北京海淀·高三校考开学考试)下列化学用语或图示表达正确的是
A.的电子式 B.砷原子的简化电子排布式为:
C.的模型 D.中的键电子云轮廓图
【答案】D
【详解】A.NaCl是离子化合物,电子式为,故A错误;
B.砷是第33号元素,砷原子的简化电子排布式为,故B错误;
C.SO2价电子对数为3,VSEPR模型为平面三角形,故C错误;
D.Cl原子的价层电子排布式为3s23p5,p轨道上由1个未成对电子,所以两个Cl原子形成的中的键电子云轮廓图,故D正确;
选D。
6.(2023秋·辽宁辽阳·高二校联考期末)下列说法错误的是
A.键的电子云重叠程度比键大,稳定性强
B.N与3个H结合形成分子,体现了共价键的饱和性
C.第三周期主族元素中第一电离能介于和P之间的有3种
D.短周期主族元素中位于s区的有5种
【答案】C
【详解】A.σ键是头碰头形成的,π键是肩并肩形成的,σ键的电子云重叠程度比π健大,稳定性强,A项正确;
B.N原子最外层有5个电子,达到8电子稳定结构需要3个电子,即可以和3给H原子结合形成共价键,是由共价键的饱和性决定的,B项正确;
C.同周期主族元素,第一电离能呈增大趋势,但由于处于全充满,处于半充满的稳定状态,存在反常现象,第一电离能:IIA族>IIIA族,VA族>VI族,第三周期元素的第一电离能:Na<Al<Mg<Si<S<P<Cl<Ar,则第一电离能介于Mg和P之间的元素有Si,S,C项错误;
D.短周期主族元素中位于s区的有5种,分别是H,Li,Na,Be,Mg,D项正确;
答案选C。
7.(2022秋·湖南长沙·高三长沙一中校考阶段练习)下列表示不正确的是
A.绿矾的化学式为 B.氧原子的核外电子轨道表示式:
C.为极性分子 D.的VSEPR模型:
【答案】B
【详解】A.绿矾的化学式为,故A正确;
B.氧原子的核外电子轨道表示式 ,故B错误;
C.中O原子有2个孤电子对,空间构型为V形,结构不对称,为极性分子,故C正确;
D.中S原子价电子对数为3,有1个孤电子对,VSEPR模型:,故D正确;
选B。
8.(2023·山东济南·统考一模)冠醚是由多个二元醇分子之间脱水形成的环状化合物。18-冠-6可用作相转移催化剂,其与形成的螯合离子结构如图所示。下列说法错误的是
A.该螯合离子中碳与氧原子具有相同的杂化类型
B.该螯合离子中所有非氢原子可以位于同一平面
C.该螯合离子中极性键与非极性键的个数比为7∶1
D.与二甲醚()相比,该螯合离子中“C-O-C”键角更大
【答案】B
【详解】A.该螯合离子中碳与氧原子都为,具有相同的杂化类型,A正确;
B.该螯合离子中碳原子为饱和碳原子,链接的氧原子和碳原子不在同一平面,B错误;
C.该螯合离子中极性键为24个、12个C-O和6个配位键,共42个极性键,非极性键为6个键,个数比为7∶1,C正确;
D.与二甲醚()相比,该螯合离子中O的孤对电子数从2对变成1对,排斥作用减小,“C-O-C”键角更大,D正确;
故选B。
Ⅱ.能力提升篇
9.(2023·全国·高三专题练习)我国科学家提出的用人工合成淀粉的突破性技术中,第一步需要先将转化为甲醇。可催化合成甲醇,其反应机理如图所示(其中吸附在催化剂表面的物种用*标注),下列说法错误的是
注 本书题目出处中,2022意为“2022届”。
A.从理论上讲,该反应历程中需要不断补充
B.在催化剂表面的吸附过程放热,有利于键的断裂,催化剂降低了反应的活化能
C.生成的反应中,断裂和形成的共价键至少有3种
D.该催化循环过程中生成了有毒气体
【答案】A
【详解】A.由题图可知,生成的反应有, , ,消耗的反应有,从理论上讲,生成的量多于消耗的量,无需额外补充(根据总反应知反应生成,不消耗,无需补充,A错误;
B.氢气在催化剂表面的吸附过程放热,有利于键的断裂,催化剂改变了反应的路径,降低了反应的活化能,B正确;
C.生成的反应中,可能断裂键或键和键都断裂,同时形成键、键,则断裂和形成的共价键至少有3种,C正确;
D.合成甲醇过程中存在副反应,生成了有毒气体,D正确;
故选:A。
10.(2023·全国·高三专题练习)某化合物结构如图所示,其中X、Y、W、Z是原子序数依次增大的短周期主族元素,且4种元素分布在3个周期,W的最外层电子数是Y的最外层电子数的2倍。下列说法正确的是
A.W与Z形成的化合物中只有离子键 B.该化合物中Y都满足8电子稳定结构
C.原子半径:Z>W>Y D.X3YW3是弱酸
【答案】D
【分析】
【详解】A.由分析可知,W与Z分别为O、Na,可以形成Na2O2,含有共价键,A错误;
B.在图示分子中,1个阴离子带2个负电荷,其中上下2个B分别与O形成4个共价键(其中1个是配位键),满足8电子稳定结构,而左右2个B分别与O形成3个共价键,其周围有6个电子,不满足8电子稳定结构,B错误;
C.Na的电子层数为3,而B、O电子层数都为2,且B在O的左边,所以原子半径:Na>B>O,C错误;
D.X3YW3的化学式为H3BO3,是一元弱酸,D正确;
故选D。
11.(2023春·辽宁·高三校联考阶段练习)下列有关说法错误的是
A.基态Ti原子中能量最高的能级有3个空轨道
B.以双聚分子形式存在的FeCl3中Fe的配位数为4
C.乙醇比甲醚的沸点高是因为乙醇分子间能形成氢键
D.价电子排布为5s25p1的元素位于第五周期第IA族,属于s区元素
【答案】D
【详解】A.基态Ti原子价电子为3d24s2,能量最高的能级为3d能级,结合洪特规则可知有3个空轨道,A正确;
B.FeCl3以双聚分子形式存在 ,Fe的配位数为4,B正确;
C.乙醇能形成分子间氢键,故熔沸点高,C正确;
D.价电子排布为5s25p1的元素位于第五周期第ⅢA族,属于p区元素,D错误;
故选D。
12.(2023秋·湖北黄冈·高二统考期末)我国科学家研倒出单层(如图所示)半导体,其进一步转化为具有金属性的双层,双层作纳米电子学等领域有巨大潜力。下列说法正确的是
A.单层与互为同素异形体 B.单层中既含极性键又含非极性键
C.双层属新型合金 D.第一电离能,C>N
【答案】B
【详解】A.与不是单质,二者不互为同素异形体,故A错误;
B.由图可知,单层中含有C-C和C-N键,既含极性键又含非极性键,故B正确;
C.双层没有金属元素,不属于合金,故C错误;
D.同一种周期元素,从左往右第一电离能有增大的趋势,且N的2p轨道电子是半充满的更加稳定,则第一电离能,C<N,故D错误;
故选B。
13.(2023秋·山东菏泽·高二菏泽一中校考开学考试)1,3-唑( )是淡黄色液体,常作为荧光增白剂。下列说法错误的是
A.第一电离能:N>O>C
B.基态氧原子核外电子有8种空间运动状态
C.1mol分子中含有8molσ键
D.分子中C、N原子的杂化方式均为sp2
【答案】B
【详解】A.C、N、O为相邻的同周期元素,由于N的2p轨道半充满,所以其第一电离能比O大,从而得出第一电离能:N>O>C,A正确;
B.基态氧原子核外电子排布式为1s22s22p4,有1s、2s、三个2p轨道,共有5种空间运动状态,B错误;
C.1,3-唑分子中,含有3个C-Hσ键、2个C-Nσ键、1个C-Cσ键、2个C-Oσ键,则1mol分子中含有8molσ键,C正确;
D.1,3-唑分子中,C、N原子的价层电子对数都为3,所以均发生sp2杂化,D正确;
故选B。
14.(2023秋·山东菏泽·高二菏泽一中校考开学考试)短周期主族元素X、Y、Z、W、Q形成的化合物结构如图所示。其中Z、W相邻且与Q同周期,Y、Q同主族,X、Z同主族且Z原子半径小。下列说法错误的是
A.X、Y、Z、W四种元素可形成离子化合物
B.原子半径:
C.电负性:
D.X与Z形成的两种常见化合物中,X原子杂化方式相同
【答案】B
【分析】根据X、Y、Z、W、Q形成的化合物结构图,Q能形成+1价阳离子,Y、Q同主族,Y、Q为ⅠA族元素,Y能形成1个共价键,则Y是H元素;Z能形成2个共价键,Z是ⅥA族元素,X、Z同主族且Z原子半径小,Z是O元素、X是S元素;Z、W相邻且与Q同周期,Q是Li元素;W为N元素。
【详解】A.S、H、O、N四种元素可形成离子化合物(NH4)2SO4,故A正确;
B.电子层数越多半径越大,电子层数相同,质子数越多半径越小,原子半径:,故B错误;
C.非金属性越强,电负性越大,电负性,故C正确;
D.S与O形成的两种常见化合物中SO2、SO3,S原子价电子对数都是3,杂化方式都是sp2,故D正确;
选B。
15.(2023秋·山东菏泽·高二菏泽一中校考开学考试)第24届冬奥会在北京、张家口两地举办。国家速滑馆“冰丝带”里屡破奥运会纪录,该冰场是冬奥史上“最快冰面”,冰层表面结构如图所示。下列有关说法错误的是
A.冰熔化是吸热的熵增过程
B.第一层固态冰中,水分子间通过氢键形成空间网状结构,密度比液态水小
C.固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性水分子”,使冰面变滑
【答案】C
【详解】A.冰熔化时,破坏一部分氢键,从而吸收热量,同时固态转化为液态,熵值增大,A正确;
B.第一层固态冰中,每个水分子与周围的4个水分子间通过氢键形成空间网状结构,由于分子间距离比液态水大,所以密度比液态水小,B正确;
C.固态水分子之间、“准液体”水分子之间都不存在化学键,只存在分子间作用力(含氢键),C错误;
D.“准液体”中的水分子与下层冰通过氢键连接,当高于一定温度时,氢键断裂,则产生“流动性水分子”,使冰面变滑,D正确;
故选C。
16.(2023秋·江苏南京·高二南京师大附中校考期末)石灰氮(CaCN2)是一种氮肥,与土壤中的H2O反应生成氰胺(H2N-C≡N),氰胺可进一步转化为尿素[CO(NH2)2]。下列有关说法不正确的是
A.H2O为极性分子 B.中子数为20的钙原子的质量数为40
C.CO(NH2)2属于有机化合物 D.1个H2N-C≡N分子中含3个σ键
【答案】D
【详解】A.H2O分子中两个H和一个O不是承一直线排列的,而是有一个为104.5°的键角。 因此结构是氧在一边,两个氢在另一边。氧的电负性较大,因此水是极性分子,A正确;
B.中子数为20的钙原子的质量数为40,B正确;
C.CO(NH2)2是尿素,属于有机化合物,C正确;
D.1个H2N-C≡N分子中含3个σ键单键,碳氮三键中含有1个σ键,则H2N-C≡N分子中含4个σ键,D错误;
故选D。
17.(2023秋·河北邯郸·高三统考期末)芳樟醇具有铃兰香气,可从香菜中提取,是目前世界上用量最大的香料,其结构简式如图。关于该化合物,下列说法正确的是
A.芳樟醇分子结构中含有手性碳原子
B.分子中C原子有sp、sp2、sp3三种杂化方式
C.与Br2的CCl4溶液反应可能得到2种加成产物(不考虑立体异构)
D.既可发生加聚反应也可发生缩聚反应
【答案】A
【详解】A.由结构简式可知,芳樟醇分子中与羟基相连的碳原子为连有4个不同原子或原子团的手性碳原子,故A正确;
B.由结构简式可知,芳樟醇分子中不含有碳碳三键,不含有杂化方式为sp的碳原子,故B错误;
C.由结构简式可知,芳樟醇分子与溴的四氯化碳溶液发生部分加成反应和完全加成反应,所得加成产物可能有5种,故C错误;
D.由结构简式可知,芳樟醇分子可以发生加聚反应,但不能发生缩聚反应,故D错误;
故选A。
18.(2022秋·湖南怀化·高二统考期末)X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大:X原子核外有6种不同运动状态的电子:Y最外层电子数比次外层电子数多3个;Z基态原子的能级成对电子数与未成对电子数相等;Q电子总数是最外层电子的3倍;R是用量最大使用最广泛的金属。下列说法正确的是
A.的价电子排布式为 B.第一电离能
C.的分子空间构型为直线型 D.最简单氢化物分子键角:
【答案】C
【分析】X原子核外有6种不同运动状态的电子,则X是6号元素,X为C,Y最外层电子数比次外层电子数多3个,则Y为N,Z基态原子的能级成对电子数与未成对电子数相等,则为2s22p4,则Z为O,Q电子总数是最外层电子的3倍,则Q为P,R是用量最大使用最广泛的金属,则R是Fe,以此解题。
【详解】A.Fe2+的价电子排布式为,A错误;
B.N的价层电子排布式为2s22p3,是半满的稳定结构,其第一电离能大于O的第一电离能,B错误;
C.中心原子C的价层电子对数为2,是sp杂化,其分子空间构型为直线形,C正确;
D.最简单氢化物和中N的电负性较大,且N—H较短,相邻两个N—H间的斥力较大,键角较大,D错误;
故选C。
四、填空题
Ⅰ.夯实基础篇
19.(2023·全国·高三专题练习)根据要求回答下列问题:
(1)是有机合成中常用的还原剂,中阴离子的空间构型是_______,中心原子的杂化类型为_______,中,存在_______(填标号)。
A.离子键 B.键 C.键 D.配位键
(2)碳氧化物、氨氧化物、二氧化硫的处理和应用是世界各国研究的热点问题。的VSEPR模型为_______;的中心原子的杂化类型为_______;与互为等电子体,且中O只与一个N相连,则的空间构型为_______,分子中的键和键数目之比是_______。
(3)某研究小组将平面形的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。
①“分子金属”可以导电,是因为_______能沿着其中的金属原子链流动。
②“分子金属”中,铂原子不是采取杂化,其理由是_______。
【答案】(1) 正四面体形 ABD
(2) 平面三角形 直线形
(3) 电子 若铂原子为杂化,则该分子的空间构型为四面体形,而非平面结构
【详解】(1)的中心原子的价层电子对数为,孤电子对数为0,采取杂化,则的空间构型为正四面体形;和之间存在离子键,中含有3个σ键和1个配位键。
(2)的中心原子S的价层电子对数为,故的VSEPR模型为平面三角形;
(3)①“分子金属”中不含阴、阳离子,故该物质能导电是因为电子定向移动形成电流。②“分子金属”中,平面形的铂配合物分子进行层状堆砌,铂原子不能采取即杂化,若铂原子为即杂化,则该分子的空间构型为四面体形,而非平面结构。
20.(2023·全国·高三专题练习)根据要求回答下列问题:
(1)药物法匹拉韦的主要成分中氮原子的杂化轨道类型为_______。
(2)磷酸根离子的空间构型为_______,其中P的杂化轨道类型为_______;与互为等电子体的阴离子有_______(写出一种离子符号)。
(3)在500~600℃的气相中,氯化铍以二聚体的形式存在,在该二聚体中的杂化方式是_______,中含有配位键的数目为_______(用含的代数式表示,设为阿伏加德罗常数的值)。
【答案】(1)、
(2) 正四面体形
(3)
【详解】(1)不会分析有机物中原子的价层电子对数而错判。由物质的结构可知,分子中有2个氨原子分别形成3个单键,且还各有1个孤电子对,故其价层电子对数为4,这2个氨原子均采取杂化;有1个氮原子形成1个双键和1个单键,其价层电子对数为3,采取杂化
(2)的中心原子P的价层电子对数为,孤电子对数为0,故其空间构型为正四面体形,中心原子P采取即杂化。寻找离子的等电子体可采用“横换法”,即将P向后换为S,并去掉1个单位的负电荷,为。
(3)二聚体中,与2个形成共价键;此外,提供空轨道,1个提供1个孤电子对,形成配位键,其结构简式为,故采取杂化,中含有配位键,其数目为。
21.(2023·全国·高三专题练习)回答下列小题
(1)分子的空间结构为___________,其中的杂化轨道类型为___________。
(2)乙醛中碳原子的杂化轨道类型为___________。
(3)在硅酸盐中,四面体[如图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构形式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化轨道类型为___________,与O的原子数之比为___________,化学式为___________。
【答案】(1) 三角锥形
(2)
(3) ##
【详解】(1)的中心原子(原子)的价层电子对数为3,所以是杂化,分子的空间结构为三角锥形。
(2)乙醛的结构式为:,醛基中碳原子杂化方式为sp2,甲基中碳原子杂化方式为sp3;
(3)依据图(a)可知,的空间结构类似于甲烷分子,为正四面体形,硅原子的杂化轨道类型和甲烷分子中碳原子的杂化轨道类型相同,为;图(b)是一种无限长单链结构的多硅酸根,每个结构单元中两个氧原子被两个结构单元顶角共用,所以每个结构单元含有1个原子、3个O原子,原子和O原子数之比为,化学式可表示为或。
Ⅱ.能力提升篇
22.(2023·全国·高三专题练习)回答下列问题
(1)比较下列分子或离子中的键角大小(填“>”“<”或“=”):
①___________,___________。
②______________________,___________。
③___________,___________。
④___________,___________。
(2)在分子中,键角___________(填“>”“<”或“=”)。理由是___________。
【答案】(1) > < < < > > > < <
(2) > 键斥力大于键斥力
【详解】(1)①中B原子的价层电子对数为: ,B原子杂化方式为sp2杂化,NCl3中N原子价层电子对数为,N原子杂化方式为sp3杂化,故键角BF3>NCl3;H2O中O原子的价层电子对数为,CS2中C原子的价层电子对数为,C原子杂化方式为sp杂化,键角H2O<CS2;
②H2O中O原子的价层电子对数为,孤电子对数为2,NH3中N原子的价层电子对数为,孤电子对数为1,CH4中C原子的价层电子对数为,中心原子杂化方式均为sp3杂化,孤电子对数越多,斥力越大,键角越小,故键角H2O<NH3<CH4;SO3中S原子的价层电子对数为,S原子杂化方式为sp2杂化,中S原子的价层电子对数为,S原子杂化方式为sp3杂化,键角SO3>;
③H2O中O原子的价层电子对数为,H2S中S原子的价层电子对数为,中心原子电负性越大,对成键电子对吸引力越强,成键电子对越靠近中心原子,斥力越大,键角越大,电负性O>S,故键角H2O>H2S;NCl3中N原子价层电子对数为,N原子杂化方式为sp3杂化,PCl3中P原子价层电子对数为,P原子杂化方式为sp3杂化,中心原子电负性越大,对成键电子对吸引力越强,成键电子对越靠近中心原子,斥力越大,键角越大,电负性N>P,故键角NCl3> PCl3;
④NF3中N原子价层电子对数为,N原子杂化方式为sp3杂化,NCl3中N原子价层电子对数为,N原子杂化方式为sp3杂化,配位原子的电负性越大,对成键电子对吸引力越强,成键电子对越远离中心原子,斥力越小,键角越小,电负性F>Cl,故键角NF3<NCl3;中P原子价层电子对数为,P原子杂化方式为sp3杂化,中P原子价层电子对数为,P原子杂化方式为sp3杂化,配位原子的电负性越大,对成键电子对吸引力越强,成键电子对越远离中心原子,斥力越小,键角越小,电负性Cl>Br,故键角<;
(2)HCHO中C原子杂化方式为sp2杂化,由于键斥力大于键斥力,故键角>。
23.(2023秋·山东济宁·高二统考期末)2022年9月,中国科学家首次在嫦娥五号带回的月壤中发现新矿物,并命名为“嫦娥石”。“嫦娥石”属于陨磷钠镁钙石族,其中一种物质的化学式为。请回答下列问题:
(1)钠在火焰上灼烧的黄光是一种_______(填字母)。
a.吸收光谱 b.发射光谱
(2)某同学把O原子价电子的轨道表示式写成了以下形式: ,这种写法违背了_______。
(3)P原子最高能级电子的电子云轮廓形状为_______,其价电子排布式为_______,电负性P_______O(填“>”或“<”)。
(4)PCl3分子空间结构为_______,PCl3与Cl2反应生成PCl5,PCl5结构为 ,PCl5是_______分子(填“极性”或“非极性”),其中P原子的杂化类型是_______(填字母序号)。
a.sp b.sp2 c.sp3 d.sp3d
【答案】(1)b
(2)泡利原理
(3) 哑铃形 3s23p3 <
(4) 三角锥形 非极性分子 d
【详解】(1)钠在火焰上灼烧的黄光是由于钠灼烧时电子吸收能量,由能量低的基态跃迁到能量高的激发态,处于能量高状态的电子不稳定,会再回到能量低的基态,多余的能量以黄色的光的形式释放出来,因此属于发射光谱,故合理选项是b;
(2)由于在一个原子轨道上不可能存在自旋方向相同的两个电子,因此该图示违背了泡利原理;
(3)P是15号元素,根据构造原理可知基态P原子核外电子排布式是1s22s22p63s23p3,其价电子排布式为3s23p3;可见P原子最高能级是3p能级,该能级的电子的电子云轮廓形状为哑铃形;同一周期元素,原子序数越大,元素的电负性就越大;同一主族元素,原子核外电子层数越少,元素的电负性就越大,所以元素的电负性:O>N>P,故电负性:P<O;
(4)PCl3分子中的中心P原子价层电子对数是3+=4,有1对孤电子对,所以PCl3分子空间结构为三角锥形;根据图示可知PCl5分子是对称结构,分子中正负电荷重心重合,因此PCl5结构为非极性分子;其中P原子形成5个δ共价键,其P原子的杂化类型是sp3d杂化,故合理选项是d。
24.(2023秋·内蒙古通辽·高二开鲁县第一中学校考期末)回答下列问题
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_______(填标号)。
A.[Ne] B.[Ne] C.[Ne] D.[Ne]
(2)Fe成为阳离子时首先失去_______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+价层电子排布式为_______。
(3)Cu2+基态核外电子排布式为_______。
(4)Mn位于元素周期表中第四周期_______族,基态Mn原子核外未成对电子有_______个。
(5)基态Cl原子有_______种空间运动状态的电子,基态原子价电子排布式_______,属于_______区(填“s”或“p”或“d”或“f”)
(6)LiBH4由Li+和BH构成,与BH互为等电子体的分子为_______,Li、Be、B元素的电离能由大到小排列顺序为_______。
(7)1 mol HCHO分子中含有σ键的数目为_______NA,CS2分子中,存在_______个键和_______个键。
【答案】(1)A
(2) 4s 4f5
(3)1s22s22p63s23p63d9
(4) ⅦB 5
(5) 9 3s23p5 p
(6) CH4 Be>B>Li
(7) 3 2 2
【详解】(1)由题给信息知,A和D代表Mg+,B和C代表Mg,Mg+已经失去了一个电子,再失一个电子较难,即第二电离能大于第一电离能,所以电离所需能量A>B;3p能级的能量高于3s,3p能级上电子较3s上易失去,故电离所需能量A>C且A>D,因此A电离最外层一个电子所需能量最大,故选A。
(2)Fe成为阳离子时首先失去4s轨道电子,Sm的价层电子排布式为4f66s2,Sm成为阳离子时首先失去6s轨道电子,再失去4f轨道电子,则Sm3+价层电子排布式为4f5。
(3)Cu基态核外电子排布式为1s22s22p63s23p63d104s1,则Cu2+基态核外电子排布式为1s22s22p63s23p63d9。
(4)Mn位于元素周期表中第四周期ⅦB族,基态Mn原子的排布式为1s22s22p63s23p63d54s2,3d能级有5个轨道,由洪特规则可知,3d能级的电子分别位于不同的轨道,则基态Mn原子核外未成对电子有5个。
(5)基态Cl原子的电子排布式为1s22s22p63s23p5,在不同轨道运动的电子的空间运动状态不同,故有几个轨道就有几种空间运动状态,故有9种空间运动状态的电子,基态原子价电子排布式为3s23p5,属于p区元素。
(6)等电子体的原子总数和价电子总数相同,与BH互为等电子体的分子为CH4,同周期元素从左至右总体上电离能增大,但是由于Be的2s能级处于全充满状态,2p能级为全空状态,较稳定,难失去电子,故Be的电离能比B的电离能大,故Li、Be、B元素的电离能由大到小排列顺序为Be>B>Li。
(7)甲醛的结构式为,单键为键,双键中有且只有一个键,故1 mol HCHO分子中含有σ键的数目为3NA,CS2分子的结构式为S=C=S,则存在2个键和2个键。
25.(2023·全国·高三专题练习)写出下列微粒的等电子体。
(1)和是等电子体的阴离子有_______、阳离子有_______。
(2)和是等电子体的阴离子是_______。
(3)和是等电子体的分子有_______,阴离子有_______,阳离子有_______。
(4)和是等电子体的阴离子是_______。
(5)和是等电子体的阳离子是_______。
(6)和是等电子体的阴离子是_______。
(7)和是等电子体的阴离子是_______。
(8)和是等电子体的阳离子是_______。
(9)和是等电子体的阴离子是_______。
【答案】(1)
(2)
(3)
(4)
(5)
(6)、
(7)
(8)
(9)
【详解】(1)CO分子中含有2个原子、价电子数是10,与CO互为等电子体的阴离子微粒有CN-或,阳离子为,
故答案为:CN-或;;
(2)H2O有3个原子8个价电子,根据等电子体原理可知,与水互为等电子体的阴离子为;
(3)具有相同原子数和最外层电子数的分子或离子叫等电子体,CO2原子数是3,最外层电子数是16,与CO2互为等电子体的分子有,阴离子有,阳离子有;
(4)原子数是3,最外层电子数是18,和是等电子体的阴离子是;
(5)有4个原子8个价电子,根据等电子体原理可知,和是等电子体的阳离子是;
(6)有4个原子24个价电子,根据等电子体原理可知,和是等电子体的阴离子是、;
(7)有4个原子26个价电子,根据等电子体原理可知,和是等电子体的阴离子是;
(8)有5个原子8个价电子,根据等电子体原理可知,和是等电子体的阳离子是;
(9)有5个原子32个价电子,根据等电子体原理可知,和是等电子体的阴离子是。









