



还剩35页未读,
继续阅读
第一章《原子结构与性质》(复习课件)-人教版2019选修第二册
展开
这是一份第一章《原子结构与性质》(复习课件)-人教版2019选修第二册,共43页。
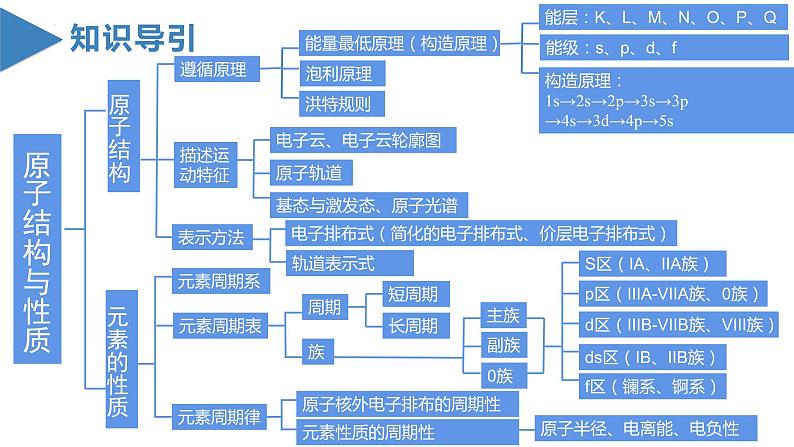
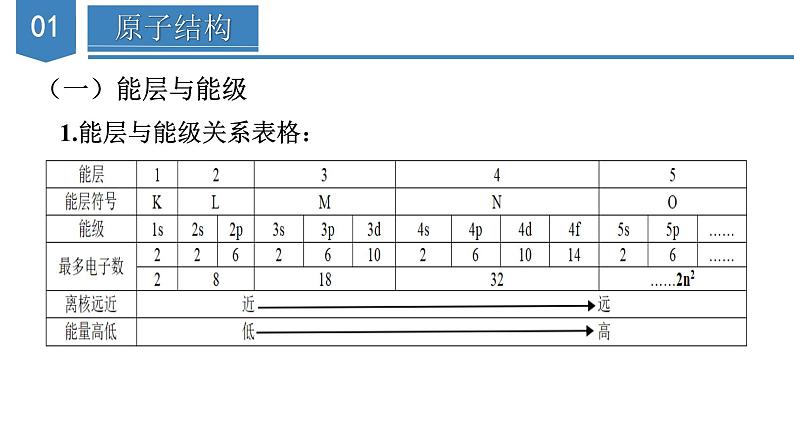
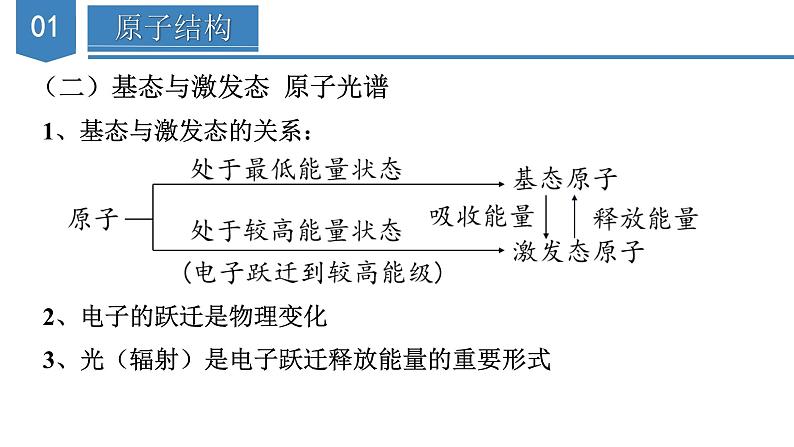
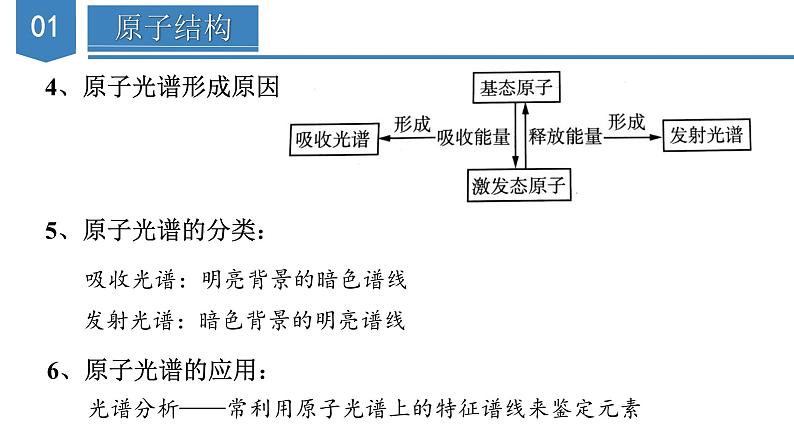
单 元 复 习第一章 原子结构与性质知识导引原子结构与性质原子结构遵循原理能量最低原理(构造原理)能层:K、L、M、N、O、P、Q能级:s、p、d、f构造原理:1s→2s→2p→3s→3p→4s→3d→4p→5s泡利原理洪特规则描述运动特征电子云、电子云轮廓图原子轨道基态与激发态、原子光谱表示方法电子排布式(简化的电子排布式、价层电子排布式)轨道表示式元素的性质元素周期系元素周期表周期短周期长周期族主族副族0族S区(IA、IIA族)p区(IIIA-VIIA族、0族)d区(IIIB-VIIB族、VIII族)ds区(IB、IIB族)f区(镧系、锕系)元素周期律原子核外电子排布的周期性元素性质的周期性原子半径、电离能、电负性原子结构(一)能层与能级1.能层与能级关系表格:2、能层与能级的有关规律(1)能级的个数=所在能层的能层序数(2)s能级最多容纳2个电子,p能级最多容纳6个电子,d能级最多容纳10个 电子,f能级最多容纳14个电子,即1,3,5,7…的2倍(3)英文字母相同的不同能级中所能容纳的最多电子数相同(4)f能级的最小能层为4,d能级的最小能层为3(5)能级能量大小的比较:先看能层,一般情况下,能层序数越大,能量越高;再看同一能层各能级的能量顺序为:E(ns)< E(np)第IIIA族; 第VA族>第VIA族(3)过渡元素的第一电离能的变化不太规则,同周期元素中随 着元素原子核电荷数的增加,第一电离能略有增加。3、逐级电离能的变化规律(1)同一元素的逐级电离能是逐渐增大的,即I1< I2< I3<…(2)当相邻逐级电离能突然变大时,说明失去的电子所在电子层 发生了变化4、电离能的应用(1)推断元素原子的核外电子排布(2)判断主族元素的最高正化合价或最外层电子数(3)判断元素的金属性、非金属性强弱(六)电负性1、变化规律:一般来说,同周期元素从左到右,元素的电负性逐渐变大; 同族元素从上到下,元素的电负性逐渐变小。金属元素的电负性较小,非金属元素的电负性较大。电负性最大的是氟,最小的是铯。2、应用:(1)判断元素的金属性或非金属性强弱①金属元素的电负性一般小于1.8,非金属元素的电负性一般大1.8②金属元素的电负性越小,金属元素越活泼;非金属元素的电负性越 大,非金属元素越活泼(2)判断化学键的类型①如果两种成键元素的电负性差值大于1.7,它们之间通常形成离子键, 但也有特例(如HF)。 ②如果两种成键元素的电负性差值小于1.7,它们之间通常形成共价键, 但也有特例(如NaH)。(3)判断元素的化合价①电负性小的元素易呈现正价②电负性大的元素易呈现负价(4)解释对角线规则3、电负性与第一电离能的关系电负性用于衡量原子吸引键合电子的能力,电负性大的原子吸引电子的能力强,所以一般来说,电负性大的原子对应元素的第一电离能也大【典例1】短周期元素X、Y、Z、M的原子序数依次增大,Z的基态原子2p轨道处于半充满状态,M的最高正化合价与最低负化合价的绝对值之差为4,四种元素组成的一种分子的结构如图所示。下列说法正确的是( )A.电负性:X>Y>Z B.原子半径:Y>Z>X ZC.Y、Z的简单气态氢化物的稳定性:Y>Z D.Y、Z、M的最高价氧化物对应的水化物均为强酸【解析】答案:B。已知X、Y、Z、M为原子序数依次增大的短周期元素,Z的基态原子2p轨道处于半充满状态,则Z为N元素,M的最高正化合价与最低负化合价的绝对值之差为4,则M为S元素,根据题给分子结构中的共价键数目可推知,X为H元素,Y为C元素。一般来说,同周期主族元素从左向右,电负性逐渐增大,同主族元素从上到下,电负性逐渐减小,则电负性:N> C>H,A项错误;H原子核外有1个电子层,而C、N原子核外均有2个电子层,一般来说,电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小,则原子半径:C>N>H,B项正确;非金属性:N>C,则稳定性: NH3>CH4,C项错误;C元素的最高价氧化物对应的水化物为H2CO3,H2CO3为弱酸,D项错误。【典例2】几种短周期元素的原子半径及主要化合价如图所示,下列叙述不正确的是( )A.第一电离能:X>Y>MB.Z的电负性小于WC.Y元素原子核外共有13种不同运动状态的电子D.X的单质可分别与Z、W的单质发生氧化还原反应【解析】答案:A。根据短周期元素的主要化合价与元素的原子半径大小关系可知:X是Mg,Y是Al,M是P,Z是N,W是O。同周期主族元素从左到右,元素的第一电离能呈增大趋势,但第ⅡA、第VA族元素的第一电离能大于同周期相邻元素的第一电离能,所以第一电离能:P>Mg>A1,A项错误;一般来说,同周期主族元素从左到右,电负性逐渐增大,电负性:Ne,电负性:dd>e D.a和b形成的化合物中不可能含共价键【解析】答案:B。短周期元素中,a有-2价,e有+6价,故其均处于第VIA族,可推知a为O元素,e为S元素,b有+1价,原子序数大于O,则b为Na元素,由原子序数可知d处于第三周期,有+5价,则d为P元素。31P和33P的质子数相同,中子数不同,是不同的核素,互为同位素,A项错误;同周期元素从左到右第一电离能呈增大趋势,但是P原子3p能级为半充满稳定状态,第一电离能较大,则第一电离能:P>S,电负性:PH2S>PH3,C项错误;O和Na形成的化合物Na2O2中含有共价键,D项错误。
单 元 复 习第一章 原子结构与性质知识导引原子结构与性质原子结构遵循原理能量最低原理(构造原理)能层:K、L、M、N、O、P、Q能级:s、p、d、f构造原理:1s→2s→2p→3s→3p→4s→3d→4p→5s泡利原理洪特规则描述运动特征电子云、电子云轮廓图原子轨道基态与激发态、原子光谱表示方法电子排布式(简化的电子排布式、价层电子排布式)轨道表示式元素的性质元素周期系元素周期表周期短周期长周期族主族副族0族S区(IA、IIA族)p区(IIIA-VIIA族、0族)d区(IIIB-VIIB族、VIII族)ds区(IB、IIB族)f区(镧系、锕系)元素周期律原子核外电子排布的周期性元素性质的周期性原子半径、电离能、电负性原子结构(一)能层与能级1.能层与能级关系表格:2、能层与能级的有关规律(1)能级的个数=所在能层的能层序数(2)s能级最多容纳2个电子,p能级最多容纳6个电子,d能级最多容纳10个 电子,f能级最多容纳14个电子,即1,3,5,7…的2倍(3)英文字母相同的不同能级中所能容纳的最多电子数相同(4)f能级的最小能层为4,d能级的最小能层为3(5)能级能量大小的比较:先看能层,一般情况下,能层序数越大,能量越高;再看同一能层各能级的能量顺序为:E(ns)< E(np)
相关资料
更多









