



2025届高考化学一轮总复习第1章物质及其变化第5讲氧化还原反应方程式的配平与计算课件
展开1.能利用化合价升降总数相等配平氧化还原反应方程式。2.熟练应用电子守恒法进行氧化还原反应的相关计算。
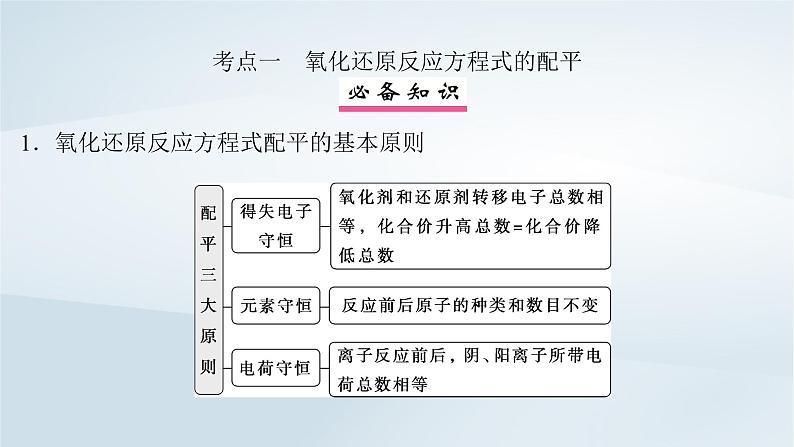
考点一 氧化还原反应方程式的配平 1.氧化还原反应方程式配平的基本原则
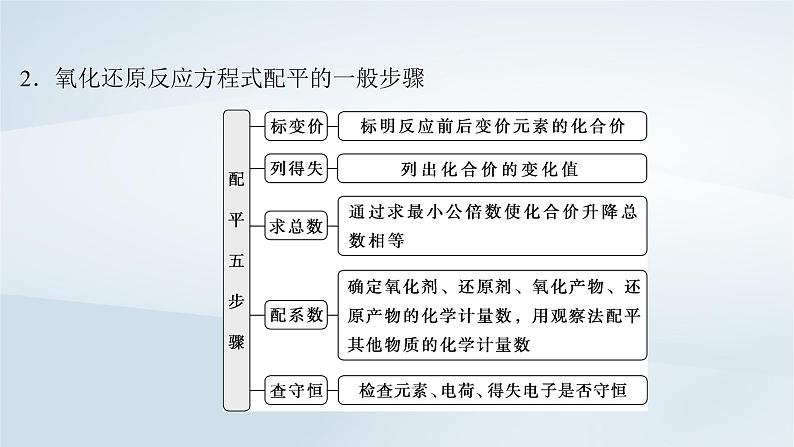
2.氧化还原反应方程式配平的一般步骤
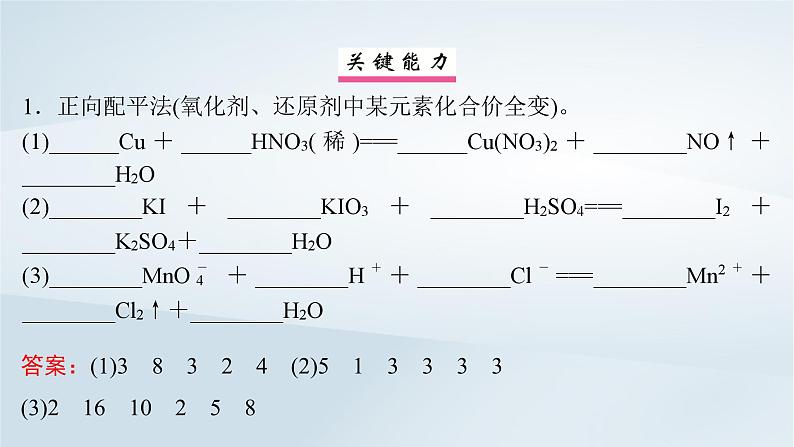
答案:(1)3 8 3 2 4 (2)5 1 3 3 3 3(3)2 16 10 2 5 8
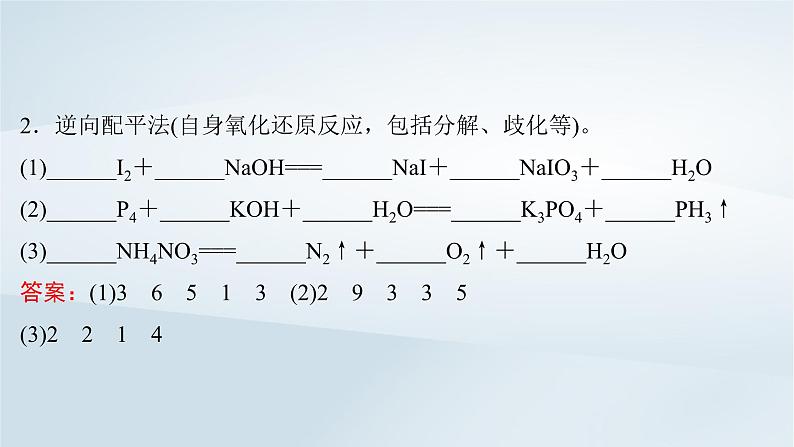
2.逆向配平法(自身氧化还原反应,包括分解、歧化等)。(1)______I2+______NaOH===______NaI+______NaIO3+______H2O(2)______P4+______KOH+______H2O===______K3PO4+______PH3↑(3)______NH4NO3===______N2↑+______O2↑+______H2O答案:(1)3 6 5 1 3 (2)2 9 3 3 5(3)2 2 1 4
[点拨] 逆向配平法适用于一种元素的化合价既升高又降低的反应和分解反应中的氧化还原反应。先确定生成物的化学计量数,然后再确定反应物的化学计量数。例如,
由于S元素的化合价既升高又降低,而且升降总数要相等,所以K2S的化学计量数为2,K2SO3的化学计量数为1,然后确定S的化学计量数为3。
答案:(1)2 1 2H2O 2 1 4H+(2)3 2 4OH- 3 2 5(3)2 5 6H+ 2 5 8
答案:(4)Al2O3 3C N2 2 3CO
(5)将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:________NaBiO3+________Mn2++______===________Na++________Bi3++________+________
答案:(1)4 11 2 8(2)11 15 24 5 6 15
5.有机化学反应方程式的配平。(1)____KClO3+____H2C2O4+____H2SO4===____ClO2↑+____CO2↑+____KHSO4+____H2O(2)________C2H5OH+________KMnO4+________H2SO4===________K2SO4+______MnSO4+________CO2↑+________H2O答案:(1)2 1 2 2 2 2 2(2)5 12 18 6 12 10 33
[点拨] 在有机化合物参与的氧化还原反应方程式的配平中,一般有机化合物中H元素显+1价,O元素显-2价,根据化合物中各元素正负化合价代数和为零的原则,确定碳元素的平均价态,然后进行配平。
考点二 电子守恒法计算 1.电子守恒法计算的原理氧化剂得电子总数=还原剂失电子总数
2.电子守恒法解题的流程
3.多步氧化还原反应的计算有的试题涉及的氧化还原反应较多,数量关系较为复杂,若用常规方法求解比较困难,若抓住失电子总数等于得电子总数这一关系,则解题就变得很简单。解答这类试题时,注意不要遗漏某个氧化还原反应,要厘清具体的反应过程,分析在整个反应过程中化合价发生变化的元素得电子数目和失电子数目,即可迅速求解。
1.24 mL 0.05 ml·L-1的Na2SO3溶液恰好与20 mL 0.02 ml·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则Cr元素在还原产物中的化合价为________。解析:由题意可知,Na2SO3发生失电子的氧化反应,K2Cr2O7发生得电子的还原反应,其中S元素的化合价从+4价升高到+6价,Cr元素的化合价将从+6价降低到+n价。根据氧化还原反应中得失电子守恒,有0.05 ml·L-1×0.024 L×(6-4)=0.02 ml·L-1×0.020 L×2×(6-n),解得n=3,因此Cr元素在还原产物中的化合价为+3价。答案:+3价
2.将Mg、Cu组成的6.6 g 混合物投入适量稀硝酸中恰好完全反应,固体完全溶解时收集到唯一还原产物NO气体2.24 L(标准状况),向反应后的溶液中加入一定量的NaOH溶液,金属离子恰好沉淀完全。形成沉淀的质量为____________。解析:根据得失电子守恒和元素守恒可得关系式:Mg~2e-~2OH-,Cu~2e-~2OH-,即金属转移电子数与其消耗的氢氧根离子数相等,稀硝酸被还原为NO气体且其在标准状况下的体积为2.24 L,物质的量为0.1 ml,所以转移电子的物质的量为0.1 ml×(5-2)=0.3 ml,最终沉淀为Cu(OH)2、Mg(OH)2,即沉淀中氢氧根离子的物质的量为 0.3 ml,所以形成沉淀的质量为6.6 g+0.3 ml×17 g/ml=11.7 g。答案:11.7 g
1.(2023·新高考海南卷)无水BeCl2可用作聚合反应的催化剂。BeO、Cl2与足量C在600~800 ℃ 制备BeCl2的化学方程式为__________________。
由图示转化可知,反应Ⅰ中只有S元素被氧化,反应Ⅱ中As、S元素均被氧化,B项错误;
根据反应Ⅰ、Ⅱ可知,1 ml As2S3发生反应时,两反应转移电子的物质的量分别为12 ml 和28 ml,个数之比为3∶7,D项正确。
3.(2022·新高考河北卷)以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6 颜料。工艺流程如下:
(1)红渣的主要成分为________(填化学式,下同),滤渣①的主要成分为________。(2)还原工序中,不生成S单质的反应的化学方程式为_________________________________________________________。
(3)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为____________,氧化工序发生反应的离子方程式为_______________________________________________________________________________________________。
新高考化学一轮复习讲义课件第1章 第5讲 氧化还原反应的计算与方程式的配平(含解析): 这是一份新高考化学一轮复习讲义课件第1章 第5讲 氧化还原反应的计算与方程式的配平(含解析),共53页。PPT课件主要包含了复习目标,电子守恒法计算,x-1,缺项配平类,Al2O3,H2O,真题演练明确考向,ZnS,课时精练,H3PO4等内容,欢迎下载使用。
新教材(广西专版)高考化学一轮复习第1章物质及其变化第5讲氧化还原反应方程式的配平及计算课件: 这是一份新教材(广西专版)高考化学一轮复习第1章物质及其变化第5讲氧化还原反应方程式的配平及计算课件,共48页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,3x+1,2x-2,x-1,缺项配平等内容,欢迎下载使用。
2025版高考化学一轮总复习第1章化学物质及其变化第5讲氧化还原反应方程式的配平和计算课件: 这是一份2025版高考化学一轮总复习第1章化学物质及其变化第5讲氧化还原反应方程式的配平和计算课件,共60页。PPT课件主要包含了2组合方式,H2↑,H2O,KIO3,氧化剂,还原剂,V1=6V2,KNO3等内容,欢迎下载使用。












