






新教材(广西专版)高考化学一轮复习第1章物质及其变化第5讲氧化还原反应方程式的配平及计算课件
展开1.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,预测物质的化学性质和变化,设计实验进行初步验证,并能分析、解释有关实验现象。2.能进行氧化还原反应方程式的配平与计算。
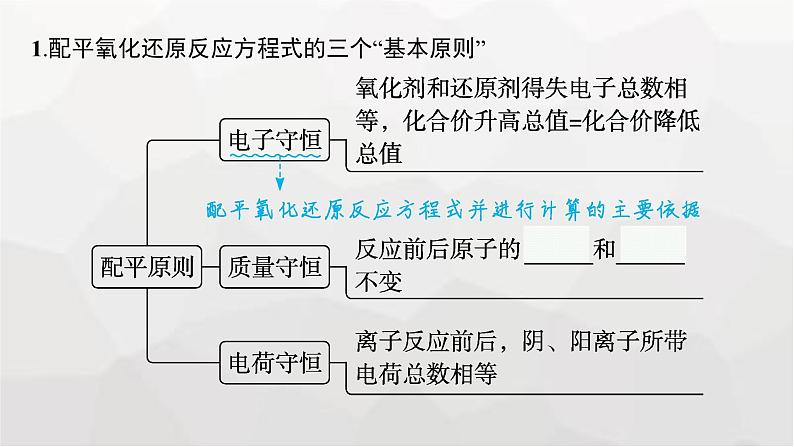
1.配平氧化还原反应方程式的三个“基本原则”
2.配平氧化还原反应方程式的五个“关键步骤”
3.氧化还原反应计算的依据(1)在氧化还原反应中,氧化剂得到电子,还原剂失去电子,且得失电子数目相等,这是氧化还原反应计算的重要依据。(2)关系:n(氧化剂)×单个氧化剂粒子得电子数=n(还原剂)×单个还原剂粒子失电子数。
应用提升 配平氧化还原反应方程式的要点(1)根据元素化合价变化确定氧化剂和还原剂、氧化产物和还原产物。(2)结合得失电子守恒,配平“两剂”和“两产物”的化学计量数。(3)结合质量守恒定律,考虑溶液的酸碱性,在“===”两侧分别添加 “H+、H2O”(酸性)或“OH-、H2O” (碱性)。(4)若为离子方程式,结合电荷守恒配平其他微粒(离子或分子)。
易错辨析 判断正误:正确的画“√”,错误的画“×”。
第三步:求总数,从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数。
故H2S的化学计量数为3,HNO3的化学计量数为2。第四步:配系数,先配平变价元素,再利用原子守恒配平其他元素。3H2S+2HNO3 === 3S↓+2NO↑+4H2O
第五步:查守恒,其他原子在配平时相等,最后利用氧原子守恒来进行验证。
针对训练1.正向配平法(适用于氧化剂和还原剂容易确定的反应)
2.逆向配平(适用于氧化产物和还原产物容易确定的反应)
3.含有未知数的配平
(2)将NaBiO3固体(黄色,微溶)加入MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式。
5.情境方程式的书写(1)酸性KMnO4溶液将乙醇氧化为乙酸,其反应的离子方程式为 。 (2)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中 (B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和[B(OH)4]-,其离子方程式为 。
归纳总结配平氧化还原反应方程式的方法和技巧(1)两种常用方法
(2)“三步法”配平缺项氧化还原反应方程式
典例突破MnO2是重要的化工原料,由软锰矿制备MnO2的一种工艺流程如图:
[资料]软锰矿的主要成分为MnO2,杂质主要有Al2O3和SiO2。(1)电解。Mn2+纯化液经电解得MnO2。生成MnO2的电极反应式是 。 (2)产品纯度测定。向a g产品中依次加入足量b g Na2C2O4和足量稀硫酸,加热至充分反应。再用c ml·L-1 KMnO4溶液滴定剩余Na2C2O4至终点,消耗KMnO4溶液的体积为d L(已知:MnO2及 均被还原为Mn2+。相对分子质量:MnO2-86.94;Na2C2O4-134.0)产品纯度为 (用质量分数表示)。
解析 (1)Mn2+纯化液经电解得MnO2,Mn2+在阳极被氧化生成MnO2,电极反应式为Mn2++2H2O-2e- === MnO2+4H+。
1.取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL 的NO2气体和672 mL的N2O4气体(均已折算为标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
2. 水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:Ⅰ.取样、氧的固定用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。Ⅱ.酸化、滴定将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2( )。
回答下列问题:(1)“氧的固定”中发生反应的化学方程式为 。 (2)取100.00 mL水样经固氧、酸化后,用a ml·L-1 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为 ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为 mg·L-1。
答案 (1)2Mn(OH)2+O2 === 2MnO(OH)2(2)蓝色刚好褪去,且30 s内不恢复原色 80ab解析 (1)“氧的固定”中发生反应的化学方程式为2Mn(OH)2+O2 === 2MnO(OH)2。(2)由始态物质O2中氧元素化合价降低和终态物质Na2S2O3中硫元素化合价升高,再根据氧化还原反应中的得失电子守恒关系可得:
归纳总结“三步法”巧解氧化还原反应的计算题
基于关键信息书写氧化还原反应化学(离子)方程式
例题.Ce2(CO3)3可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO4形式存在,还含有SiO2、Al2O3、Fe2O3、CaF2等物质。以独居石为原料制备Ce2(CO3)3·nH2O的工艺流程如下:
(1)“沉铈”过程中,生成Ce2(CO3)3·nH2O的离子方程式为 。 (2)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为 。
思路指导(1)“沉铈”过程加入NH4HCO3溶液,物质转化:
(2)高温下,物质转化过程:
突破方法“四步法”书写信息型氧化还原反应方程式基于反应前后元素化合价的变化,结合守恒规律,按照“四步法”书写氧化还原反应方程式,具体步骤如下:
针对训练(1) Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为 。
(2) 用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
MnO2与BaS溶液反应转化为MnO的化学方程式: 。
答案 (1)2Cl2+HgO === HgCl2+Cl2O(2)MnO2+BaS+H2O === Ba(OH)2+MnO+S解析 (1)用新制的HgO和Cl2反应来制备Cl2O,该反应是歧化反应,则氧化剂和还原剂都是Cl2,Hg和O元素化合价不变,由此推知还生成HgCl2,结合得失电子守恒和质量守恒配平:2Cl2+HgO === HgCl2+Cl2O。(2)反应物有MnO2、BaS,生成物有MnO,锰元素由+4价降低到+2价,根据工艺流程推知,BaS中硫元素应被氧化为单质S,结合守恒规律配平化学方程式:MnO2+BaS+H2O === Ba(OH)2+MnO+S。
1.(2023湖南卷)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3)褪色的主要原因是发生了以下两种化学反应。
下列说法正确的是( )B.反应Ⅰ和Ⅱ中,元素As和S都被氧化C.反应Ⅰ和Ⅱ中,参加反应的 :Ⅰ<ⅡD.反应Ⅰ和Ⅱ中,氧化1 ml As2S3转移的电子数之比为3∶7
答案 D解析 As2S3在紫外光作用下,主要发生反应Ⅰ:2As2S3+6O2+3H2O ══ 2As2O3+3H2S2O3;As2S3在自然光作用下,主要发生反应Ⅱ:As2S3+7O2+6H2O ══ 2H3AsO4+3H2SO4。
2.(2023北京卷,节选)尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。19世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是 。
答案 AgOCN+NH4Cl ══ CO(NH2)2+AgCl解析 根据原子守恒分析,AgOCN与NH4Cl反应生成尿素和氯化银,化学方程式是AgOCN+NH4Cl ══ CO(NH2)2+AgCl。
3.(2023北京卷,节选)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。(1)将“浸银”反应的离子方程式补充完整:
(2)结合平衡移动原理,解释浸出剂中Cl-、H+的作用: 。
答案 (1)2 4 Cl- 2 Fe2+ (2)Cl-可与Ag2S电离出的Ag+结合生成[AgCl2]-,使平衡正向移动,提高Ag2S的浸出率;H+可抑制Fe3+水解,防止生成Fe(OH)3沉淀
4.(2022全国甲卷,节选)硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
回答下列问题:(1)菱锌矿焙烧生成氧化锌的化学方程式为 。 (2)向80~90 ℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为 。
2025版高考化学一轮总复习第1章化学物质及其变化第5讲氧化还原反应方程式的配平和计算课件: 这是一份2025版高考化学一轮总复习第1章化学物质及其变化第5讲氧化还原反应方程式的配平和计算课件,共60页。PPT课件主要包含了2组合方式,H2↑,H2O,KIO3,氧化剂,还原剂,V1=6V2,KNO3等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第1章物质及其变化第5讲氧化还原反应方程式的配平和计算课件: 这是一份备战2025届新高考化学一轮总复习第1章物质及其变化第5讲氧化还原反应方程式的配平和计算课件,共40页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,氧化剂,还原剂,种类个数,化合价,第二步列得失,e-×2等内容,欢迎下载使用。
新高考化学一轮复习课件 第1章 第5讲 氧化还原反应的计算与方程式的配平: 这是一份新高考化学一轮复习课件 第1章 第5讲 氧化还原反应的计算与方程式的配平,共55页。PPT课件主要包含了高考化学一轮复习策略,电子守恒法计算,归纳整合,专项突破,真题演练明确考向,课时精练等内容,欢迎下载使用。












