



备战2025届新高考化学一轮总复习第1章物质及其变化第5讲氧化还原反应方程式的配平和计算课件
展开1.能从物质类别和元素价态变化的视角说明物质的转化路径。2.能利用得失电子守恒法进行氧化还原反应方程式的配平和计算。3.掌握质量守恒定律及其应用。
考点一 氧化还原反应方程式的配平
考点二 氧化还原反应的计算
考点一氧化还原反应方程式的配平
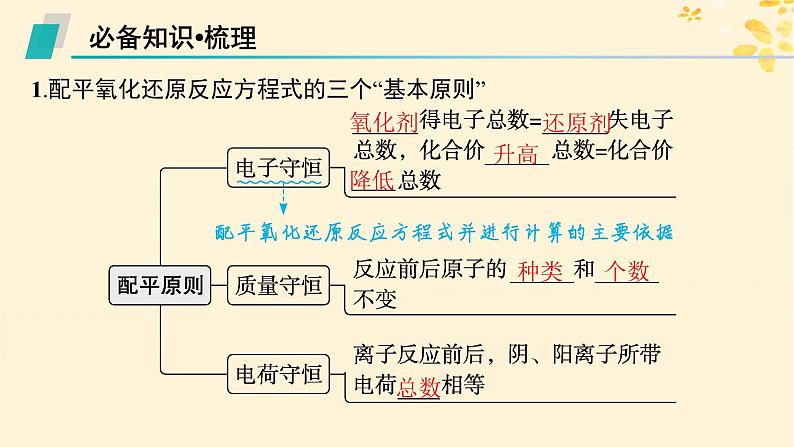
1.配平氧化还原反应方程式的三个“基本原则”
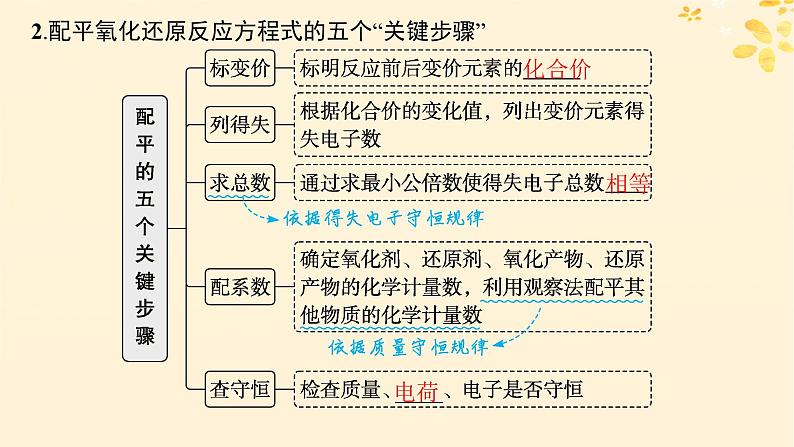
2.配平氧化还原反应方程式的五个“关键步骤”
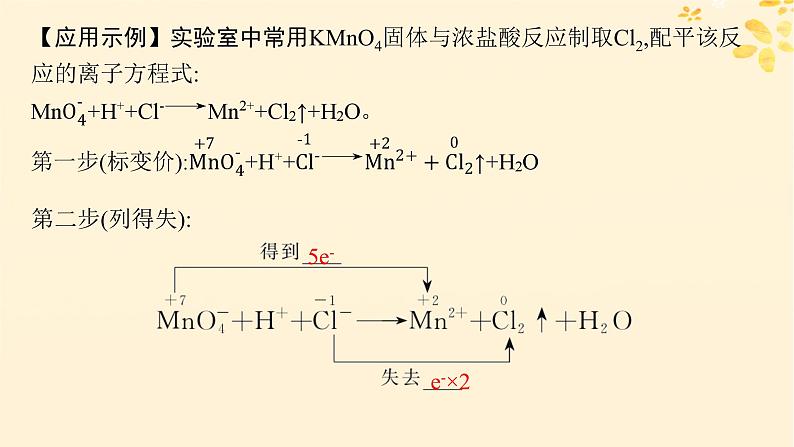
【应用示例】实验室中常用KMnO4固体与浓盐酸反应制取Cl2,配平该反应的离子方程式:
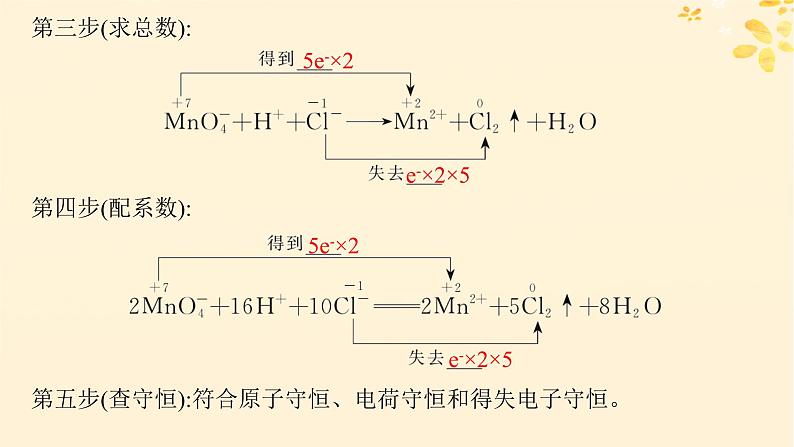
第五步(查守恒):符合原子守恒、电荷守恒和得失电子守恒。
考向1 常规类型方程式的配平例1(高考题节选)(1)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备过程第一步如下:
(2)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O (未配平)。配平后的离子方程式为________________________________。
MnO(OH)2+2I-+4H+═Mn2++I2+3H2O
[对点训练1] 配平下列氧化还原反应方程式。
考向2 缺项型方程式的配平例2(1)(2023·北京卷,节选)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合溶液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。将“浸银”反应的离子方程式补充完整:
[对点训练2] (高考题节选)(1)完成NaClO3氧化FeCl2的离子方程式:
1.氧化还原反应的计算——电子守恒法氧化还原反应计算的基本依据是________得到电子总数=________失去电子总数。
2.“三步法”巧解氧化还原反应的计算题
【应用示例】实验室中可用Na2SO3溶液吸收Cl2尾气,发生反应: Na2SO3+Cl2+H2O═Na2SO4+2HCl。现有500 mL 1.0 ml·L-1 Na2SO3溶液,则最多吸收Cl2的体积为________ L(标准状况)。
解析 第一步:根据化合价变化,找出“两剂”“两产物”:Na2SO3→Na2SO4,S元素化合价升高,则Na2SO3是还原剂,Na2SO4是氧化产物。Cl2→HCl,Cl元素化合价降低,则Cl2是氧化剂,HCl是还原产物。第二步:确定单个粒子得失电子数:Na2SO3→Na2SO4~2e-,Cl2→2HCl~2e-。第三步:根据得失电子守恒列出关系式:n(Na2SO3)×(6-4)=n(Cl2)×2,代入数据:0.5 L×1.0 ml·L-1×2=n(Cl2)×2,n(Cl2)=0.5 ml,在标准状况下的体积为0.5 ml×22.4 L·ml-1=11.2 L。
考向1 多步相关氧化还原反应的计算例1(2021·山东卷,13改编)实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )
A.G与H均为氧化产物B.实验中KMnO4既是氧化剂也是还原剂C.Mn元素至少参与了3个氧化还原反应D.G与H的物质的量之和可能为0.25 ml
解析 KMnO4固体受热分解生成K2MnO4、MnO2和O2,K2MnO4、MnO2均具有氧化性,在加热条件下都能与浓盐酸发生氧化还原反应,反应过程中Cl-被氧化为Cl2,K2MnO4、MnO2被还原为MnCl2,因此气体单质G为O2,气体单质H为Cl2,O2和Cl2均为氧化产物,A正确;KMnO4固体受热分解过程中,Mn元素化合价降低被还原,部分O元素化合价升高被氧化,因此KMnO4既是氧化剂也是还原剂,B正确;含Mn物质的变化:KMnO4→K2MnO4+MnO2, K2MnO4→MnCl2,MnO2→MnCl2,Mn元素化合价均降低,故Mn元素至少参加3个氧化还原反应,C正确;生成1 ml O2转移4 ml电子,生成1 ml Cl2转移2 ml电子,若KMnO4转化为MnCl2过程中得到的电子全部是Cl-生成Cl2所失去,则得到气体的物质的量最大,由2KMnO4~5Cl2可知,n(气体)max=0.25 ml,但该气体中一定含有O2,故最终所得气体的物质的量小于0.25 ml,D错误。
[对点训练1] 实验室中利用洁净的铜片和浓硫酸进行如图实验,经检测所得固体中含有Cu2S和白色物质X,下列说法正确的是( )
A.白色物质X为CuSO4B.NO和Y均为还原产物C.参加反应的浓硫酸中,表现氧化性的占75%D.NO与Y的物质的量之和可能为2 ml
考向2 氧化还原滴定的计算例2(2022·重庆卷,15节选)电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。
(1)沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为________________________________________。
滴入最后半滴KIO3标准溶液,溶液由无色变为蓝色,且半分钟内不褪色
[对点训练2] (2020·山东卷,20节选)某FeC2O4·2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:Ⅰ.取m g样品于锥形瓶中,加入稀硫酸溶解,水浴加热至75 ℃。用c ml·L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30 s内不褪色,消耗KMnO4溶液V1 mL。Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀硫酸酸化后,在75 ℃继续用KMnO4溶液滴定至溶液出现粉红色且30 s内不褪色,又消耗KMnO4溶液V2 mL。样品中所含H2C2O4·2H2O(M=126 g·ml-1)的质量分数表达式为________________________。
进阶1 练易错·避陷阱
进阶2 练热点·提素能
进阶3 研真题·明考向4.(2022·辽宁卷,17节选)取2.50 g H2O2产品,加蒸馏水定容至100 mL摇匀,取20.00 mL置于锥形瓶中,用0.050 0 ml·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为________。
2025届高考化学一轮总复习第1章物质及其变化第5讲氧化还原反应方程式的配平与计算课件: 这是一份2025届高考化学一轮总复习第1章物质及其变化第5讲氧化还原反应方程式的配平与计算课件,共29页。
新教材(广西专版)高考化学一轮复习第1章物质及其变化第5讲氧化还原反应方程式的配平及计算课件: 这是一份新教材(广西专版)高考化学一轮复习第1章物质及其变化第5讲氧化还原反应方程式的配平及计算课件,共48页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,3x+1,2x-2,x-1,缺项配平等内容,欢迎下载使用。
2025版高考化学一轮总复习第1章化学物质及其变化第5讲氧化还原反应方程式的配平和计算课件: 这是一份2025版高考化学一轮总复习第1章化学物质及其变化第5讲氧化还原反应方程式的配平和计算课件,共60页。PPT课件主要包含了2组合方式,H2↑,H2O,KIO3,氧化剂,还原剂,V1=6V2,KNO3等内容,欢迎下载使用。












