





所属成套资源:2025年高中化学新人教版选择性必修1分层作业课件(26份)
人教版 (2019)选择性必修1第一节 化学反应速率作业课件ppt
展开这是一份人教版 (2019)选择性必修1第一节 化学反应速率作业课件ppt,共34页。PPT课件主要包含了答案D,答案C,淀粉溶液,无色溶液变蓝,锥形瓶,水浴加热,加快反应速率等内容,欢迎下载使用。
题组1.化学反应速率的影响因素1.在生产、生活中,下列措施不是用来调控化学反应速率的是( )A.洗衣粉中添加酶B.将鲜肉存放在冰箱中C.向自来水中充入氯气D.冶炼铁时将铁矿石粉碎
解析 洗衣粉中添加酶,酶可作为催化剂加快反应速率,A不符合题意;鲜肉存放在冰箱中,低温环境下细菌腐蚀鲜肉的速率较低,可使鲜肉保存更长时间,B不符合题意;向自来水中充入Cl2可生成HClO,从而达到杀菌消毒的目的,C符合题意;冶炼铁时将铁矿石粉碎,可增大铁矿石与空气的接触面积,从而增大反应速率,D不符合题意。
2.化学反应速率是用来表示化学反应过程进行快慢的物理量,下列措施能减小反应速率的是( )
解析 将铁片换成铁屑,反应物接触面积增大,反应速率增大,A不符合题意;大理石与稀盐酸反应过程中加入NaCl溶液,导致c(H+)减小,反应速率减小,B符合题意;MnO2能催化H2O2分解,反应速率增大,C不符合题意;压缩容器容积,气体浓度增大,反应速率增大,D不符合题意。
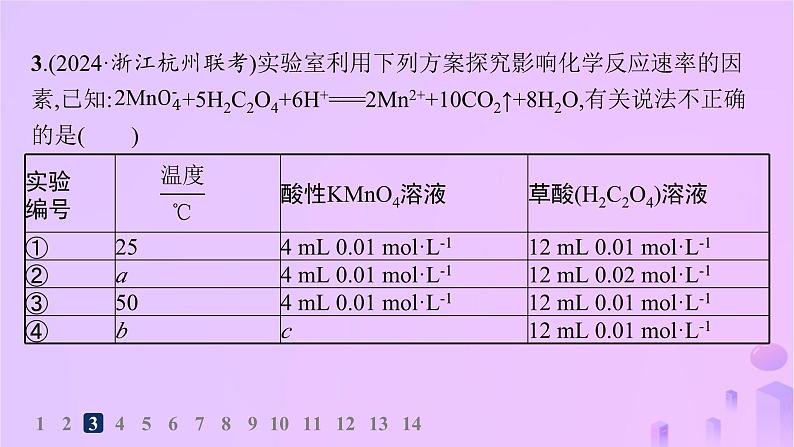
3.(2024·浙江杭州联考)实验室利用下列方案探究影响化学反应速率的因素,已知: +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,有关说法不正确的是( )
A.a=25,实验①②探究的是浓度对于化学反应速率的影响B.实验①③探究的是温度对化学反应速率的影响C.实验中需记录溶液颜色变化所需的时间D.若b=25,c表示4 mL 0.02 ml·L-1,则实验①④也可用于探究化学反应速率的影响因素
解析 实验①②研究草酸的浓度对化学反应速率的影响,则温度应该相同,即a=25,A正确;实验①③中温度不同,c(KMnO4)、c(H2C2O4)均相同,故实验①③探究的是温度对化学反应速率的影响,B正确;由于实验过程中酸性KMnO4溶液的浓度相同,通过高锰酸钾溶液褪色所需要的时间可反映化学反应速率,则实验中需记录溶液颜色变化所需的时间,C正确;若b=25,c表示4 mL 0.02 ml·L-1,则实验④中KMnO4过量,溶液无法褪色,则实验①④不能用于探究化学反应速率的影响因素,D错误。
4.(2024·山东德州模拟)一定条件下,I-可催化SO2在水中发生反应,反应过程分为两步:
某小组设计以下实验探究上述反应速率的影响因素(如图所示,温度都相同),已知:(1)试管①中是18 mL SO2的稀溶液;②③④中均是18 mL SO2的饱和溶液;(2)四组实验中溶液出现浑浊所用时间:①>②>③>④。
下列说法错误的是( )A.通过实验①②可探究SO2的浓度对反应速率的影响B.实验①③可证明酸性条件下I-的催化效果更好C.实验④开始加入I2,发生反应ⅱ生成H+和I-,加快了反应速率
解析 实验①②中温度和NaI溶液的浓度相同,SO2的浓度不同,则实验①②可探究SO2的浓度对反应速率的影响,A正确;实验①③中SO2的浓度和H+的浓度都不同,则实验①③不能证明酸性条件下I-的催化效果更好,B错误;实验④开始加入I2,发生反应ⅱ生成H+和I-,加快了反应速率,C正确;由反应
题组2.活化能5.升高温度时,某化学反应速率增大,主要原因是( )A.分子运动速率加快,使反应物分子的碰撞机会增多B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多C.该化学反应的过程是吸热的D.该化学反应的过程是放热的
解析 升高温度,将更多的分子转化为活化分子,活化分子百分数增大,有效碰撞次数增多,则反应速率增大,故B正确。
6.一定条件,反应2CO(g)+2NO(g) N2(g)+2CO2(g)的反应历程如图所示,下列描述正确的是( )A.该反应过程中共有两个基元反应B.总反应速率快慢由第二步决定C.第二步基元反应为O—N==N—O+CO===N2O+CO2D.该反应所有基元反应均为吸热反应
解析 根据图示,该反应过程包含3个过渡态(“波峰”),故共有3个基元反应,A错误;一般活化能越大,反应速率越慢,慢反应决定总反应速率,第三步基元反应的活化能最大,总反应速率的快慢由第三步决定,B错误;根据图示,第二步基元反应为O—N==N—O+CO===N2O+CO2,C正确;根据图示,该反应第二步基元反应为放热反应,D错误。
7.(2020·天津卷)理论研究表明,在101 kPa和298 K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是( )A.HCN比HNC稳定B.该异构化反应的ΔH=+59.3 kJ·ml-1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热
解析 根据图中信息得到HCN的能量比HNC的能量低,再根据能量越低越稳定可知,HCN比HNC稳定,A正确;根据焓变等于生成物总能量减去反应物总能量可知,该异构化反应的ΔH=59.3 kJ·ml-1-0=+59.3 kJ·ml-1,B正确;根据图中信息得出正反应是吸热反应,因此正反应的活化能大于逆反应的活化能,C正确;使用催化剂,不能改变反应的反应热,只改变反应路径,反应热只与反应物和生成物的总能量有关,D错误。
8.过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论, NO2(g)+CO(g) ===CO2(g)+NO(g)的反应过程如下,下列有关说法正确的是( )
A.第二步活化配合物之间的碰撞一定是有效碰撞B.活化配合物的能量越高,第一步的反应速率越快C.第一步反应需要吸收能量D.该反应的反应速率主要取决于第二步反应
解析 活化分子发生有效碰撞需有合适的取向,故第二步活化配合物之间的碰撞不一定是有效碰撞,A错误;活化配合物的能量越高,反应的活化能越大,第一步的反应速率越慢,B错误;第一步反应为慢反应,活化配合物具有高能量,表明反应的活化能大,且需要吸收能量,C正确;一个化学反应分多步完成时,该反应的反应速率主要取决于慢反应,则题中反应的反应速率决定于第一步反应,D错误。
9.科技工作者运用DFT计算研究在甲醇钯基催化剂表面上制氢的反应过程如图所示。其中吸附在钯催化剂表面上的物种用*标注。
下列说法正确的是( )A.CH3OH吸附在催化剂表面是一个吸热过程B.甲醇在不同催化剂作用下制氢时的焓变是不相同的C.CH3OH(g) CO(g)+2H2(g)的ΔH=+120.5 kJ·ml-1D.CO*+4H*===CO*+2H2(g)是总反应的决速步骤
解析 从图中可以看出,CH3OH的能量比CH3OH*多22.6 kJ·ml-1,则吸附在催化剂表面是放热过程,A错误;催化剂不能改变反应的焓变,因此甲醇在不同催化剂作用下制氢时的焓变是相同的,B错误;CH3OH(g)的相对能量为0,[CO(g)+2H2(g)]的相对能量为97.9 kJ·ml-1,则CH3OH(g) CO(g)+2H2(g)的ΔH=+97.9 kJ·ml-1,C错误;CO*+4H*===CO*+2H2(g)的活化能为113.9 kJ·ml-1-(-65.7 kJ·ml-1)=179.6 kJ·ml-1,该步反应是各步反应中活化能最大的反应,故该步反应是总反应的决速步骤,D正确。
10.(2024·广东广州六校联考)已知光照条件下,甲烷氯化反应是一个自由基型的取代反应。在该反应过程中,经历两步反应,反应1:CH4(g)+Cl·(g)→·CH3(g)+HCl(g);反应2:·CH3(g)+Cl2(g)→CH3Cl(g)+Cl·(g)(·CH3和Cl·分别表示甲基和氯原子)。各物质的相对能量变化如图所示。下列说法不正确的是( )
A.该反应的反应速率由反应1决定B.过渡态结构的稳定性:过渡态1<过渡态2C.CH4(g)+Cl2(g) ===CH3Cl(g)+HCl(g) ΔH=-105.4 kJ·ml-1D.反应1逆反应的活化能为8.3 kJ·ml-1
解析 由图可知,该反应过程中反应1的活化能大,为慢反应,化学反应取决于慢反应,故总反应的反应速率由反应1决定,A正确;过渡态1的能量高于过渡态2,则过渡态结构的稳定性:过渡态1<过渡态2,B正确;由图可知,反应1逆反应的活化能为(16.7-7.5) kJ·ml-1=9.2 kJ·ml-1,D错误。
11.亚硫酸钠和碘酸钾在酸性溶液中发生以下反应: aNa2SO3+bKIO3+cH2SO4===eNa2SO4+fK2SO4+gI2+hH2O。该反应的过程较复杂,一般认为发生以下①~④反应:
应速率快)。下列说法不正确的是( )A.反应①的活化能大于反应④B.该反应总的反应速率由反应①决定C.若预先加入淀粉溶液, 消耗完全时,才会有淀粉变蓝的现象产生D.若反应中有5 ml电子转移,则生成0.5 ml I2
12.室温下,用0.1 ml·L-1 Na2S2O3溶液、0.1 ml·L-1 H2SO4溶液和蒸馏水进行如下表所示的5个实验,并分别测量浑浊度随时间的变化。
下列说法不正确的是( )A.实验③中x=8B.实验①②③或③④⑤均可说明其他条件相同时,增大反应物浓度可增大该反应速率C.降低Na2S2O3溶液的浓度比降低H2SO4溶液浓度对该反应化学反应速率影响程度更大D.将装有实验②的试剂的试管浸泡在热水中一段时间后再混合,其浑浊度曲线应为a
解析 实验发生反应Na2S2O3+H2SO4===SO2↑+S↓+Na2SO4+H2O,浑浊是因为生成了硫单质,浑浊度代表生成硫单质的速率。为避免溶液总体积不同对实验造成的干扰,总体积应相同,故实验③中x=8,A正确;实验①②③其他条件相同,随着Na2S2O3浓度的增大,反应速率加快,实验③④⑤其他条件相同,随着H2SO4浓度的减小,反应速率减慢,说明增大反应物浓度可增大该反应速率,B正确;由①②③和③④⑤的速率变化图像可知,降低Na2S2O3溶液的浓度比降低H2SO4溶液的浓度对该反应化学反应速率影响程度更大,C正确;将装有实验②的试剂的试管浸泡在热水中一段时间,温度升高,反应速率加快,浑浊度曲线变化应更快,D错误。
13.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
回答下列问题:(1)该反应的离子方程式为 。 (2)该实验的目的是 。 (3)实验试剂除了1 ml·L-1 KI溶液、0.1 ml·L-1 H2SO4溶液外,还需要的试剂是 ,实验现象为 。
探究温度对反应速率的影响
4H++4I-+O2===2I2+2H2O
(4)实验操作中除了需要上述条件外,还必须控制 (填字母)不变。 A.温度B.试剂的用量(体积)C.试剂添加的顺序(5)由上述实验记录可得出的结论是 。 (6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的措施是 。
温度每升高10 ℃,反应速率约增大到原来的2倍
保证其他实验条件不变,采用不同浓度的H2SO4溶液进行对比实验
解析 (1)根据得失电子数目相等、电荷守恒和原子守恒,可得该反应的离子方程式为4H++4I-+O2===2I2+2H2O。(2)表中数据只有温度和显色时间,故该实验的目的是探究温度对反应速率的影响。(3)为测定显色时间,产物中有碘单质生成,还需要的试剂是淀粉溶液,实验现象为无色溶液变为蓝色。(4)设计实验必须保证其他条件不变,只改变一个条件,才能得到准确的结论,故还必须控制试剂的用量(体积)和试剂添加的顺序不变。(5)分析实验数据,温度每升高10 ℃,显色时间缩短到原来的一半,故可得出结论:温度每升高10 ℃,反应速率约增大到原来的2倍。(6)若要进行溶液酸性强弱对反应速率影响的探究实验,需保证其他实验条件不变,采用不同浓度的H2SO4溶液进行对比实验。
14.(2024·福建漳州十校联考)NaNO2溶液和NH4Cl溶液可发生反应:NaNO2+NH4 ClN2↑+NaCl+2H2O。为探究反应速率与c(NaNO2)的关系,利用如图装置(夹持仪器略去)进行如下实验。实验步骤:往A中加入V mL的2 ml·L-1 NaNO2溶液、2 ml·L-1 NH4Cl溶液和水,充分搅拌。控制体系温度,通过分液漏斗往A中加入1 ml·L-1醋酸。当导管口气泡均匀稳定地冒出时,开始用排水法收集气体。用秒表测量收集1.0 mL N2所需的时间,重复多次取平均值(t)。回答下列问题:
(1)仪器A的名称为 。 (2)检验装置气密性的方法:关闭止水夹K,__________________________________________________________________________ 。 (3)若需控制体系的温度为36 ℃,采取的合理加热方式为 。 (4)每组实验过程中,反应物浓度变化很小,忽略其对反应速率测定的影响。实验数据如表所示。
向分液漏斗加足量水,打开活塞往A中滴入水,一段时间后水难以滴下,则气密性良好,否则,气密性不好
①V2= ,V4= 。 ②该反应的速率方程为v=k·cm(NaNO2)·c(NH4Cl)·c(H+),k为反应速率常数,利用实验数据计算得m= (填整数)。 ③醋酸的作用是 。
相关课件
这是一份高中化学人教版 (2019)选择性必修1第四节 化学反应的调控作业课件ppt,共17页。PPT课件主要包含了答案A等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文内容课件ppt,共40页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 化学反应速率作业课件ppt,共24页。PPT课件主要包含了反应速率减小,淀粉溶液,无色溶液变蓝等内容,欢迎下载使用。













