

海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题B卷
展开可能用到的相对原子质量:Cl 35.5 H 1 C 12 O 16
一、选择题(共14小题,每小题3分,共42分)
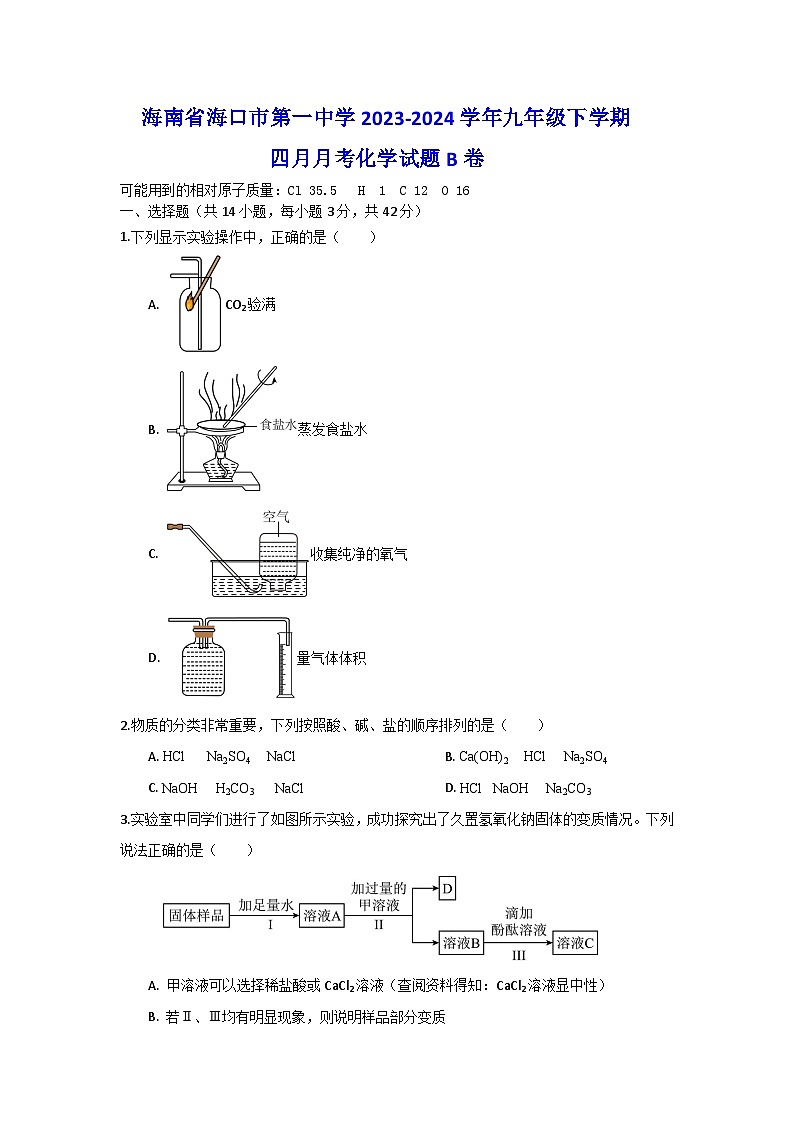
1.下列显示实验操作中,正确的是( )
A. CO2验满
B. 蒸发食盐水
C. 收集纯净的氧气
D. 量气体体积
2.物质的分类非常重要,下列按照酸、碱、盐的顺序排列的是( )
A. HCl Na2SO4 NaClB. Ca(OH)2 HCl Na2SO4
C. NaOH H2CO3 NaClD. HCl NaOH Na2CO3
3.实验室中同学们进行了如图所示实验,成功探究出了久置氢氧化钠固体的变质情况。下列说法正确的是( )
A. 甲溶液可以选择稀盐酸或CaCl2溶液(查阅资料得知:CaCl2溶液显中性)
B. 若Ⅱ、Ⅲ均有明显现象,则说明样品部分变质
C. D物质可能是气体,也可能是沉淀
D. 溶液B中的溶质一定只含有NaOH和甲
4.下列与金属材料有关的说法中,正确的是( )
A. 黄铜片比紫铜片硬度小
B. 铝的活动性比铁强,在空气中更易被腐蚀
C. 钢的性能优良,是纯铁
D. 用Al、ZnSO4溶液和Ag可以验证A1、Zn、Ag的活动性
5.“珍爱生命,拒绝毒品”,青少年更应该对毒品说不,如吸食“冰毒”,会严重破坏人的生理和免疫功能。冰毒主要成分是甲基苯丙胺,下列说法正确的是( )
A. 甲基苯丙胺由C、H、O原子构成
B. 甲基苯丙胺中各元素的质量比为10:15:1
C. 甲基苯丙胺的相对分子质量为149g
D. 一个甲基苯丙胺分子含26个原子
6.下列所示的四个图像能正确反映对应变化关系的是( )
A. 相同质量分数的稀盐酸滴入等体积不同质量分数的KOH溶液
B. 向等质量的镁粉和锌粉中加入浓度相同的稀盐酸至过量
C. 等体积、等质量分数的H2O2溶液分解
D. 向一定量的氢氧化钾和氯化钡的混合溶液中滴加稀硫酸
7.图A、B、C、D四点表示对应选项中溶液的pH,其中不合理的是( )
A. 盐酸B. 碳酸C. 食盐水 D. 石灰水
8.酸是一类重要的物质。以下关于酸的说法正确的是( )
A. 不慎将浓硫酸沾在皮肤上,应立即用大量水冲洗,并涂上石灰水
B. 浓盐酸、浓硫酸敞口放置,溶质质量分数都减小,都具有挥发性
C. 能使石蕊变红的溶液一定是酸的水溶液
D. 硫酸能与硝酸钡溶液反应,盐酸不能与硝酸钡反应
9.下列物质的应用正确的是( )
A. 纯碱用于制肥皂
B. 用消石灰改良碱性土壤
C. 盐酸制药物
D. 食盐配制生理盐水
10.下列实验中,不能达到相应实验目的的是( )
A. 除去CuSO4溶液中的H2SO4:可加入适量的Cu(OH)2充分反应后过滤
B. 分离Fe和CuCl2固体:加水溶解,过滤、洗涤、干燥
C. 鉴别(NH4)2SO4、Na2SO4、NH4NO3三种化肥:取样,分别加入Ba(OH)2溶液,观察现象
D. 检验CaCl2溶液中混有盐酸:取样,滴加碳酸钠溶液,观察是否冒气泡
11.下列有关化学反应的四种基本类型说法不正确的是( )
A. 置换反应不一定在溶液中进行
B. 复分解反应AgNO3+X═Y+AgCl↓,Y盐
C. 化合反应中元素化合价不一定会变
D. 分解反应的产物中可能有化合物
12.归纳总结是化学学习中的重要方法,下列说法中合理的有( )
①水分子、铁原子分别是保持水、铁的化学性质的最小粒子
②洗涤剂、汽油和氢氧化钠都可以除去油污,但原理各不相同
③能产生温室效应的气体除二氧化碳外,还有臭氧、甲烷、氟利代烷等
④纯碱、火碱均属于碱,均可使紫色石蕊试液变蓝
⑤生活中许多物质中都含有酸性和碱性物质,如食醋中含有醋酸,除锈剂中含有盐酸,炉具清洁剂中含有氢氧化钠,治疗胃酸过多症的药物里含有氢氧化铝或碳酸氢钠等物质
A. 2种B. 3种C. 4种D. 5种
13.下表列出了除去物质中所含少量杂质的方法,其中不正确的是( )
A. AB. BC. CD. D
14.在密闭容器内进行某化学反应,测量反应前t0、反应中t1和反应后t2三个时刻甲、乙、丙、丁四种物质的质量分数,得到质量分数分布图分别如下:
下列说法错误的是( )
A. 该反应中,乙是反应物,丁是生成物
B. t1时刻,甲和乙的质量比为5:7
C. 若丙是铜,丁是二氧化碳,则丙、丁的化学计量数之比为1:1
D. 若反应的物质总质量为100g,如果再增加20g甲,则甲与乙可恰好完全反应
二、非选择题(共58分)
15.(8分)相同质量的M、N两种活泼金属,分别与足量的稀盐酸在室温下发生反应(M、N在生成物中的化合价为均为+2价),生成H2的质量m和反应时间t的关系如图所示.
(1)金属活动顺序是M比N (填“强”或“弱”);相对原的相对原子质量是M比N的 (填“大”或“小”) ;
(2)M与稀盐酸反应结束后,消耗稀盐酸中溶质的质量为 g。
16.(10分)A、B、C、D是初中化学常见的物质,这四种物质中均含有同一种元素。其中A为无色气体单质,B、C为氧化物,且B为有毒气体,D是⼤理石的主要成分。它们之间的部分转化关系如图所示(图中反应条件及部分反应物、生成物已省略)。
回答下列问题:
(1)写出D物质的名称______;
(2)写出B与氧化铜反应的化学方程式______;
(3)写出D→C化学方程式______。
17.(10分)市售的“自热米饭”带有一个发热包,遇水后可迅速升温至150 ℃,保温时间达3小时,能将生米做成熟饭。某中学化学兴趣小组对发热包非常感兴趣,进行了以下探究。
【查阅资料】(1)发热包主要由生石灰、铁粉、镁粉、铝粉、炭粉中的若干种组成;
(2)氢氧化镁和氢氧化铝均为不溶于水的白色固体,但后者可溶于NaOH溶液;
【成分探究】取出某品牌的发热包内灰黑色的固体粉末,分成两份。
(1)小吴用磁铁靠近其中一份粉末,发现有黑色物质被磁铁吸引,证明粉末中含有______,用磁铁将该物质全部吸出后,剩余粉末为样品A ;
(2)小周将另一份粉末加水溶解、过滤后,取部分滤液滴入酚酞试液,滤液变______色,证明原粉末中含生石灰;
(3)除上述物质外,还可能存在镁粉、铝粉、炭粉,对此大家提出了以下几种猜想:
猜想一:只存在上述三种中的一种;
猜想二:上述三种同时存在;
猜想三:存在铝粉和炭粉;
猜想四:存在镁粉和铝粉;
猜想五:______。
【实验验证】小施用样品A进行实验,流程如图1。向滤液B滴加氢氧化钠溶液时,他观察到开始时有白色沉淀生成,后来又全部消失,最后得到的是无色溶液E。
【实验结论】不溶物D是______,气体C是______;
大家结合实验现象讨论后,认为猜想______正确,理由是______;
【原理探究】小吴利用如图2装置证明发热包放热主要来自于生石灰与水的反应。加水后发现A中温度迅速升高,B中有气泡产生,该气体为______(填名称)。但温度很快下降,说明该反应很快结束,不能长时间保温。
【猜想】大家大胆猜测应该还有其他放热反应存在。
【实验验证】同学们按资料介绍,用铁粉、炭粉和食盐水在锥形瓶中模拟铁的锈蚀实验,不久后发现锥形瓶外壁微烫,并持续较长时间。该现象很好地解释了发热包的保温机理。
【拓展活动】在上述铁的锈蚀实验中未观察到红色的铁锈产生。老师告诉同学们,铁锈蚀时首先生成一种碱[Fe(OH)2]。请写出该反应的化学方程式______。
18.(10分)KCl和KNO3的部分溶解度数据如表:
(1)40℃时,将30gKCl固体加入到50g水中,充分搅拌后,所得溶液中溶剂与溶液的质量之比为______(填最简整数比);
(2)20℃时,将125g溶质质量分数为20%的KCl溶液变为该温度下的饱和溶液,至少应向溶液中再加入______gKCl固体;
(3)50℃时,将mgKNO3溶液进行如图所示操作:
B溶液是______(填“饱和”或“不饱和”)溶液;m=______。
19.(10分)酸与碱作用生成盐和水的反应,叫中和反应.在用盐酸和氢氧化钠溶液进行中和反应的实验时,反应过程溶液的pH的变化曲线如图所示:
(1)要得到此变化曲线,所进行的操作是 (填序号);
①将稀盐酸滴加到氢氧化钠溶液中
②将氢氧化钠溶液滴加到稀盐酸中
(2)该反应的化学方程式 。
20.(10分)向10g大理石样品(杂质不溶于水,也不与盐酸反应)中分两次加入一定溶质质量分数的稀盐酸,充分反应后烧杯内物质总质量变化如图所示。
请计算:
(1)碳酸钙中钙元素的质量分数为______;
(2)计算所用稀盐酸中溶质质量分数;
(3)反应后溶液的质量为______。
参考答案
15.【答案】(1)强 小 (2)36.5
【解析】(1)根据图象可以看出,金属M需要的时间短,因此M的金属活动性强;而M得到的氢气多,说明M的相对原子质量小,故答案为:强,小
(2)由于M和稀盐酸反应共得到了1g氢气,根据氢元素质量守恒,生成氢气的质量等于消耗的氯化氢中氢元素的质量.在氯化氢中氢元素的质量分数为×100%=×100%,则消耗的稀盐酸中溶质的质量为:=36.5g,故答案为:36.5
或者设消耗掉的HCl的质量为x
M+2HCl=MCl2+H2↑
73 2
x 1g
=
x=36.5g
故答案为36.5.
16.【答案】(1)碳酸钙 (2)
(3)
【解析】【分析】根据A、B、C、D是初中化学常见的物质,其中A为无色气体单质,B、C为氧化物,且B为有毒气体,所以B是一氧化碳,A是氧气,D是大理石的主要成分,所以D是碳酸钙,氧气、一氧化碳都会生成C,所以C是二氧化碳,然后将推出的物质进行验证即可。
【小问1详解】
D是大理石的主要成分,所以D的名称是碳酸钙。
【小问2详解】
B是一氧化碳,能与氧化铜在加热的条件下反应生成铜单质和二氧化碳,反应的化学方程式:。
【小问3详解】
D是碳酸钙,C是二氧化碳,碳酸钙和稀盐酸反应可生成二氧化碳,反应的化学方程式:。
17.【答案】(1)铁粉 (2)红
(3) ①. 存在镁粉和炭粉 ②. 炭粉 ③. H2 ④. 三 ⑤. 滤液B中生成的白色沉淀全部溶解,说明该沉淀是氢氧化铝,原固体中存在铝粉,不含镁 ⑥. 空气 ⑦.
【解析】(1)铁粉可被磁铁吸引,所以用磁铁靠近其中一份粉末,发现有黑色物质被磁铁吸引,证明粉末中含有铁粉;
(2)证明原粉末中含生石灰,生石灰氧化钙和水反应生成氢氧化钙,氢氧化钙溶液未碱性,可使酚酞变红,所以滤液变红色;
(3)根据题目猜想的可能性在镁粉、铝粉、炭粉间进行组合,根据猜想一、猜想二排除只含一种物质或三种物质都含有的情况,则猜想五只能含有两种物质,结合猜想三、猜想四可得出猜想五:存在镁粉和炭粉;
实验结论:样品A中除去了铁粉,则一定有生石灰,可能有镁粉、铝粉、炭粉,加入稀盐酸,氧化钙和盐酸反应生成氯化钙和水,有气体C生成,则气体C为镁与盐酸或铝与盐酸反应生成的氢气;有不溶物D,D为炭粉,炭粉不与盐酸反应;滤液B加入足量氢氧化钠,开始有白色沉淀则可能为氢氧化镁、氢氧化铝,后继续加入氢氧化钠沉淀全部消失,根据查阅资料“(2)氢氧化镁和氢氧化铝均为不溶于水的白色固体,但后者可溶于NaOH溶液”可知,生成的白色沉淀为氢氧化铝,则样品A中含有铝粉、炭粉,不含有镁粉,所以不溶物D是炭粉;样品A中含有铝粉、炭粉,不含有镁粉则猜想三成立,因为加入稀盐酸有不溶物则确定有炭粉,向滤液中加入氢氧化钠溶液开始有白色沉淀,最终全部消失说明有铝粉没有镁粉;
原理探究:A中温度迅速升高,集气瓶中空气受热膨胀进入B中产生气泡,则B中有气泡产生,该气体为空气;
拓展活动:反应物是铁、水和氧气,生成物为氢氧化亚铁,则化学方程式为:。
18.【答案】(1)5:7 (2)9
(3) ①. 不饱和 ②. 203.9
【解析】【小问1详解】
由表中数据可知,40℃时,氯化钾的溶解度为40g,则该温度下,50g水中最多可溶解氯化钾的质量为,则将30gKCl固体加入到50g水中,充分搅拌后,得到饱和溶液,所得溶液中溶剂与溶液的质量之比为50g:70g=5:7。
【小问2详解】
125g溶质质量分数为20%的KCl溶液中氯化钾的质量为125g×20%=25g,溶剂的质量为125g-25g=100g,而20℃时,氯化钾的溶解度为34g,则若想让溶液变为该温度下的饱和溶液,至少还需加入氯化钾的固体质量为34g-25g=9g。
【小问3详解】
由40℃降温到30℃时,析出硝酸钾的质量为38.1g-20g=18.1g,而硝酸钾在40℃和30℃时的硝酸钾分别为63.9g、45.8g,则说明该溶液中水的质量为,则m=100g+45.8g+38.1g+20g=203.9g。
A烧杯中,水的质量的100g+20g=120g,硝酸钾的质量为203.9g-120g=83.9g,则B烧杯中,溶剂质量为100g,硝酸钾质量为83.9g,又由于50℃时,硝酸钾的质量为85.5g>83.9g,则B溶液为不饱和溶液。
19.【答案】(1) ② (2)NaOH+HCl=NaCl+H2O
【解析】分析:(1)根据图象中pH值的变化是从小于7逐渐的增大到大于7,可以分析确定操作的过程,
(2)根据反应物盐酸和氢氧化钠中和生成水和氯化钠的过程,依照书写规则书写化学反应方程式.
解答:解:(1)由图象可知,pH值是从小于7 逐渐的增大到7然后在大于7,可知原溶液是酸性的,然后不断的加碱,使PH升高,故答案为:②,
(2)该题是氢氧化钠和盐酸发生中和反应生成氯化钠和水的过程,故答案为:NaOH+HCl=NaCl+H2O.
点评:本题主要考查了从图象的角度对中和反应的正确理解,要学会这种数形结合的思想
20.【答案】(1)40% (2)根据质量守恒,可知加入50g盐酸时生成的二氧化碳的质量为10g+50g-57.8g=2.2g,设50g盐酸中溶质质量为x,则
解得x=3.65g
则所用稀盐酸中溶质的质量分数为
答:所用稀盐酸中溶质的质量分数为7.3%。
(3)104.2g
【解析】【小问1详解】碳酸钙中钙元素的质量分数为。
【小问2详解】见答案。
【小问3详解】根据质量守恒,可知共生成二氧化碳的质量为10g+50g+50g-106.7g=3.3g,设大理石中碳酸钙的质量为y,则
解得y=7.5g
则大理石中杂质的质量为10g-7.5g=2.5g,则反应后溶液的质量为106.7g-2.5g=104.2g。
选项
物质
所含杂质
除去杂质的方法
A
N2
O2
通过灼热的铜网
B
CO2
CO
通入足量氧气后点燃
C
CaO
CaCO3
高温煅烧
D
FeCl2
CuCl2
加入过量的铁粉,充分反应后,过滤
温度/℃
20
30
40
50
溶解度/g
KCl
34.0
37.0
40.0
42.6
KNO3
31.6
45.8
63.9
85.5
海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题A卷(原卷版+解析版): 这是一份海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题A卷(原卷版+解析版),文件包含海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题A卷解析版docx、海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题A卷原卷版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题B卷(原卷版+解析版): 这是一份海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题B卷(原卷版+解析版),文件包含海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题B卷原卷版docx、海南省海口市第一中学2023-2024学年九年级下学期四月月考化学试题B卷解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
海南省琼海市嘉积中学2023-2024学年九年级下学期四月月考化学试题B卷(原卷版+解析版): 这是一份海南省琼海市嘉积中学2023-2024学年九年级下学期四月月考化学试题B卷(原卷版+解析版),文件包含海南省琼海市嘉积中学2023-2024学年九年级下学期四月月考化学试题B卷原卷版docx、海南省琼海市嘉积中学2023-2024学年九年级下学期四月月考化学试题B卷解析版docx等2份试卷配套教学资源,其中试卷共14页, 欢迎下载使用。












