

湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷(含解析)
展开考试时间:2024年3月11日14:30-17:05 时长:75分钟满分:100分
可能用到的相对原子质量:
一、单选题:本题共15小题,每小题3分,共45分。每小题只有一个正确选项,错选多选不得分。
1.日常使用的金属材料大多数属于合金,下列说法不正确的是
A.超级钢强度很大,能实现钢板的轻薄化
B.稀土元素被称为“冶金工业的维生素”它包含:第三副族的镧系及锗、铷共计17种元素
C.铝合金是用途广泛的合金之一,硬铝是一种铝合金,是制造飞机和宇宙飞船的理想材料
D.储氢合金是一类能大量吸收H2并与H2结合成金属氢化物的新型合金
2.下列物质用途或变化过程与氧化还原反应无关的是
A.FeSO4补铁剂与维生素C配合使用效果更佳
B.将SO2通入到Ca(ClO)2溶液中,生成白色沉淀
C.胃溃疡患者不能用NaHCO3来治疗胃酸过多
D.铝粉和烧碱作管道疏通剂
3.下列有关物质的性质与用途正确且对应关系也正确的是
A.BaSO4不溶于盐酸,“钡餐”常用作医疗上消化系统检查的造影剂
B.浓硝酸有强氧化性,常温下可以和铁反应生成Fe(NO3)3
C.金属铁比铜活泼,可以用FeCl3溶液刻蚀覆铜板
D.二氧化碳不支持燃烧,二氧化碳可用于金属钠着火后灭火
4.下列物质可由化合反应直接制得的有几种
①FeCl2 ②Na[Al(OH)4] ③NO2 ④Fe(OH)3 ⑤Na2CO3 ⑥SO3
A.2种B.3种C.4种D.6种
5.氮及其化合物的转化具有重要应用。下列说法不正确的是
A.“雷雨发庄稼”和合成氨工业都属于氮的固定
B.侯氏制碱法的副产物可以作为氮肥
C.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
D.二氧化硫、氮氧化物溶于雨水会形成酸雨,酸雨的pH约为5.6
6.下列离子方程式书写正确的是
A.Na2CO3溶液中加入少量SO3:
B.向FeI2溶液中通入足量Cl2发生反应:
C.把足量锌粉加入稀硝酸中:
D.等物质的量浓度的Ba(OH)2溶液和NH4HSO4溶液以体积比1∶1混合:
7.为阿伏加德罗常数的值,下列说法错误的是
A.1.9 g 和1.7 g 中含有的电子数均为
B.标准状况下,11.2 L NO与11.2 L O2混合后的分子数目为
C.23 g Na与78 g Na2O2分别与足量水反应生成的气体在标准状况下体积相同
D.1 ml Cu与足量硫粉共热转移的电子数为
8.下列关于化学键和分子间作用力的说法中正确的是
A.由非金属元素形成的化合物一定是共价化合物
B.物质中一定存在化学键
C.CO2溶于水和干冰升华都只有分子间作用力的改变
D.纯碱和烧碱熔化时克服的化学键类型相同
9.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比)化学反应的产物并不改变的是
A.Li和O2B.NaOH和CO2C.Fe和稀硝酸D.木炭(C)和CuO
10.在含有大量Fe2+、、的强酸性溶液中加入下列试剂后,溶液中主要存在的一组离子正确的是
A.通入过量Cl2:、、、、
B.加入少量NaClO溶液:、、、、
C.加入过量NaClO和NaOH的混合溶液:、、、、
D.加入过量NaOH溶液:、、、、
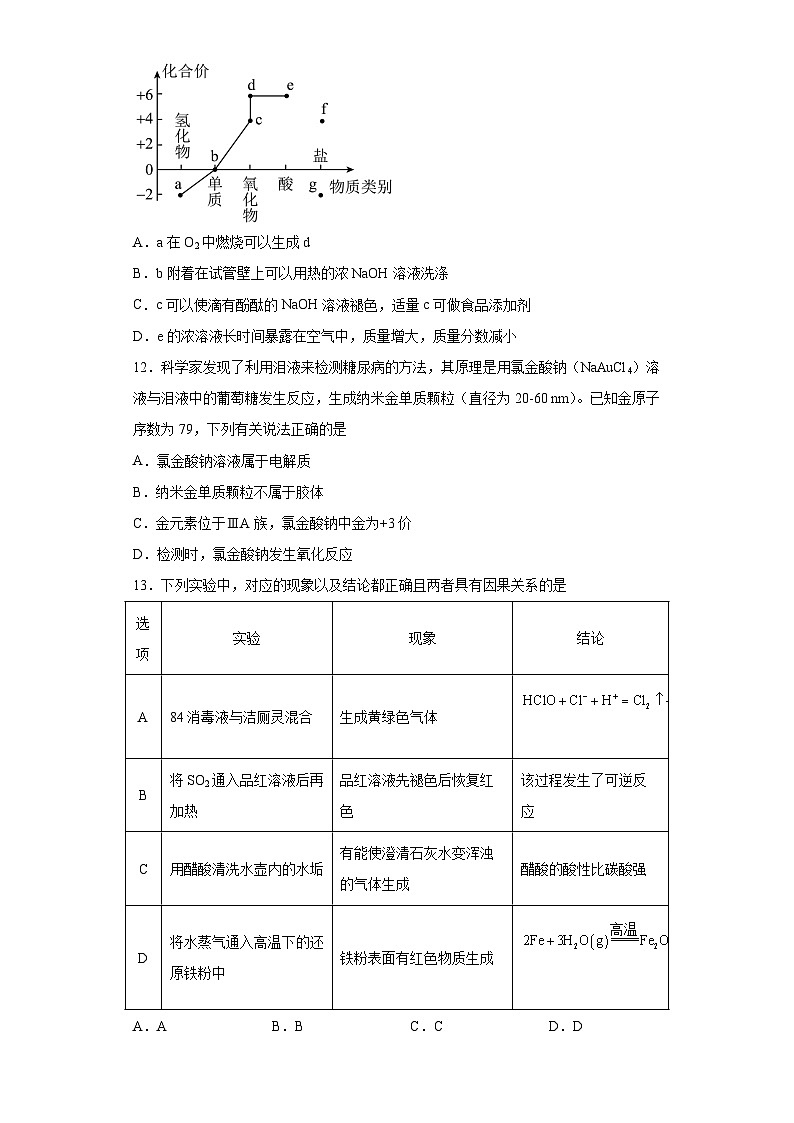
11.部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是
A.a在O2中燃烧可以生成d
B.b附着在试管壁上可以用热的浓NaOH溶液洗涤
C.c可以使滴有酚酞的NaOH溶液褪色,适量c可做食品添加剂
D.e的浓溶液长时间暴露在空气中,质量增大,质量分数减小
12.科学家发现了利用泪液来检测糖尿病的方法,其原理是用氯金酸钠(NaAuCl4)溶液与泪液中的葡萄糖发生反应,生成纳米金单质颗粒(直径为20-60 nm)。已知金原子序数为79,下列有关说法正确的是
A.氯金酸钠溶液属于电解质
B.纳米金单质颗粒不属于胶体
C.金元素位于ⅢA族,氯金酸钠中金为+3价
D.检测时,氯金酸钠发生氧化反应
13.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
A.AB.BC.CD.D
14.用NaCl固体配制一定浓度的NaCl溶液,下列图示对应的操作正确规范的有多少项
A.1项B.2项C.3项D.4项
15.W、X、Y、Z、Q为原子序数依次增大的短周期主族元素,W与Y形成生活中常见的液态化合物,Y的原子序数等于W与X的原子序数之和,Z原子最外层电子数为Y原子最外层电子数的一半,Q的原子半径是第三周期中最小的。下列说法不正确的是
A.Y元素与Z元素组成的化合物可做耐火材料
B.由W、X、Y三种元素所组成的化合物可能是酸也可能是碱
C.由Z和Q形成的化合物在熔融状态下能导电
D.简单氢化物的沸点:X
16.下表是元素周期表的一部分,请回答:
(1)②最高价氧化物的空间构型为。
(2)考古工作者利用元素②的一种核素(写化学式)测定一些文物的年代。
(3)⑧在元素周期表中的位置是。
(4)用电子式表示④的简单氢化物的形成过程。
(5)与⑤同周期的元素中简单离子半径最小的为(填离子符号)。
(6)下列性质的比较,不能用元素周期律解释的是。
A.酸性:HClO4>H2SO3>H2CO3
B.碱性:Ca(OH)2>Mg(OH)2>Be(OH)2
C.稳定性:HF>H2S>PH3
D.非金属性:O>N>Si
E.沸点高低:H2O>H2Se>H2S
(7)有两种化合物A和B都由①④⑤⑦四种元素组成。若A与B在水溶液中能发生离子反应,则该反应的离子方程式为。
17.某学习小组通过下列装置探究MnO2与FeCl3•6H2O能否反应产生Cl2。
实验操作:点燃酒精灯,加热
实验现象:ⅰ.A中部分固体溶解,上方出现白雾
ⅱ.稍后,产生黄色气体,管壁附着黄色液滴
ⅲ.B中溶液变蓝
已知:①溴水为橙色;
②三氯化铁常温下为固体,熔点为282℃,300℃以上易升华,易溶于水。
(1)现象ⅰ中的白雾主要成分是(化学式)的水溶液。
(2)分析现象ⅰ和ⅱ,推测黄色气体的成分,有以下三种可能:
甲.同时存在Cl2和FeCl3 乙.FeCl3 丙.Cl2
①为检验黄色气体中是否存在氯化铁,应将黄色气体通入溶液,溶液变红。黄色气体中存在氯化铁说明氯化铁具有的性质为。
结论:甲或乙成立。
氯化铁可使B中溶液变蓝,反应的离子方程式是。
②为进一步确认黄色气体中存在氯气,该小组提出以下2个方案:
Ⅰ.在A、B间增加盛有某种试剂的洗气瓶C除去FeCl3,观察到B中溶液变为蓝色。C中盛放的试剂是(填字母序号)
A.饱和NaHCO3溶液 B.NaOH溶液 C.饱和NaCl溶液
D.浓硫酸 E.Na2SO3溶液
Ⅱ.将B中KI—淀粉溶液替换为NaBr溶液,B中溶液呈橙色;并检验反应后不存在。检验的原因是。
选择NaBr溶液是由氧化剂氧化性的强弱决定,则、Cl2、Br2的氧化性由强到弱的顺序为。
结论:甲成立。
(3)使用NaOH溶液处理尾气中存在的Cl2所对应的离子反应方程式为。
18.钼酸钠(Na2MO4)具有广泛的用途,可作新型阻燃剂、水处理剂和无公害型冷却水系统的金属抑制剂等。回答下列问题:
Ⅰ.工业通过钼精矿(主要成分MS2中硫为-2价)制备钼酸钠晶体的流程如图所示。
(1)通入空气焙烧钼精矿时,会产生一种有毒气体,工业上使用足量氨水吸收,用化学反应方程式解释原因:。
(2)写出粗产品焙烧的化学方程式。
(3)实验室进行操作1所用的玻璃仪器是:烧杯、、,操作2的步骤是:、、过滤、洗涤、干燥。
(4)操作3中硫元素被氧化为最高价,发生反应的离子方程式为。
Ⅱ.为实现绿色化学,也可从废钼催化剂(主要成分MO3、Al2O3、Fe2O3等)中回收Na2MO4和Al(OH)3,其工艺流程如图:
(5)检验②操作后所得的滤液中含有的实验方法是。
(6)第③步操作中加入H2SO4需要适量,用离子方程式说明原因:(不考虑对的影响)
19.某学习小组根据氨气还原氧化铜的反应,设计实验测定铜元素相对原子质量Ar(Cu)(近似值)。甲同学模拟合成氨工业制备氨气,反应前先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。装置图如下:
已知:实验室用亚硝酸盐和铵盐的混合浓溶液共热制备N2,化学反应方程式为:。请回答下列问题:
(1)C装置应选用(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)装置B的作用是:①使气体混合均匀;②;③。
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为。
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
A.五氧化二磷B.无水CuSO4C.碱石灰D.无水CaCl2
(5)G装置的作用是①;②。
若没有G装置,测得结果Ar(Cu)(填“偏大”“偏小”或“无影响”)。
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。
①A中的固体可为(填化学式)
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=(用含有m1、m2、m3的式子表示)。
选项
实验
现象
结论
A
84消毒液与洁厕灵混合
生成黄绿色气体
B
将SO2通入品红溶液后再加热
品红溶液先褪色后恢复红色
该过程发生了可逆反应
C
用醋酸清洗水壶内的水垢
有能使澄清石灰水变浑浊的气体生成
醋酸的酸性比碳酸强
D
将水蒸气通入高温下的还原铁粉中
铁粉表面有红色物质生成
称量
转移
定容
摇匀
①
②
③
④
⑤
⑥
⑦
⑧
1.B
【详解】A.超级钢强度很大,能实现钢板的轻薄化,A正确;
B.稀土元素被称为“冶金工业的维生素”它包含:第三副族的镧系及钪、钇共计17种元素,B错误;
C.铝合金是用途广泛的合金之一,硬铝是一种铝合金,硬铝的密度小、强度高,是制造飞机和宇宙飞船的理想材料,C正确;
D.储氢合金是一类能大量吸收H2并与H2结合成金属氢化物的新型合金,便于氢的储运,D正确;
故选B。
2.C
【详解】A.维生素C具有还原性可以防止FeSO4氧化变质,两者配合使用效果更佳,物质用途与氧化还原反应有关,A错误;
B.将通入到Ca(ClO)2溶液中,+4价的硫被氧化为+6价生成硫酸钡沉淀,物质变化与氧化还原反应有关,B错误;
C.NaHCO3与胃酸中的盐酸发生复分解反应生成二氧化碳,生成的气体会使胃膨胀,加重胃溃疡的程度,但物质用途与氧化还原反应无关,C正确;
D.铝粉和烧碱反应生成氢气和四羟基合铝酸钠,物质用途与氧化还原反应有关,D错误;
故选C。
3.A
【详解】A.BaSO4不溶于盐酸,也不溶于水,不会被人体吸收,所以可以用作医疗上消化系统检查的造影剂,A正确;
B.常温下浓硝酸能使铁钝化,不能直接和铁反应生成Fe(NO3)3,B错误;
C.FeCl3溶液蚀刻铜板的原理是:2Fe3++Cu= 2Fe2++Cu2+,三价铁离子的氧化性大于铜,C错误;
D.二氧化碳不支持燃烧,但是不能用于金属钠着火后灭火,因为钠燃烧生成的过氧化钠能与二氧化碳反应生成氧气,D错误;
故选A。
4.D
【详解】①FeCl3与Fe发生化合反应生成FeCl2;
②氧化铝、氢氧化钠和水发生化合反应生成Na[Al(OH)4];
③NO和O2发生化合反应生成NO2;
④Fe(OH)2与氧气和水发生化合反应生成Fe(OH)3;
⑤Na2O与CO2发生化合反应生成Na2CO3;
⑥SO2与O2发生化合反应生成SO3;
可由化合反应直接制得的有6种,故选D。
5.D
【详解】A.“雷雨发庄稼”是雷电作用下氮气和氧气反应生成一氧化氮的过程,合成氨工业是氮气和氢气在高温高压催化剂作用下合成氨气的过程,都属于氮的固定,A正确;
B.侯氏制碱法的副产物氯化铵可以作为氮肥,B正确;
C.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”,C正确;
D.二氧化硫、氮氧化物溶于雨水会形成酸雨,因二氧化碳等溶于水正常雨水的pH约为5.6,D错误;
故选D。
6.B
【详解】A.Na2CO3溶液中加入少量SO3:,A错误;
B.向FeI2溶液中通入足量Cl2发生反应:,B正确;
C.锌粉加入稀硝酸中,硝酸是氧化性酸,反应生成一氧化氮气体而不是氢气,C错误;
D.等物质的量浓度的Ba(OH)2溶液和NH4HSO4溶液以体积比1∶1混合:,D错误;
故选B。
7.B
【详解】A.含有8+3-1=10个电子,含有8+1+1=10个电子,1.9 g 的物质的量为=0.1ml,含有的电子数均为,1.7 g 的物质的量为=0.1ml,含有的电子数均为,故A正确;
B.在标况下,11.2LNO物质的量为0.5ml,11.2LO2物质的量为0.5ml,混合反应生成0.5mlNO2,剩余氧气0.25ml,二氧化氮可以聚合为四氧化二氮,混合后所含分子数小于NA,故B错误;
C.23 g Na的物质的量n==1ml,由方程式2Na+2H2O═2NaOH+H2↑可知,生成0.5mlH2,78gNa2O2的物质的量n==1ml,由方程式2Na2O2+2H2O═4NaOH+O2↑可知,生成0.5mlO2,故C正确;
D.1 ml Cu与足量硫粉共热生成Cu2S,Cu元素由0价上升到+1价,转移的电子数为,故D正确;
故选B。
8.D
【详解】A.由非金属元素形成的化合物不一定是共价化合物,如NH4Cl属于离子化合物,A错误;
B.物质中不一定存在化学键,如He、Ar、Kr等单原子分子中不存在任何化学键,B错误;
C.CO2溶于水时会和水发生化学反应,发生化学键的断裂和形成,干冰升华只是改变状态,只改变分子间作用力,C错误;
D.纯碱和烧碱熔化时克服的化学键类型都是离子键,D正确;
故答案为:D。
9.A
【详解】A.Li和O2反应只能生成Li2O,改变反应条件(温度、反应物用量比)化学反应的产物不改变,故A符合题意;
B.NaOH与二氧化碳的反应,如果二氧化碳不足,产物是碳酸钠;如果二氧化碳过量,产物是碳酸氢钙,故B不符合题意;
C.Fe和稀硝酸反应,若Fe过量,产物是硝酸亚铁;如果Fe少量,产物为硝酸铁,故C不符合题意;
D.木炭(C)和CuO反应,若C过量,产物是CO;如果C少量,产物为CO2,故D不符合题意;
故选A。
10.C
【详解】A.通入过量Cl2,将Fe2+完全氧化为Fe3+,溶液的成分为Fe3+、、、、,A错误;
B.加入少量NaClO溶液,将Fe2+氧化为Fe3+,同时HClO是弱酸,故溶液成分为:、、,B错误;
C.加入过量NaClO和NaOH的混合溶液:将Fe2+氧化并沉淀,同时将反应完全生成气体,溶液成分为:Na+、、Clˉ、ClOˉ、OHˉ,C正确;
D.加入过量NaOH溶液,将Fe2+、反应完全生成沉淀和气体,溶液成分为:Na+、、OHˉ,D错误;
故答案为:C。
11.A
【分析】根据部分含硫物质的类别与相应化合价图可知:a是H2S,b是S单质,c是SO2,d是SO3,e是H2SO4,f是亚硫酸盐,g是金属硫化物。
【详解】A.根据分析可知:物质a为H2S,在O2中燃烧可以生成SO2,A错误;
B.S单质可以热的氢氧化钠反应生成硫化钠、亚硫酸钠和水,可以洗涤附着在试管壁上的S,B正确;
C.SO2与NaOH溶液反应使滴有酚酞的NaOH溶液褪色,二氧化硫可以杀菌、抗氧化,所以适量SO2可做食品添加剂,C正确;
D.浓硫酸长时间暴露在空气中,质量增大,质量分数减小,浓硫酸具有吸水性,D正确;
故选A。
12.B
【详解】A.氯金酸钠溶液是混合物,不属于电解质,A错误;
B.纳米金单质颗粒是纯净物,不属于胶体,B正确;
C.金元素位于IB族,氯金酸钠中Na的化合价为+1价,Cl的化合价为-1价,根据化学式各元素的化合价代数和为0可知,金元素的化合价为+3价,C错误;
D.检测时,NaAuCl4转化为Au,Au的化合价降低被还原,发生还原反应,D错误;
故选B。
13.C
【详解】A.84消毒液(次氯酸钠)和洁厕灵(盐酸)发生氧化还原反应生成有毒气体氯气,离子方程式为,A错误;
B.可逆反应是指在同一条件下,反应既可以正向进行,又可以逆向进行,将SO2通入品红溶液后再加热不是同一条件,B错误;
C.水垢的主要成分为碳酸钙,醋酸与碳酸钙反应生成醋酸钙、水和二氧化碳,C正确;
D.将水蒸气通入高温下的还原铁粉中,生成黑色固体,方程式为,D错误;
故选C。
14.A
【详解】称量时应该在称量纸或者滤纸上称量,且左物右码,即称量操作正确;
转移时应该通过玻璃棒引流,但玻璃棒下端需在容量瓶刻度线以下,即转移操作错误;
定容时需要胶头滴管,但胶头滴管不能插入容量瓶中;
摇匀时需右手食指按住瓶塞,左手五指托住容量瓶,上下颠倒摇匀,即摇匀操作错误;
综上分析可知,只有称量操作正确,故答案为:A。
15.C
【分析】W、X、Y、Z、Q为原子序数依次增大的短周期主族元素,W与Y形成生活中常见的液态化合物,W为氢、Y为氧;Y的原子序数等于W与X的原子序数之和,则X为氮;Z原子最外层电子数为Y原子最外层电子数的一半,Z为铝;Q的原子半径是第三周期中最小的,Q为氯,据此分析。
【详解】A.氧化铝熔点高,常做耐火材料,A正确;
B.由H、N、O三种元素所组成的化合物可能是酸(HNO3)也可能是碱(),B正确;
C.氯化铝是共价化合物,熔融状态下不导电,C错误;
D.通常,水呈液态,氨呈气态,简单氢化物的沸点:NH3
16.(1)直线形
(2)
(3)第4周期第ⅠB族
(4)
(5)Al3+
(6)AE
(7)H++=H2O+SO2↑
【分析】由题干元素周期表信息可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为S、⑧为Cu,据此分析解题。
【详解】(1)由分析可知,②为C,②最高价氧化物即CO2是一种直线形分子,其结构式为:O=C=O,故答案为:直线形;
(2)由分析可知,②为C,考古工作者利用元素②的一种核素测定一些文物的年代,故答案为:;
(3)由分析可知,⑧为Cu,⑧在元素周期表中的位置是第4周期第ⅠB族,故答案为:第4周期第ⅠB族;
(4)由分析可知,④为O,用电子式表示④的简单氢化物即H2O的形成过程为:,故答案为:;
(5)由分析可知,⑤为Na,根据电子层数越大微粒半径一般越大,电子层数相同时核电荷数越大半径越小,故与⑤同周期即第三周期的元素中简单离子半径最小的为Al3+,故答案为:Al3+;
(6)A.非金属元素的最高价氧化物对应水化物的酸性才与其非金属性一致,而H2SO3不是S的最高价氧化物对应水化物,故酸性:HClO4>H2SO3>H2CO3,不能用元素周期律解释,A符合题意;
B.同一主族从上往下元素的金属性依次增强,最高价氧化物对应水化物的碱性也依次增强,故碱性:Ca(OH)2>Mg(OH)2>Be(OH)2可以用元素周期律解释,B不合题意;
C.已知元素简单气体氢化物的稳定性与非金属性一致,故稳定性:HF>H2S>PH3能用元素周期律解释,C不合题意;
D.根据同一周期从左往右元素的非金属性依次增强,同一主族从上往下元素的非金属性依次减弱,故非金属性:O>N>C>Si可以用元素周期律解释,D不合题意;
E.沸点高低:H2O>H2Se>H2S是由于H2O中存在分子间氢键,而H2Se的相对分子质量比H2S大,与元素的金属性和非金属性无关,即不能用元素周期律解释,E符合题意;
故答案为:AE;
(7)由分析可知,①为H、④为O、⑤为Na、⑦为S,有两种化合物A和B都由①④⑤⑦四种元素组成,若A与B在水溶液中能发生离子反应即NaHSO4和NaHSO3反应生成Na2SO4、H2O和SO2,则该反应的离子方程式为:H++=H2O+SO2↑,故答案为:H++=H2O+SO2↑。
17.(1)HCl
(2) KSCN 氧化性 2Fe3++2I-=2Fe2++I2 C 排除Fe3+将Br-氧化成Br2的可能性 Cl2>Br2>I2
(3)Cl2+2OH-=Cl-+ClO-+H2O
【分析】由题意可知,加热试管A中二氧化锰与六水氯化铁混合物时,二氧化锰与六水氯化铁反应生成氯化铁、氯化锰、氯气和水,其中氯化铁能与碘化钾溶液发生氧化还原反应生成单质碘,会干扰氯气的检验,利用KSCN溶液可以检验FeCl3存在,利用Cl2能够氧化Br-,而FeCl3不能氧化Br-,可以排除FeCl3的干扰,最后Cl2有毒,需要用NaOH溶液吸收进行尾气处理,据此分析解题。
【详解】(1)形成白雾的原因是FeCl3•6H2O 受热水解,生成HCl气体,同时受热失去结晶水,HCl和H2O结合形成盐酸小液滴,而形成白雾,故答案为:HCl;
(2)①铁离子遇到KSCN 溶液变红,为检验黄色气体中是否存在氯化铁,应将黄色气体通入KSCN溶液,溶液变红,说明含有FeCl3,氯化铁可使B中溶液变蓝,即FeCl3将KI氧化为I2,该反应的离子方程式是2Fe3++2I-=2Fe2++I2,该反应中FeCl3作氧化剂,具有氧化性,即黄色气体中存在氯化铁说明氯化铁具有的性质为氧化性,故答案为:KSCN;氧化性;2Fe3++2I-=2Fe2++I2;
②
Ⅰ.除去Cl2中的FeCl3和O2(H+),若仍能观察到B 中溶液仍变为蓝色,则证明原气体中确实存在Cl2,使用饱和NaCl 溶液,可以让FeCl3溶解,并且除去O2影响过程中提供酸性的HCl 气体,从而排除两个其他影响因素,在A、B间增加盛有某种试剂的洗气瓶C除去FeCl3,观察到B中溶液变为蓝色,饱和NaHCO3溶液、NaOH溶液、Na2SO3溶液均会与Cl2反应,不合题意,而浓硫酸不能除去HCl,不合题意,故该试剂应为饱和NaCl溶液,故答案为:C;
Ⅱ.若B中观察到浅橙红色,则证明有物质能够将Br-氧化成Br2,若未检查到Fe2+,则证明是Cl2氧化的Br-,而不是Fe3+,另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响问题,故答案为:排除Fe3+将Br-氧化成Br2的可能性;
选择NaBr溶液是由氧化剂氧化性的强弱决定,由上述实验可知,发生的反应有:Cl2+2Br-=Br2+2Cl-,Fe3+与Br-不反应,故则Fe3+、Cl2、Br2的氧化性由强到弱的顺序为Cl2>Br2>I2,故答案为:Cl2>Br2>I2;
(3)Cl2与NaOH反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故使用NaOH溶液处理尾气中存在的Cl2所对应的离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。
18.(1)2NH3+H2O+SO2=(NH4)2SO3
(2)MO3+Na2CO3 Na2MO4+CO2
(3) 漏斗 玻璃棒 蒸发浓缩 冷却结晶
(4)MS2+6OH-+9ClO-=MO+2SO+9Cl-+3H2O
(5)用铂丝蘸取滤液,放在酒精灯上灼烧,火焰呈黄色,说明溶液中含有
(6)Al(OH)3+3H+=Al3++3H2O
【分析】Ⅰ.钼精矿(主要成分为MS2)在空气中焙烧得到MO3,根据S元素的价态变化规律可知S元素被氧化成二氧化硫;然后MO3和Na2CO3混合焙烧,得到Na2MO4和二氧化碳,Na2MO4溶于水形成溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到Na2MO4·2H2O,钼精矿(主要成分为MS2)经碱浸并用NaClO氧化,过滤得到Na2MO4溶液。
Ⅱ.废钼催化剂(主要成分MO3、Al2O3、Fe2O3等)和碳酸钠混合焙烧,MO3、Al2O3与Na2CO3的反应和SiO2与Na2CO3的反应相似,加入碳酸钠焙烧时可生成Na2MO4和NaAlO2,溶于水后过滤得到滤渣Fe2O3和含有MO、AlO,第③步操作H2SO4需要适量,避免氢氧化铝溶解,Na2MO4溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到Na2MO4晶体。
【详解】(1)由分析可知,有毒气体为SO2,工业上使用足量氨水吸收SO2,化学反应方程式为:2NH3+H2O+SO2=(NH4)2SO3。
(2)由分析可知,MO3和Na2CO3混合焙烧,得到Na2MO4和二氧化碳,化学方程式为:MO3+Na2CO3 Na2MO4+CO2。
(3)操作1为过滤,所用的玻璃仪器是:烧杯、漏斗、玻璃棒,操作2是为了从溶液中析出晶体,具体的操作步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)操作3中硫元素被氧化为最高价,则NaClO被还原为NaCl,由化合价升降法可配平反应的离子方程式:MS2+6OH-+9ClO-=MO+2SO+9Cl-+3H2O。
(5)检验溶液中含有钠离子,可以用焰色反应实验,如果焰色呈黄色则可以说明含有钠离子,操作方法为:用铂丝蘸取滤液,放在酒精灯上灼烧,火焰呈黄色,说明溶液中含有。
(6)第③步操作H2SO4需要适量,避免氢氧化铝溶解,离子方程式为:Al(OH)3+3H+=Al3++3H2O。
19.(1)Ⅰ
(2) 干燥气体 观察和控制气体的流速
(3)2NH3+3CuON2+3H2O+3Cu
(4)C
(5) 尾气处理 防止空气中水和二氧化碳进入F 偏小
(6) 氧化钙或者氢氧化钠
【分析】实验室用亚硝酸盐、铵盐的混合浓溶液共热制备N2,属于液体和液体混合加热制备气体的反应,则C装置应选用Ⅰ,D为氨气与氧化铜反应装置,F为干燥管,G为尾气处理装置,并同时可以防止空气中水和二氧化碳进入F,据此回答。
【详解】(1)亚硝酸盐、铵盐的混合浓溶液共热制备N2,属于液体和液体混合加热制备气体的反应,C装置应选用为Ⅰ;
(2)B装置有浓硫酸,具有吸水性,可干燥混合气体,还可以使氢气和氮气混合均匀,还可观察和控制气体的流速;
(3)氨气还原炽热氧化铜生成氮气、铜和水,该反应方程式为:2NH3+3CuON2+3H2O+3Cu。
(4)干燥管F装置用于测定生成物水的质量,但不能剩余的吸收氨气,应该为碱石灰,无水硫酸铜检验水的存在,五氧化二磷,无水CaCl2均能吸收氨气;
故选C;
(5)①根据分析可知G装置的作用是尾气处理;
②防止空气中水和二氧化碳进入F;
③若没有G装置,F中会吸收空气中的二氧化碳和水,使m(H2O)得质量偏大,使氧原子的物质的量偏大,n(Cu)=n(CuO)=n(O),使铜的物质的量偏大,测得结果Ar(Cu)偏小;
(6)①A为制备氨气,固体可以是氧化钙或者氢氧化钠;
②CuO的质量为(m2-m1)g,该CuO中含有O的质量为:(m2-m3)g,n(O)=ml,n(Cu)=n(CuO)=n(O)=,Cu的质量为(m3-m1)g,则Cu的摩尔质量为:。
2024湖北省云学名校联盟高一下学期3月联考化学试卷含解析: 这是一份2024湖北省云学名校联盟高一下学期3月联考化学试卷含解析,文件包含湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷原卷版docx、湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷含解析docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
2024湖北省云学名校联盟高二下学期3月联考化学试卷含解析: 这是一份2024湖北省云学名校联盟高二下学期3月联考化学试卷含解析,文件包含湖北省云学名校联盟2023-2024学年高二下学期3月联考化学试卷原卷版docx、湖北省云学名校联盟2023-2024学年高二下学期3月联考化学试卷含解析docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷(无答案): 这是一份湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷(无答案),共6页。试卷主要包含了5 Fe,9 g 和1等内容,欢迎下载使用。












