





第34讲(二) 配合物与超分子-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
展开1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
第六章 物质结构与性质 元素周期律
第34讲 分子的性质 配合物与超分子
1.理解配位键的含义。2.了解超分子的概念。
考点三 配 合 物、超 分 子
⑵条件:中心原子(离子)提供空轨道,配体提供孤电子对
成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
如分子有NH3、H2O、HF、CO 等;离子有F-、Cl-、Br-、I- 、OH-、CN-、SCN-等。
如H+、Al3+、B及过渡金属的原子或离子Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、C3+、Cr3+等。
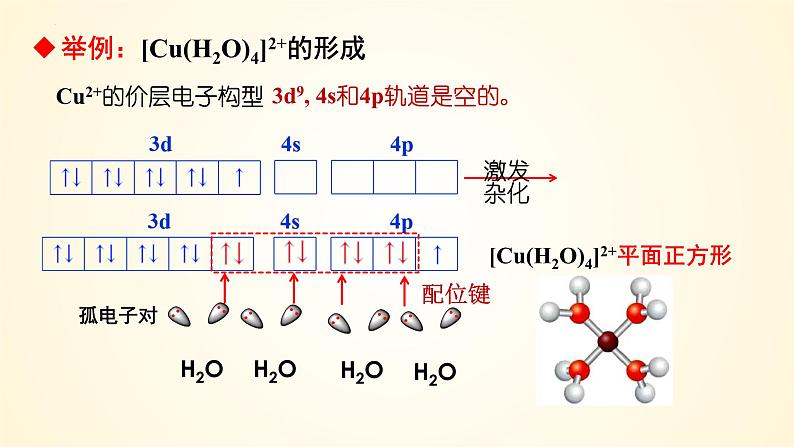
Cu2+的价层电子构型
举例:[Cu(H2O)4]2+的形成
3d9, 4s和4p轨道是空的。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
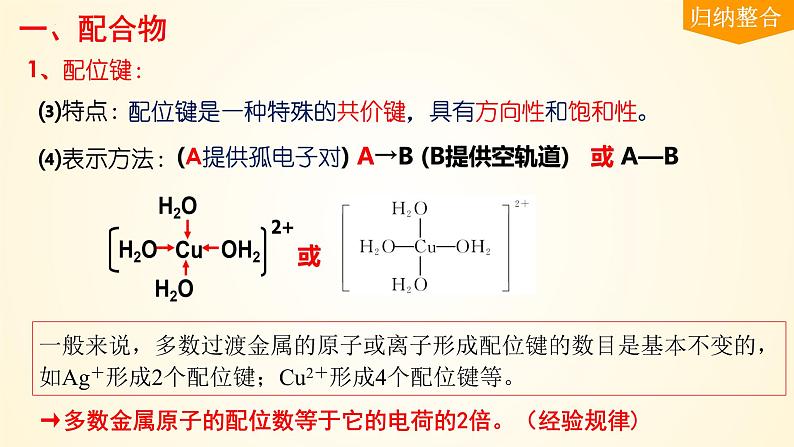
(A提供孤电子对) A→B (B提供空轨道) 或 A—B
配位键是一种特殊的共价键,具有方向性和饱和性。
→多数金属原子的配位数等于它的电荷的2倍。(经验规律)
(1)相同原子间形成的配位键与它们之间形成的共价单键相同,如
NH4+的空间结构是正四面体形
(2)配位键一般是共价单键,属于σ键。
中的4个N-H(键能、键长和键角)完全相同,
1.下列不能形成配位键的组合是A.Ag+、NH3 B.H2O、H+ C.C3+、CO D.Ag+、H+
2.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是 ①H2O ②NH3 ③F- ④CN- ⑤COA.①② B.①②③ C.①②④ D.①②③④⑤
(1)中心原子(离子):提供空轨道的金属离子或原子。一般是过渡金属,必须有空轨道。
(2)配位体:含有孤电子对的分子或离子,如 NH3 H2O CO Cl- SCN- CN-
(3)配位原子:配位体中具有孤电子对的原子N O P S,一般是ⅤA Ⅵ A ⅦA的非金属原子
(4)配位数:直接同中心原子配位的分子或原子数目,一般是2、4、6、8
(5)配离子的电荷:等于中心离子和配体总电荷的代数和,如[Fe(SCN)6]3-
1).概念:把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以 配位键 结合形成的化合物称为配位化合物,简称配合物。
如氢氧化二氨合银{[Ag(NH3)2]OH}、硫酸四氨合铜[Cu(NH3)4]SO4}等
= [Cu(H2O)4]2+
配合物由内界和外界构成,配合单元是内界,内界由中心离子(原子)和配体构成。外界是带异号电荷的离子。
内界与外界以离子键结合,在水中完全电离,内界较稳定。
配位原子:配体中给出孤电子对与中心形成配位键的原子。
如H2O中O,CO中的C,NH3中的N 。
内界微粒很难电离(电离程度很小),因此,配合物[C(NH3)5C1]Cl2内界中的C1—不能被Ag+沉淀,只有外界的C1—才能与AgNO3溶液反应产生沉淀。
配合物在水溶液中电离成内界和外界两部分, 如 [C(NH3)5Cl]Cl2 = [C(NH3)5C1]2+ + 2C1—,
请根据给出的配合物完成下表
[Ag(NH3)2]+
[Fe(CN)6]3-
[C(NH3)5Cl]2+
配合物结构小结: 2、中心粒子可以是阳离子,也可以是中性原子; 3、配位体可以是离子或分子,可以有一种或同时存在多种; 4、配位数通常为2、4、6、8这样的偶数。
1.有些配合物没有外界;如 Ni(CO)4 、Fe(CO)5
2.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法正确的是A.配位体是Cl-和H2O,配位数是8B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+C.内界和外界中Cl-的数目比是1∶2D.在1 ml该配合物中加入足量AgNO3溶液,可以得到3 ml AgCl沉淀
内界Cl-不与Ag+反应
3、常见的配合物及其制取
(1)[Cu(H2O)4]2+
已知配合物的品种超过数百万种,是一个庞大的化合物家族。
(2)[Cu(NH3)4](OH)2
促进过饱和溶液结晶的两种方法:
1)加入凝结核; 2)用玻璃棒摩擦容器内壁。
沉淀溶解,得深蓝色溶液
实验3-3 制取 [Cu(NH3)4](OH)2
该晶体在乙醇中的溶解度较小
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
实验证明,无论在得到的深蓝色透明溶液中,还是在析出的深蓝色晶体中,深蓝色都是由于存在[Cu(NH3)4]2+,中心离子是Cu2+,而配体是NH3,配位数为4。
(3) K3Fe(SCN)6
Fe3+ + n SCN- [Fe(SCN)n]3-n
n = 1∽6,随SCN-的浓度而异
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2+
Fe(SCN)52- + SCN- Fe(SCN)63-
应用:检验或鉴定Fe3+,用于电影特技和魔术表演
(4)[Ag(NH3)2]Cl
沉淀消失,得澄清的无色溶液
Ag++Cl-=AgCl↓
AgCl+2NH3=[Ag(NH3)2]Cl
实验3-5 制取[Ag(NH3)2]Cl
AgCl+2NH3=[Ag(NH3)2]++Cl-
1.怎样配制银氨溶液?发生哪些反应?
向AgNO3溶液中逐滴加稀氨水,直到最初生成的沉淀恰好溶解为止。
氨水呈弱碱性,滴入AgNO3溶液中,会形成AgOH白色沉淀,
AgOH+2NH3·H2O = [Ag(NH3)2]+ + OH- + 2H2O
继续滴加氨水时,NH3分子与Ag+形成[Ag(NH3)2]+配合离子,配合离子很稳定,会使AgOH逐渐溶解。
Ag+ + NH3·H2O = AgOH↓ + NH4+
2. 配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些?
3. 分析NH3和BF3可以形成配位键吗?
有离子键、共价键、配位键。
可以形成NH3· BF3
4 (1)[Cu(NH3)4]2+与[Cu(H2O)4]2+哪个配位离子更稳定?原因是什么?提示 [Cu(NH3)4]2+更稳定。因为N和O都有孤电子对,但O电负性大,吸引孤电子对的能力强,故NH3提供孤电子对的能力比H2O大。(2)NH3与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,原因是什么?提示 电负性:F>H,使得NF3提供孤电子对的能力小于NH3。
4、配合物的形成对性质的影响
一些难溶于水的金属氢氧化物、卤化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
如:Cu(OH)2 + 4NH3 =[Cu(NH3)4]2+ + 2OH—
AgCl + 2NH3·H2O = Ag(NH3)2Cl + 2H2O
当简单离子形成配离子时,颜色会发生变化,据此可以判断是否有配离子生成。
如 Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
0.1ml/L CuCl2溶液
2ml/L CuCl2溶液
原因:Cu2+与Cl-可以形成一系列配合物,在水溶液中,作为配体的Cl-可以多至4个。在Cl-的浓度极高时,形成的CuCl42-呈黄色。
当中心原子(离子)相同时,配合物的稳定性与配体的性质有关。
配合物具有一定的稳定性,配位键越强,配合物越稳定。
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
由两种或两种以上的分子(包括离子)通过分子间相互作用形成的分子聚集体。
2.超分子内分子间的作用力
主要是氢键、静电作用、范德华力、疏水作用以及一些分子与金属离子形成的弱配位键等。
注意:超分子定义中的分子是广义的,包括离子。
分子聚集体有的是有限的,有的是无限伸展的。
注意:超分子不同于蛋白质、淀粉等大分子,也不同于高分子
4. 重要特征及其应用
a. “杯酚”分离 C60 和 C70
杯酚与C60通过范德华力相结合,通过尺寸匹配实现分子识别
b. “冠醚”识别碱金属离子
冠醚,是分子中含有多个-氧-亚甲基(CH2)-结构单元的大环多醚。
C 原子:8 O 原子:4
环上总原子数:8 + 4 = 12
C 原子:10 O 原子:5
环上总原子数:10 + 5 = 15
冠醚是皇冠状的分子,有不同大小的空穴,能与正离子,尤其是碱金属离子络合
思考:冠醚靠什么原子吸引阳离子?
C 原子是环的骨架,稳定了整个冠醚,
冠醚与金属阳离子通过配位作用相结合形成超分子
选2 P99 表3-6 冠醚识别钾离子
不同冠醚的空腔尺寸不同,与不同的阳离子相匹配,从而实现选择性结合。
1.冠醚与碱金属离子之间的配位键属于离子键、共价键、氢键还是分子间作用力?提示 共价键。2.冠醚与碱金属离子形成配合物得到的晶体里还有什么粒子,这类晶体是离子晶体、共价晶体还是分子晶体?提示 阴离子,离子晶体。
超分子自组装过程是使超分子产生高度有序的过程。
自组装:在不受外力介入下,分子自行聚集、组织成规则结构的现象。
例如,分子的结晶即是一种自组装现象。
纯水 洗涤灵 胶束
第25讲 氮及其氧化物 硝酸-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第25讲 氮及其氧化物 硝酸-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了氮族元素,内容索引,专项突破,归纳整合,迁移应用等内容,欢迎下载使用。
第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共55页。PPT课件主要包含了氧族元素,易得2e-,专项突破,归纳整合,CS2,氧化性,还原性,漂白性,迁移应用,思考与交流等内容,欢迎下载使用。
第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合,生活小知识等内容,欢迎下载使用。












