





第35讲(二) 常见晶体类型-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
展开考点二 常见晶体类型
答题规范(5) 晶体熔、沸点高低原因解释
考点二 常 见 晶 体 类 型
如:I2、H2O、NH3、H3PO4、乙醇等在固态时都是分子晶体。
只含分子的晶体叫做分子晶体。
分子间作用力(包括范德华力和氢键)
→下列晶体是否属于分子晶体?
H2S、O2、 SO2、 H2SO4、乙醇、 He、 NaCl、Cu、SiO2、C(金刚石)
①所有非金属氢化物:H2O、H2S、NH3、CH4、HX
②部分非金属单质:X2、O2、H2、S8、P4、C60
③部分非金属氧化物: CO2、SO2、NO2、P4O6、P4O10
④几乎所有的酸:H2SO4、HNO3、H3PO4、H2SiO3等
⑤绝大多数有机物:乙醇、冰醋酸、蔗糖、蛋白质、尿素等
例外:金刚石、晶体硅等
⑥稀有气体为单原子分子,固态时为分子晶体
①干冰中的CO2分子间只存在 ,不存在 。②干冰晶胞是一种面心立方结构,每个晶胞中均摊 个CO2分子③每个CO2分子周围等距离紧邻的CO2分子数为 个。
用途:干冰在常压下极易升华,在工业上广泛用作制冷剂。
3.分子晶体的结构特征
(1)干冰晶体的结构特征
④观察分析,有___种取向不同的CO2分子。
顶角一种取向,三对平行面分别为三种取向,所以共有4种取向。
1个分子周围最邻近的分子数目称为配位数
→干冰中CO2的配位数:12
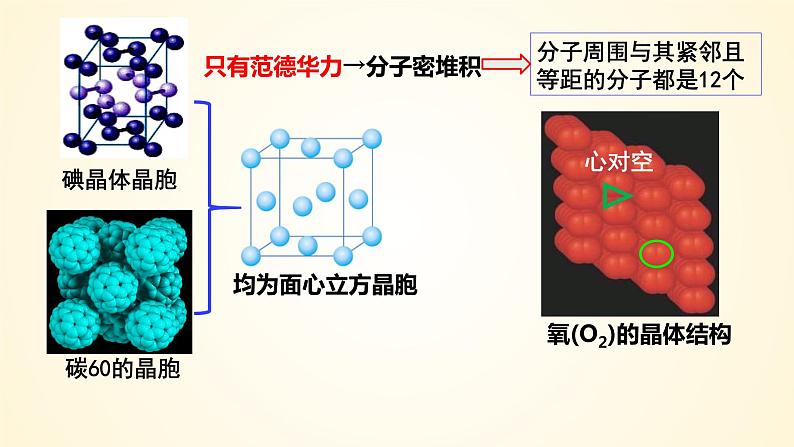
只有范德华力→分子密堆积
分子周围与其紧邻且等距的分子都是12个
(2)C60分子中σ键数目= 。其中单键数= ,双键数= 。
(1)分子共有60个顶点,32个面,其中有12个正五边形,20个正六边形;
氢键具有方向性和饱和性
(2)冰晶体的结构特征
→冰中水分子的配位数:4
①水分子之间的作用力有 ,且主要是 。②由于氢键具有 ,使四面体中心的每个水分子与 个相邻的水分子相互吸引。
→冰的硬度和干冰相似,而熔点比干冰的熔点高得多。
③水分子以氢键相连接,含1 ml H2O的冰中,最多可形成__ ml“氢键”
为什么干冰的熔沸点比冰低,而密度却比冰大?
由于干冰中的CO2之间只存在范德华力,一个分子周围有12个紧邻分子,∴密度比冰的高。
冰存在分子间氢键,CO2之间只存在范德华力,∴ 干冰的熔沸点比冰低。
→结合冰的结构解释,为何水凝结成冰后密度减小?
→氢键具有方向性,迫使在四面体中心的水分子与位于四面体顶角的四个水分子吸引,水分子间留有相当大的空隙,空间利用率低,密度减小。
→当冰刚刚融化成液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大,超过4℃时,由于热运动加剧,分子间距离加大,密度逐渐减小。所以4℃时水的密度最大。
→为什么水在4℃时的密度最大?
冰融化,分子间空隙减小
→分子非密堆积(每个分子周围紧邻的分子少于12个)
总结:分子晶体的结构特征
→分子密堆积(每个分子周围有12个紧邻的分子)
如:C60、干冰 、O2
如:HF 、NH3、冰(每个水分子周围只有4个紧邻的水分子)。
③分子晶体中存在单个分子,化学式代表真实的分子组成。
所有原子都以共价键相互结合形成三维的立体网状结构的晶体
①某些单质:硼(B)、金刚石(C)、硅(Si)、锗(Ge)和灰锡(Sn)等
②某些非金属化合物:SiO2、碳化硅(SiC)、氮化硅(Si3N4)、氮化硼(BN)等
如刚玉(ɑ-Al2O3)
3.典型的共价晶体的结构分析
图3-21 金刚石的多面体外形、晶体结构和晶胞示意图
②每个碳原子都采取____杂化;
③所有的C—C键长相等,键角相等,键角为_________.
④晶体中最小的碳环由___个碳组成, 且_____同一平面内;
①在金刚石晶体中每个碳原子周围紧邻的碳原子有 个
⑤每个碳原子被 个六元环共用。
⑦在金刚石晶胞中占有的碳原子数____
8×1/8+6×1/2+4=8
→12g金刚石含有___个C原子,含有____个C-C键
⑥晶体中每个C参与了 条C—C键的形成,而在每条键中的贡献只有 ,故C原子与C—C键数之比为: 。
→即金刚石中,1mlC平均拥有 ml C—C键
键能:347.7 kJ/ml(很大)
109º 28´,三维骨架
原子半径:Si C
俗称“金刚砂”,类似于金刚石的结构。
→金刚砂的结构中,只有C-Si键,一个硅原子周围结合___个碳原子,最小的环为六元环,环上有___个硅原子。
SiO2是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α-SiO2)。
低温石英晶体的空间结构模型
其结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构。
→这一结构决定了它具有手性,被广泛用作压电材料,如石英手表。
海滩河岸边的黄沙、石英矿脉、花岗石中的白色晶体以及透明的水晶都是低温石英。
封闭的环状结构SiO2晶体
→每个SiO2晶胞中平均含有___个Si原子和___个O原子
→每4个O原子与1个Si原子在晶胞内构成1个硅氧四面体。
②每个Si原子都采取 杂化和 个O原子形成 个Si-O键.
③没有单个SiO2分子存在,只存在硅、氧原子,Si:O比例: .
每个Si周围结合 个O;
每个O周围结合 个Si
④最小的环是由6个Si原子和6个O原子组成的12元环。
⑤1ml SiO2中含 ml Si-O键
强碱、活泼金属的氧化物和过氧化物、大多数盐
→离子晶体无单个分子存在;如NaCl不表示分子式
:阴、阳离子通过离子键结合、在空间呈现规则几何外形的晶体。
活泼碳化物(CaC2)及氮化物(Mg3N2)等
Na+:体心和棱中点Cl-:面心和顶点
3.常见离子晶体的结构
(1)每个晶胞含Na+、Cl-的个数:
晶胞中各离子的位置分布?
→每个Na+周围与之最接近且距离相等的Cl-有____个。
指一个离子周围最邻近的异电性离子的数目
→每个Cl-周围与之最接近且距离相等的Na+有____个。
→6个Na+连线形成的空间几何构型是__________。
(3) Na+周围最近的Na+数: Cl-周围最近的Cl-数:
小结NaCl的微观结构特征
(1)每个NaCl晶胞含4个Na+、4个Cl-
(2)Na+的配位数:
每个Na+周围与之最接近且距离相等的Cl-有6个,Na+有12个。每个Cl-周围与之最接近且距离相等的Na+有6个,Cl-有12个。
Cl-位于顶点Cs+位于体心
(2)每个晶胞含Cs+ 、 Cl-的个数:
“CsCl”仅表示物质组成,不表示分子式
→8个离子所围成的的空间几何构型是__________。
每个Cs+同时吸引着 个Cl−
每个Cl−同时吸引着 个Cs+
以Cs+在晶胞的顶点为例
(4)Cs+周围最近的Cs+数: Cl-周围最近的Cl-数:
→6个离子连线形成的空间几何构型是__________。
小结CsCl的微观结构特征
(1)每个CsCl晶胞含1个Cs+、1个Cl-
(2)Cs+的配位数:
(3) Cs+周围最近的Cs+数: Cl-周围最近的Cl-数:
每个Cs+周围与之最接近且距离相等的Cl-有8个,Cs+有6个。每个Cl-周围与之最接近且距离相等的Cs+有8个,Cl-有6个。
1. 粒子位置:2. 晶胞中的离子数:3. Ca2+、F-离子配位数比:
Ca2+位于顶点和面心F-位于立方体内
个Ca2+, 个F-
F- 配位数:配位多面体:
Ca2+配位数:配位多面体:
S2-周围最近的S2-数______
(3)晶胞中含有的离子数:Zn2+___; S2- ___
(4)Zn2+配位数___ ;S2-配位数__
(1)粒子位置:Zn2+_____;S2- . 或者反之。
(2)晶体堆积方式:可类比金刚石的晶胞
S2-成面心立方密堆积,内部4个Zn2+交错排列在4个小立方体的中心。
(5)若晶胞边长为a,最近阴阳离子间距为: .
(6)Zn2+周围最近的Zn2+数____
【思考】CaF2晶胞与ZnS晶胞类似,为什么CaF2晶胞Ca2+的配位数为8个,
【提示】F-与Ca2+电荷比为1:2,而ZnS中,S2-与Zn2+电荷比为1:1
而ZnS 晶胞中Zn2+配位数为4?
【注意】阴、阳离子配位数比=阴、阳离子数目反比
提示:如CuSO4•5H2O中还存在共价键、分子间作用力,有些还有氢键等,但主体是离子键。
思考:离子晶体只存在离子键作用力吗?试举例说明
→以上讨论了NaCl、CsCl、CaF2、ZnS 四种离子晶体.
→实际上,大量离子晶体的阴离子或阳离子不是单原子离子, 有的还存在电中性分子(如H2O、NH3等)。
→晶体中也存在范德华力,只是当能量份额很低时不提及。 然而,贯穿整个晶体的主要作用力仍是阴、阳离子之间的作用力。
例如: CaCO3、K2SO4、(NH4)2SO4、CuSO4·5H2O、Cu(NH3)4SO4·H2O等,在这些离子晶体中还存在共价键、氢键等。
气态离子形成1 ml离子晶体释放的能量,通常取正值,单位:kJ·ml-1。
①离子所带电荷数:离子所带电荷数越多,晶格能越大。②离子的半径:离子的半径越小,晶格能越大。
(2)意义:晶格能越大,表示离子键越强,离子晶体越稳定,熔、沸点越高。
如:以铁为主要成分的碳钢、锰钢、不锈钢等, 以铜为主要成分的黄铜、青铜、白铜等。
黄铜(铜、锌合金)、青铜(铜锡合金)、白铜(铜、镍合金)
→大多数合金是以一种金属为主要组成
注意:汞在固态时也是金属晶体
→金属单质或合金(晶体锗、灰锡除外)属于金属晶体。
(四)金属键与金属晶体
→金属晶体的结构就像很多硬球一层一层很紧密的地堆积,每一个金属原子的周围有较多的相同原子围绕着。
→由于金属原子的最外层电子数较少,容易失去电子成为金属阳离子,金属原子释放出的价电子不专门属于某个特定的金属阳离子,而为许多金属阳离子所共有,并在整个金属中自由运动,这些电子又称为自由电子。
→金属脱落下来的价电子几乎均匀分布整个晶体中,像遍布整块金属的“电子气”,被所有原子所共有,把所有金属原子维系在一起。
①自由电子不是专属于某个特定的金属阳离子, 而是在整块固态金属中自由移动。
②金属键既没有方向性,也没有饱和性。
:金属阳离子与自由电子间强烈的相互作用
→金属原子半径越小,价电子数越多,自由电子与金属阳离子间的作用力越大,金属键越强
→金属晶体的熔沸点越高
4.“电子气理论”解释金属的物理性质
①金属或合金具有导电性
解释:金属晶体内部到处移动的自由电子,在电场作用下,改作定向移动,从而形成了电流。
⑴金属晶体具有导电性,但能导电的物质不一定是金属。
→如石墨具有导电性,属于非金属。还有一大类能导电的有机高分子化合物(如聚乙炔),也不属于金属。
⑵金属导电的粒子是自由电子,导电过程是物理变化。而电解质溶液导电的粒子是自由移动的阴阳离子,导电过程是化学变化。
⑶不同的金属导电能力不同,导电性最强的三中金属是:Ag、Cu、Al。
特别提醒:温度升高,金属导电能力下降,而溶液导电能力却增强。
(2)金属或合金的导热性很好
自由电子在运动时与金属离子相互碰撞, 在碰撞过程中发生能量交换。当金属的某一端受热时,该区域获得能量的电子会向别处运动并发生碰撞,将能量从温度高的区域传递到温度低的区域,最后使整块金属的温度趋于一致。
→即电子气中的自由电子在热的作用下运动时频繁与金属离子碰撞,从而引起能量传递,呈现良好的导热性。
(3)金属或合金的延展性很好
当金属受到外力作用时,弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用,晶体中的各原子层就会发生相对滑动,原来的排列方式不变,电子气也没有被破坏,所以金属有良好的延展性;
(4)金属大都有特殊的金属光泽
金属晶体内部存在自由电子,当光线投射到金属表面时,自由电子吸收可见光,然后又把各种波长的光大部分再反射出来,这就使绝大多数金属呈现银灰色或银白色光泽。
→金属在粉末状态时,金属原子的取向杂乱,排列不规则,吸收可见光后反射不出去,所以金属粉末常呈暗灰色或黑色
思考:金属粉末常呈暗灰色或黑色,为什么呢?
→某些金属(如铜、金、铯、铅等)由于较易吸收某些频率的光而呈现较为特殊的颜色。
原子半径越小,价电子数越多,金属键越强,反之,金属键越弱
金属键越强,金属的熔沸点越高,硬度越大
①.定义:金属原子之间通过金属键相互结合形成的晶体。
②.组成粒子:金属阳离子和自由电子。
③.微粒间的作用力:金属键
⑤.在金属晶体中,不存在单个分子或原子,
→金属晶体与共价晶体一样是一种“巨分子”
④.金属单质或合金(晶体锗、灰锡除外)均属于金属晶体。
金属材料形成合金以后性能会发生改变?
提示:当向金属晶体中掺入不同的金属或非金属原子(形成合金)时,就像在滚珠之间掺入了细小而坚硬的沙土或碎石一样,会使这种金属的延展性(变差)、熔点(变低)、硬度(增大)等发生改变。
拓展:金属晶体的堆积方式
由于金属键没有饱和性和方向性,因此金属原子尽可能采取最紧密的堆积方式,使得金属晶体结构最稳定,能量最低。
典型代表P,配位数为6,空间利用率52%
典型代表Cu、Ag、Au,配位数为12,空间利用率74%
典型代表Na、K、Fe,配位数为8,空间利用率68%
典型代表Mg、Zn、Ti,配位数为12,空间利用率74%
→典型的晶体有分子晶体、离子晶体、共价晶体和金属晶体。事实上,纯粹的晶体类型是不多的,大多数晶体是它们之间的过渡晶体。
Na2O离子键成分较多,当成离子晶体; Al2O3、SiO2共价键成分较多,当成共价晶体。
(五)过渡晶体与混合型晶体
离子键、共价键、金属键等都是化学键的典型模型,但是,原子间形成的化学键往往是介于典型模型之间的过渡状态,由于微粒间的作用存在键型过渡,即使组成简单的的晶体,也可能介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,形成过渡晶体。
1.四种典型晶体类型都存在过渡晶体
2.晶体性质偏向某一晶体类型的过渡晶体通常当作该晶体类型处理
未参与杂化的p轨道上电子可在层内运动
→既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
构成σ键的sp2杂化轨道
③1ml石墨(C)中含有____mlC-C键 。
个C-C键。
每个环中,平均含有 个C原子,
①石墨中C原子以sp2杂化;层内C-C之间夹角为____。
②石墨晶体中最小环为 元环,
④层平面内,C原子的配位数为3,共价键的键长很短,键能很大,石墨的熔点很高。
石墨晶体中,层内C—C的键长为142 pm,而金刚石中C—C的键长为154 pm,回答下列问题。(1)熔点:石墨____(填“>”“<”或“=”)金刚石。(2)石墨中C—C的键长小于金刚石中C—C键长的原因:__________________________________________________________________________________________________________________。
C—C间的σ键,而石墨中层内的C—C间不仅存在σ键,还存在π键,电子层重叠程度大,所以C—C间的键长短
②层内的碳原子核间距为142pm,层间距离为335pm,说明层间没有化学键相连,是靠范德华力维系的
分析石墨晶体的构成微粒及微粒间相互作用,解释石墨具有润滑性和导电性的原因。
→各层之间以范德华力结合,容易滑动,所以石墨质软,具有润滑性。
(1)石墨具有润滑性的原因:
(2)石墨具有导电性的原因:
石墨结构中未参与杂化的p轨道
→未参与杂化的2p电子相互平行重叠,形成离域π键,这些p轨道中的电子可在整个层平面中运动。因此石墨能导电(类似金属晶体的导电性)。
→石墨的导电性只能沿石墨平面方向
→由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面。
离域大π键:多个平行的p轨道肩并肩重叠而成的键,简称大π键
四种常见晶体类型的比较
一般不溶于水,少数与水反应
大多易溶于水等极性溶剂
一般不导电,溶于水后有的导电
一般不具有导电性,个别为半导体
晶体不导电,水溶液或熔融态导电
【规律方法】判断晶体类型的方法
④金属单质或合金在固态时大多为金属晶体。
③有很高的熔、沸点,硬度大,并且难溶于水的物质大多为共价晶体, 如晶体硅、二氧化硅、金刚石等。
②在熔融状态下能导电的晶体(化合物)是离子晶体。 如:NaCl熔融后电离出Na+和Cl-,能自由移动,所以能导电。
①在常温下呈气态或液态或易升华的物质, 其晶体应属于分子晶体(Hg除外)。如H2O、H2、稀有气体等。
一般是根据物质的物理性质:
晶体熔、沸点高低原因解释
(2)SiO2的熔点比CO2高,原因是 。
:×××为×××晶体,而×××为×××晶体。
例1 (1)金刚石的熔点比NaCl高,原因是 。
金刚石是共价晶体,而NaCl是离子晶体
SiO2是共价晶体,而CO2是分子晶体
1.不同类型晶体熔、沸点比较
①同为分子晶体,×××存在氢键,而×××仅存在较弱的范德华力。
2.同类型晶体熔、沸点比较
④同为分子晶体,×××形成分子间氢键,而×××形成的则是分子内氢键,分子间氢键会使熔、沸点升高。
③同为分子晶体,两者的相对分子质量相同(或相近),×××的极性大,熔、沸点高。
②同为分子晶体,×××的相对分子质量大,范德华力强,熔、沸点高。
例2 (1)NH3的沸点比PH3高,原因是___________________________。
同为分子晶体,NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力
同为分子晶体,CS2的相对分子质量大,范德华力强,熔、沸点高
同为分子晶体,两者相对分子质量相同,CO的极性大,熔、沸点高
(3)CO比N2的熔、沸点高,原因是 。
(2)CO2比CS2的熔、沸点低,原因是 。
同为共价晶体,×××晶体的键长短,键能大,熔、沸点高。
晶体硅与SiC均属于共价晶体,晶体硅中的Si-Si比SiC中Si-C的键长长,键能低,所以熔点低
例3 Si单质比化合物SiC的熔点低,理由是_______________________。
①阴、阳离子电荷数相等,则看阴、阳离子半径:同为离子晶体,Rn-(或Mn+)半径小于Xn-(或Nn+),故×××晶体离子键强,熔、沸点高。
②阴离子(或阳离子)电荷数不相等,阴离子(或阳离子)半径不相同:同为离子晶体,Rn-(或Mn+)半径小于Xm-(或Nm+),Rn-(或Mn+)电荷数大于Xm-(或Nm+),故×××晶体离子键强,熔、沸点高。
例4 (1)ZnO和ZnS的晶体结构相似,熔点较高的是ZnO,理由是 。
ZnO和ZnS同属于离子晶体,O2-半径小于S2-,故ZnO离子键强,熔点高
同为离子晶体,Fe2+半径比Fe3+大,所带电荷数也小于Fe3+,FeO的离子键比Fe2O3小
(2)FeO的熔点小于Fe2O3的熔点,原因是_____________________。
1. FeF3具有较高的熔点(高于1 000 ℃),其化学键类型是________,FeBr3的相对分子质量大于FeF3,但其熔点只有200 ℃,原因是_________________________________________________________。
FeF3为离子晶体,FeBr3的化学键以共价键为主,属于分子晶体
2.已知:K2O的熔点为770 ℃,Na2O的熔点为1 275 ℃,二者的晶体类型均为_________,K2O的熔点低于Na2O的原因是___________________。
K+的半径大于Na+,K2O的离子键键能小于Na2O
3.已知氨(NH3,熔点:-77.8 ℃、沸点:-33.5 ℃),联氨(N2H4,熔点:2 ℃、沸点:113.5 ℃),解释其熔、沸点高低的主要原因:___________。
联氨分子间形成氢键的数目多于氨分子形成的氢键
4.已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是_____(填化学式),其理由是_____________________________________。
两种晶体均为共价晶体,N和B原子半径较小,键能较大,熔点较高
第41讲 常考新型化学电源-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第41讲 常考新型化学电源-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共41页。PPT课件主要包含了复习目标,内容索引,专项突破,归纳整合,“浓差电池”等内容,欢迎下载使用。
第39讲 反应热的测定与计算-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第39讲 反应热的测定与计算-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共43页。PPT课件主要包含了复习目标,内容索引,专项突破,归纳整合,一中和热,放热反应,mol纯物质,友情提示,反应热大小的比较等内容,欢迎下载使用。
第29讲 常见气体的实验室制备、净化和收集-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第29讲 常见气体的实验室制备、净化和收集-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共35页。PPT课件主要包含了复习目标,热点强化12,化学装置图的正误判断等内容,欢迎下载使用。












