






新高考化学一轮复习课件第6章 第34讲 分子的性质 配合物与超分子(含解析)
展开1.理解分子的极性。2.掌握范德华力的含义及对物质性质的影响。 3.理解氢键的含义, 能列举存在氢键的物质, 并能解释氢键对物质性质的影响。4.理解配位键的含义。5.了解超分子的概念。
考点一 键的极性与分子极性
考点二 分子间作用力
考点三 配合物、超分子
真题演练 明确考向
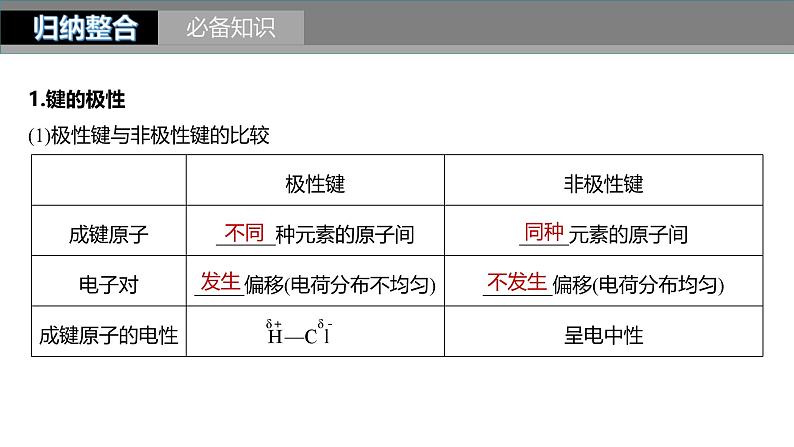
1.键的极性(1)极性键与非极性键的比较
思考 如何判断共价键极性的强弱?
提示 成键元素电负性值差异越大,共价键的极性越强。
(2)键的极性对化学性质的影响键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的 而实现的,羧基中羟基的极性越大,越 ,则羧酸的酸性越强。①与羧基相邻的共价键的极性越大,羧基中 ,则羧酸的酸性越强。②烷基是推电子基团,从而减小羟基的 ,导致羧酸的酸性减小。一般地,烷基越长,推电子效应 ,羧酸的酸性 。
2.极性分子和非极性分子(1)概念极性分子:分子的正电中心和负电中心 ,键的极性的向量和 零。非极性分子:分子的正电中心和负电中心 ,键的极性的向量和 零。(2)极性分子和非极性分子的判断方法①A—A型分子一定是非极性分子、A—B型分子一定是极性分子。②判断ABn型分子极性的两条经验规律a.中心原子A化合价的绝对值等于该元素原子最外层电子数,则为非极性分子,反之则为极性分子。b.中心原子A没有孤电子对,则为非极性分子,反之则为极性分子。
一、有关羧酸酸性强弱的判断及归因分析1.试比较下列有机酸的酸性强弱。①CF3COOH ②CCl3COOH ③CHCl2COOH ④CH2ClCOOH ⑤CH3COOH⑥CH3CH2COOH
答案 ①>②>③>④>⑤>⑥
2.酸性:氟乙酸大于氯乙酸的原因是_________________________________________________________________________________________________________________________________。3.酸性:甲酸大于乙酸的原因是_______________________________________________________________________________________。
电负性:F>Cl,C—F的极性大于C—Cl的极
性,导致氟乙酸羧基中的羟基的极性更大,更易电离出H+,故氟乙酸的酸性大于氯乙酸的酸性
烷基(R—)是推电子基团,烷基越长推电子效应越大,
使羧基中的羟基的极性越小,羧酸的酸性越弱
二、分子极性的判断4.下列分子P4、C60、 Cl2、NO、H2O2、NO2、SO2、CH2Cl2、CS2、C2H2、SO3、 BF3、HCN 、HCHO、PCl5、PCl3属于极性分子的是____________________________________________________;属于非极性分子的是______________________________________________。
P4、C60、Cl2、CS2、C2H2、SO3、
NO、H2O2、NO2、SO2、CH2Cl2、
HCN、HCHO、PCl3
1.分子间作用力(1)范德华力、氢键的对比
(2)氢键的表示方法(以HF分子间氢键为例)
已知邻羟基苯甲醛( )与对羟基苯甲醛( )的沸点相差很大,其中沸点较高的是________________,请画出上述两种物质形成氢键的情况:_______________________________________________________________________________________________________。
邻羟基苯甲醛形成分子内氢键: ;对羟基苯甲醛形成分子间氢键:
2.分子的溶解性(1)“相似相溶”规律①非极性溶质一般能溶于 溶剂,极性溶质一般能溶于 溶剂。②分子结构相似的物质易互溶。(2)氢键对分子溶解性的影响若溶剂和溶质分子之间可以形成氢键,则溶质的溶解度 。
3.分子的手性(1)手性异构:具有完全相同的组成和原子排列的一对分子,如同左手和右手一样互为 ,在三维空间里 的现象。(2)手性分子:具有 的分子。(3)手性碳原子:在有机物分子中,连有 的碳原子。含有手性碳原子的分子是手性分子,如 。
1.氢键是一种特殊的化学键( )2.卤素单质、卤素氢化物、卤素碳化物(即CX4)的熔、沸点均随着相对分子质量的增大而增大( )3.氨水中氨分子与水分子间形成了氢键( )4.可燃冰(CH4·8H2O)中甲烷分子与水分子之间形成了氢键( )5.H2O比H2S稳定是因为水分子间存在氢键( )6.氢键的存在一定能使物质的熔、沸点升高( )
一、范德华力、氢键的存在1.液氨、液氯、清洗剂、萃取剂等重点品种使用企业和白酒企业,应加强储罐区、危化品库房、危化品输送等的管理,确保化工生产安全。下列说法正确的是A.液氨中只存在范德华力B.液氨分子间作用力强,所以其稳定性大于PH3C.液氯挥发导致人体吸入后中毒,是因为液氯分子中的共价键键能较小D.萃取剂CCl4的沸点高于CH4的沸点
液氨中还存在共价键、氢键等作用力,A项错误;分子间作用力只影响物质的物理性质,与其稳定性无关,B项错误;由于液氯中Cl2分子间的作用力弱,液氯沸点低,极易挥发而被人体吸入引起中毒,与共价键键能大小无关,C项错误;由于CCl4与CH4结构相似,且均为共价化合物,CCl4的相对分子质量大于CH4,其沸点也高于CH4的沸点,D项正确。
A.由于氢键的存在,水分子的稳定性好,高温下也很难分解B.第一层固态冰中,水分子间通过氢键形成空间网状结构C.第二层“准液体”中,水分子间形成氢键的机会比固态冰中少D.当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流 动性的水分子”,使冰面变滑
2.“冰面为什么滑?”,这与冰层表面的结构有关(如图)。下列有关说法错误的是
水分子的稳定性好,是由水分子内氢氧共价键的键能决定的,与分子间形成的氢键无关,A错误;固态冰中,1个水分子与周围的4个水分子通过氢键相连接,从而形成空间网状结构,B正确;“准液体”中,水分子间的距离不完全相等,所以1个水分子与少于4个的水分子间形成氢键,形成氢键的机会比固态冰中少,C正确;当温度达到一定数值时,“准液体”中的水分子与下层冰连接的氢键被破坏,使一部分水分子能够自由流动,从而产生“流动性的水分子”,造成冰面变滑,D正确。
3.画出氢氟酸溶液中可能存在的氢键形式:_____________________________________。
F—H…F,O—H…O,F—H…O,O—H…F
二、分子间作用力与分子性质原因分析4.有关分子的溶解性,解答下列各题:(1)H2O2难溶于CS2,简要说明理由________________________________________________________________________。(2)ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是_____________________________________________________________________。(3)NH3、CH3CH2OH、CH3CHO都极易溶于水的原因是_____________________________________________________________。
H2O2为极性分子,而CS2为非极性溶剂,根据“相似
相溶”规律,H2O2难溶于CS2
ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小
NH3、CH3CH2OH、CH3CHO
都是极性分子,且都能与H2O形成氢键
5.有关物质的熔、沸点,解答下列问题。
(1)有机物A( )的结构可以表示为 (虚线表示氢键),而有机物B( )只能形成分子间氢键。工业上用水蒸气蒸馏法将A和B进行分离,首先被蒸出的成分是___,原因是:_________________________________________________________。
A易形成分子内氢键,B易形成分子间氢键,所以B的沸点比A的高
(2)苯胺( )与甲苯( )的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(111 ℃),原因是____________________。
(3)如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_____________________________________。(4)在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)所涉及的4种物质中,沸点从高到低的顺序为_______________________,原因是__________________________________________________________________________________________________________。
S8相对分子质量大,分子间范德华力大
H2O>CH3OH>CO2>H2
H2O与CH3OH均为极性分子,
H2O中氢键比甲醇多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力
1.配位键(1)形成:由一个原子单方面提供 而另一个原子接受孤电子对形成的共价键,即“电子对给予—接受”键被称为 。
2.配位化合物(1)概念:金属离子或原子(称为中心离子或原子)与某些 (称为配体或配位体)以 结合形成的化合物。(2)形成条件中心离子或原子:有空轨道,一般是带正电的金属离子,特别是过渡金属离子,如Fe3+、Cu2+、Zn2+、Ag+等,但也有电中性的原子等。配位体:其中的配位原子(配位体中直接同中心离子或原子配合的原子)有孤电子对。配位体可以是分子,如CO、NH3、H2O等,也可以是离子,如F-、Cl-、Br-、I-、CN-、SCN-、OH-等。
(3)组成:如[Cu(NH3)4]SO4
Cu2++2NH3·H2O
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
AgCl+2NH3===[Ag(NH3)2]++Cl-
4.超分子(1)概念超分子是由 的分子通过 形成的分子聚集体。(2)超分子内分子间的作用力多数人认为,超分子内部分子之间通过非共价键相结合,包括氢键、静电作用、疏水作用以及一些分子与金属离子形成的弱配位键等。(3)超分子的两个重要特征是分子识别和自组装。(4)超分子的应用在分子水平上进行分子设计,有序组装甚至复制出一些新型的分子材料。
1.配位键实质上是一种特殊的共价键( )2.提供孤电子对的微粒既可以是分子,也可以是离子( )3.有配位键的化合物就是配位化合物( )4.配位化合物都很稳定( )5.在配合物[C(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀( )6.Ni(CO)4是配合物,它是由中心原子与配体构成的( )
一、配合物1.关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物,下列说法正确的是A.配位体是Cl-和H2O,配位数是8B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+C.内界和外界中Cl-的数目比是1∶2D.在1 ml该配合物中加入足量AgNO3溶液,可以得到3 ml AgCl沉淀
配合物[TiCl(H2O)5]Cl2·H2O中配位体是Cl-和H2O,配位数是6,故A错误;中心离子是Ti3+,故B错误;加入足量AgNO3溶液,外界Cl-与Ag+反应,内界Cl-不与Ag+反应,1 ml该配合物只能生成2 ml AgCl沉淀,故D错误。
2.(2022·济南调研)向盛有硫酸铜溶液的试管中滴加氨水,先生成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色透明溶液。下列对此现象的说法正确的是A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变B.沉淀溶解后,生成深蓝色的配离子[Cu(NH3)4]2+C.配位化合物中只有配位键D.在配离子[Cu(NH3)4]2+中,Cu2+给出孤电子对,NH3提供空轨道
NH3与Cu2+形成配位键,Cu2+提供空轨道,NH3提供孤电子对。
3.(2023·烟台质检)过渡金属配合物的一些特有性质的研究正受到许多研究人员的关注,因为这方面的研究无论是理论上还是工业应用上都有重要意义。氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。下列有关该配离子的说法正确的是A.1 ml该配离子中含有π键的个数是6×6.02×1023B.该配离子中碳原子的杂化类型均为sp2杂化C.该配离子含有的非金属元素中电负性最大的是碳D.该配离子中含有的化学键有离子键、共价键、配位键
根据配离子结构示意图可知,1 ml该配离子中含有π键的个数是6NA,即6×6.02×1023,故A正确;该配离子中碳原子的杂化类型有sp2、sp3杂化,故B错误;该配离子含有的非金属元素有C、O、H,电负性最大的是氧,故C错误;该配离子中含有的化学键有共价键、配位键,故D错误。
4.回答下列问题:(1)将白色CuSO4粉末溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配离子,请写出生成此配离子的离子方程式:___________________________,蓝色溶液中的阳离子内存在的全部化学键类型有________________。1 ml该阳离子中含σ键个数为________。
Cu2++4H2O===[Cu(H2O)4]2+
Cu2+提供空轨道,H2O分子中的O原子提供孤电子对形成配离子[Cu(H2O)4]2+。
(2)CuSO4·5H2O(胆矾)中含有水合铜离子而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来):______________________。
(3)向CuSO4溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以析出深蓝色的[Cu(NH3)4]SO4·H2O晶体。下列说法不正确的是______(填字母)。a.[Cu(NH3)4]SO4的组成元素中电负性最大的是N元素b.CuSO4晶体及[Cu(NH3)4]SO4·H2O中S原子的杂化方式均为sp3c.[Cu(NH3)4]SO4所含有的化学键有离子键、共价键和配位键d.NH3分子内的H—N—H键角大于H2O分子内的H—O—H 键角e. 的空间结构为正四面体形f.[Cu(NH3)4]2+中,N原子是配位原子g.NH3分子中氮原子的杂化轨道类型为sp2
电负性:O>N,a不正确;S原子与4个O原子形成共价键,所以S原子采取sp3杂化,b正确;
NH3分子内N原子有1个孤电子对,H2O分子中O原子有2个孤电子对,H2O分子中孤电子对对共用电子对排斥作用大,所以H2O分子中H—O—H键角小于NH3分子中H—N—H键角,d正确;
二、超分子5.下列关于超分子的说法中,不正确的是A.超分子是由两种或两种以上的分子必须通过氢键相互作用形成的分子聚集体B.将C60加入一种空腔大小适配C60的“杯酚”中会形成超分子C.碱金属离子虽然不是分子,但冠醚在识别碱金属离子时,形成的也是超分子D.超分子的重要特征是自组装和分子识别
超分子是由两种或两种以上的分子通过分子间作用力形成的分子聚集体,不一定是氢键,A错误;将C60加入一种空腔大小适配C60的“杯酚”中,两分子间的作用力为分子间作用力,能形成超分子,B正确;冠醚是皇冠状的分子,有不同大小的空穴,会与合适的碱金属离子形成超分子,C正确;超分子的两大特征为分子识别和自组装,D正确。
6.冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关。二苯并-18-冠-6与K+形成的配离子的结构如图所示。下列说法错误的是
A.冠醚可以用来识别碱金属离子B.二苯并-18-冠-6也能适配Li+C.该冠醚分子中碳原子杂化方式有2种D.一个配离子中配位键的数目为6
由表知,碱金属离子在冠醚空腔直径范围内,冠醚与碱金属离子的包含物都是超分子,可以识别碱金属离子,A正确;Li+半径小于Na+;则二苯并-18-冠-6不能适配Li+,B错误;该冠醚分子中苯环碳原子为sp2杂化、其他碳链上的碳原子为sp3杂化,C正确;由结构简式可知,一个配离子中配位键的数目为6,D正确。
7.利用超分子可分离C60和C70。将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法错误的是A.第二电离能:C
1.(1)[2021·全国甲卷,35(3)]甲醇的沸点(64.7 ℃)介于水(100 ℃)和甲硫醇(CH3SH,7.6 ℃)之间,其原因是________________________________________________________________________________________。
甲硫醇不能形成分子间氢键,而水和甲醇均能形成氢键,且物质的量相等时水比甲醇的氢键多
(2)[2021·湖南,18(2)①]硅和卤素单质反应可以得到SiX4。
0 ℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是______(填化学式),沸点依次升高的原因是____________________________________________________________________,气态SiX4分子的空间结构是____________。
SiX4都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大
由题给熔、沸点数据可知,0 ℃时,四氟化硅为气态,四氯化硅为液态,四溴化硅、四碘化硅为固态;SiX4分子中硅原子的价层电子对数为4,孤电子对数为0,则分子的空间结构为正四面体形。
2.(1)[2022·全国甲卷,35(3)]固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构____________________。(2)[2017·全国卷Ⅱ,35(3)③]图中虚线代表氢键,其表示式为( )N—H…Cl、________________、__________________。
(H3O+)O—H…N
3.(1)[2021·全国乙卷,35(2)]三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+ 中提供电子对形成配位键的原子是____________,中心离子的配位数为____。
[Cr(NH3)3(H2O)2Cl]2+中三价铬离子提供空轨道,N、O、Cl提供孤电子对,中心离子的配位数为N、O、Cl三种原子的个数之和,即3+2+1=6。
(3)[2020·山东,17(3)]含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 ml该配合物中通过螯合作用形成的配位键有____ ml,该螯合物中N的杂化方式有____种。
(2)[2020·全国卷Ⅲ,35(2)节选]NH3BH3分子中,N—B化学键称为______键,其电子对由_____提供。
由题给图示可知,1个Cd2+与C、N杂环上的4个N原子分别形成4个配位键,与2个O原子分别形成2个配位键,因此1 ml该配合物中通过螯合作用形成的配位键有6 ml。
(4)[2019·全国卷Ⅰ,35(2)节选]乙二胺(H2NCH2CH2NH2)是一种有机化合物。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________________________________________________,其中与乙二胺形成的化合物稳定性相对较高的是_____(填“Mg2+”或“Cu2+”)。
电子对与金属离子形成配位键
乙二胺中2个氮原子提供孤电子对与金属镁离子或铜离子形成稳定的配位键,故能形成稳定环状离子。由于铜离子半径大于镁离子,形成配位键时头碰头重叠程度较大,其与乙二胺形成的化合物较稳定。
1.下列说法错误的是 A.卤化氢中,HF的沸点最高,是由于HF分子间存在氢键B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低C.H2O的沸点比HF的沸点高,是由于水中氢键键能大D.氨气极易溶于水与氨气分子和水分子间形成氢键有关
HF分子之间存在氢键,故熔、沸点相对较高,A正确;能形成分子间氢键的物质熔、沸点较高,邻羟基苯甲醛容易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,所以邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,B正确;H2O分子最多与周围H2O分子形成4个氢键,而HF分子最多与周围HF分子形成两个氢键,氢键越多,熔、沸点越高,所以H2O的熔、沸点高,C错误;氨气分子和水分子间形成氢键,导致氨气极易溶于水,D正确。
2.偶极矩是电荷量与正、负电荷中心间的距离的乘积。用偶极矩可判断分子的极性:一般来说极性分子的偶极矩不为零;非极性分子的偶极矩为零。下列分子中偶极矩不为零的是A.BeCl2 B.BF3 C.PCl3 D.CH4
在题给四种分子中,只有PCl3 (结构与NH3相似)是极性分子。
3.下列化合物中含有2个手性碳原子的是
中,只有次甲基上的碳原子为手性碳原子,A不符合题意; 中,除醛基外的碳原子都为手性碳原子,B符合题意; 中,除羧基外的碳原子都为手性碳原子,C不符合题意; 中,与苯环相连的碳原子为手性碳原子,D不符合题意。
5.(2020·海南,7)向CuSO4溶液中滴加氨水至过量,下列叙述正确的是A.先出现沉淀,后沉淀溶解变为无色溶液B.离子方程式为Cu2++4NH3·H2O===[Cu(NH3)4]2++4H2OC.Cu2+与NH3中的氮原子以π键结合D.NH3分子中∠HNH为109°28′
向CuSO4溶液中滴加氨水至过量,先生成氢氧化铜蓝色沉淀,后溶解形成深蓝色铜氨溶液,故A错误;Cu2+提供空轨道,NH3中的氮原子提供孤电子对,形成配位键,故C错误;NH3分子为三角锥形,键角∠HNH为107°,故D错误。
6.检验Ni2+反应的一种生成物为丁二酮肟镍,是一种鲜红色沉淀,其分子结构如图所示。下列说法正确的是A.Ni2+核外有14种运动状态不同的电子B.该分子内微粒之间存在的作用力有共价键、配位键、 离子键、氢键C.基态N原子的价层电子轨道表示式为D.H2O中有2个由s轨道与sp3杂化轨道形成的σ键
Ni2+价层电子排布式为3d8,能级、轨道中的电子运动状态不同,核外有26种运动状态不同的电子,A说法错误;该分子不是离子化合物,不含离子键,B说法错误;
基态N原子的价层电子排布式为2s22p3,轨道表示式为 ,C说法错误;
H2O中心氧原子s能级与p能级3个轨道杂化,含有2个σ键,2个孤电子对,D说法正确。
7.铜是重要过渡元素,能形成多种配合物,如Cu2+与乙二胺(H2N—CH2—CH2—NH2)可形成如图所示配离子。下列说法不正确的是A.1 ml 乙二胺分子中含有11NA个σ键B.乙二胺分子中氮原子轨道的杂化类型为 sp3C.Cu2+与乙二胺形成的配离子内部含有极性键、非极性键、配位键和离子键D.乙二胺和三甲胺[分子式为 N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多, 原因为乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键
乙二胺的结构式为 ,所以1 ml 乙二胺分子中含有11NA个σ键,A正确;
乙二胺分子中氮原子有3个σ键,还有一个孤电子对,轨道的杂化类型为sp3,B正确;Cu2+与乙二胺形成的配离子内部含有H—N等极性键、C—C非极性键、配位键,但不含有离子键,C错误。
8.[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是A.Zn2+基态核外电子排布式为[Ar]3d10B.1 ml HCHO分子中含有σ键的数目为1.806×1024C.HOCH2CN分子中碳原子轨道的杂化类型是sp3D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为
Zn原子序数为30,位于第ⅡB族,所以,Zn2+基态核外电子排布式为[Ar]3d10,A正确;1个HCHO分子含2个C—H和1个C==O,共有3个σ键,所以1 ml HCHO分子中含有σ键的数目为1.806×1024,B正确;HOCH2CN分子中与羟基相连的C为sp3杂化,—CN(—C≡N)中的C为sp杂化,C错误。
9.B2O3的气态分子结构如图1所示,硼酸(H3BO3)晶体结构为层状,其二维平面结构如图2所示。下列说法错误的是A.两分子中B原子分别采用sp杂化、sp2杂化B.硼酸晶体中层与层之间存在范德华力C.1 ml H3BO3晶体中含有6 ml氢键D.硼原子可提供空轨道,硼酸电离的方程式为 H3BO3+H2O [B(OH)4]-+H+
由题中信息可知,硼酸晶体为层状结构,类比石墨的晶体结构可知其层与层之间存在范德华力,故B正确;由图中信息可知,每个硼酸分子有3个羟基,其O原子和H原子均可与邻近的硼酸分子形成氢键,平均每个硼酸分子形成了3个氢键,因此,1 ml H3BO3晶体中含有3 ml氢键,故C错误;
B原子最外层有3个电子,在图1分子中每个B原子只形成了2个σ键,且没有孤电子对,故采用sp杂化,在图2分子中每个B原子形成了3个σ键,且没有孤电子对,故采用sp2杂化,A正确;
10.(1)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间结构都是三角锥形,但NF3不易与Cu2+形成配离子的原因是___________________________________________________________________________________________________________________________。(2)CO为配合物中常见的配体。CO作配体时,提供孤电子对的通常是C原子而不是O原子,其原因是_____________________________________________________________。
N—F成键电子偏向F,导致NF3中的N原子核对孤电子对的吸引力增强,难以形成配位键,故NF3不易与Cu2+形成配离子
C的电负性比O小,C原子提供孤电子对的倾向更大,更易形成配位键
CO中C、O原子各有一个孤电子对,但电负性:C<O,故O吸引孤电子对的能力更强,提供孤电子对形成配位键的能力减小。
(3)下图为DNA结构局部图。DNA双螺旋是通过氢键使它们的碱基(A和T、C和G)相互配对形成的,请写出图中存在的两种氢键的表示式:____________、__________。
11.第四周期的铬、铁、镍、铜等金属及其化合物在工业上有重要用途。(1)基态铬原子的价层电子排布式为_________。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为:K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑①上述反应式中非金属元素电负性由大到小的顺序是 __________(用元素符号表示)。②COCl2分子中所有原子均满足8电子稳定结构,则COCl2分子中σ键和π键的个数比为_________。
(3)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O] ,其结构如图所示。下列说法不正确的是_____ (填字母)。A.该复合物中只含有离子键和配位键B.该复合物中Cl原子的杂化类型为sp3C.该复合物中只有CO和H2O作为配体D.CO与N2的价层电子总数相同,其结构为C≡O
阴、阳离子之间存在离子键,非金属元素之间存在共价键,含有空轨道和含有孤电子对的原子之间存在配位键,水分子之间存在氢键,该配合物中含有离子键、配位键、共价键和氢键,故A错误;该复合物中Cl原子含1对共用电子对和3个孤电子对,所以其价层电子对数是4,根据价层电子对互斥模型判断Cl的杂化类型为sp3,故B正确;该复合物中Cl、CO和H2O为配体,故C错误;CO与N2的价层电子总数相同,为等电子体,等电子体结构和性质相似,所以其结构式为C≡O,故D正确。
12.(1)配位化学创始人维尔纳发现,取CCl3·6NH3(黄色)、CCl3·5NH3(紫红色)、CCl3·4NH3(绿色)和CCl3·4NH3(紫色)四种化合物各1 ml,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3 ml、2 ml、1 ml和1 ml。①请根据实验事实用配合物的形式写出它们的化学式。CCl3·6NH3________________,CCl3·4NH3(绿色和紫色)________________。
[C(NH3)6]Cl3
[C(NH3)4Cl2]Cl
每个CCl3·6NH3分子中有3个Cl-为外界离子,配体为6个NH3,化学式为[C(NH3)6]Cl3;每个CCl3·4NH3(绿色和紫色)分子中有1个Cl-为外界离子,配体为4个NH3和2个Cl-,化学式均为[C(NH3)4Cl2]Cl。
②上述配合物中,中心离子的配位数都是____。
这几种配合物的化学式分别是[C(NH3)6]Cl3、[C(NH3)5Cl]Cl2、[C(NH3)4Cl2]Cl,其配位数都是6。
大单元三 第八章 第35讲 分子的性质 配合物与超分子-2025年高考化学大一轮复习(人教版)【配套PPT课件】: 这是一份大单元三 第八章 第35讲 分子的性质 配合物与超分子-2025年高考化学大一轮复习(人教版)【配套PPT课件】,共60页。PPT课件主要包含了键的极性与分子极性,分子间作用力,超分子,练真题明考向,课时精练等内容,欢迎下载使用。
2025届高考化学一轮总复习第6章物质结构与性质元素周期律第31讲分子的性质配合物与超分子课件: 这是一份2025届高考化学一轮总复习第6章物质结构与性质元素周期律第31讲分子的性质配合物与超分子课件,共53页。PPT课件主要包含了不发生,容易电离出H+,羟基的极性越大,不重合,不等于,范德华力,非极性,手性异构体,不同原子或原子团,孤电子对等内容,欢迎下载使用。
第34讲(二) 配合物与超分子-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第34讲(二) 配合物与超分子-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共46页。PPT课件主要包含了2配合物与超分子,专项突破,归纳整合等内容,欢迎下载使用。












