






第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
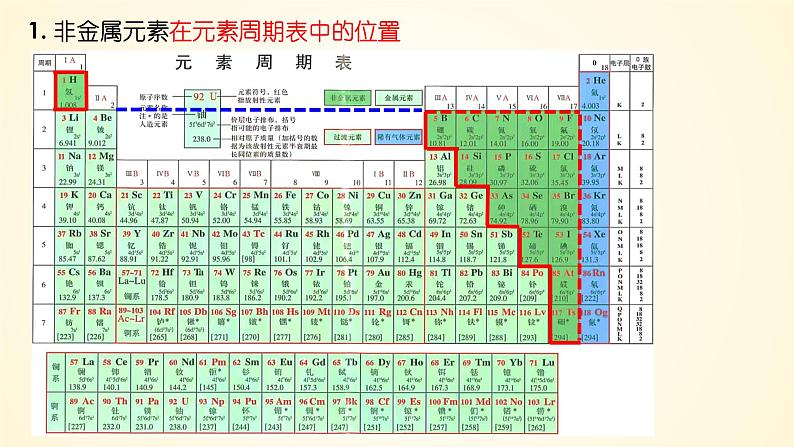
展开1. 非金属元素在元素周期表中的位置
ⅦAFClBrIAtTs
①非金属元素共有 种,在周期表中处于 区域 (H除外)。
②非金属元素的结构特点:
除H、B外,最外层电子数≥4;且原子半径比同周期的金属元素小。
双原子分子——H2、N2、O2、Cl2、 Br2 、I2 多原子分子——白磷P4、 硫:S2、 S4、 S6、 S8等
C:Si:O:S:P:
金刚石、石墨、C60等
1)单质分子晶体类型:
金刚石、晶体硅、晶体硼
2.非金属单质的特点及性质
3)非金属单质的物理性质
气态: H2、N2、O2、F2、Cl2(稀有气体除外)
2F2+2H2O =4HF+O2
Cl2+H2O HCl+HCIO
其他非金属单质均难溶于水,难与水反应。
4)非金属单质的化学性质
很多非金属单质既有氧化性又有还原性,但会以某一方面为主
如:O2、O3、S、X2(卤素)以氧化性为主
H2、C、P以还原性为主
第五章 非金属及其化合物
第19讲 氯 及 其 化 合 物
1.掌握氯气的性质、用途。2.了解重要的含氯化合物的性质及应用。
考点一 氯 气 氯 水
考点二 次氯酸 次氯酸盐
考点一 氯 气 氯 水
氯元素的价电子排布式为 ,位于元素周期表的第 周期第 族,属于p区元素,易得1个电子达到稳定结构,是典型的非金属元素。
(1)常见有颜色的气体:
F2(淡黄绿色)、Cl2(黄绿色)、溴蒸气(红棕色)、 NO2(红棕色)
HCl (1:500)
(3)常见气体在水中的溶解性:
Cl2 、HCl、SO2、H2S、CO、NO、NO2、NH3等。
记住: 易液化的气体: SO2、NH3 、Cl2
加压液化,形成液氯贮存在钢瓶中
3.从氯的原子结构认识氯气的化学性质——氧化性
思考:Cl原子、Cl2、Cl- 三个粒子的活泼性顺序?
答案: Cl原子 > Cl2 > Cl-
Cl2:存在Cl—Cl
Cl2在一定条件下,能跟许多金属、非金属及化合物发生反应。
形成Cl原子,表现强氧化性
1)与某些金属单质反应2)与某些非金属单质反应3)与水反应4)与碱液反应5)与某些有机物反应6)与一些还原性物质反应
Fe2+\ SO32-\ SO2\ I- \ Br- \ S2- \
1)可与大多数金属反应
(产生棕褐色的烟,溶于水溶液呈黄色)
(产生棕黄色的烟,溶于水溶液呈蓝绿色)
且把变价金属(如铁,铜)氧化成高价态。
注意:常温下,铁与氯气不反应,所以可用钢瓶储运液氯。
[对比]I2、S氧化性弱,只能将变价金属氧化到低价态
Cl2与金属反应,一律作氧化剂,1mlCl2转移2mle-
1、下列化合物中,不能由氯气和相应的金属直接反应来制取的是 A FeCl3 B CaCl2 C FeCl2 D KCl
2、下列化合物中,既能由氯气和相应的金属直接反应来制取, 也能由金属与酸反应制备的是( ) A FeCl3 B AlCl3 C FeCl2 D CuCl2
2)与非金属单质反应 (H2、P、Si等)
(H2在Cl2中安静地燃烧,发出 色火焰,瓶口有______)
(剧烈反应,发生 ,瓶口有 )
HCl是一种无色,有剌激性气味的气体,有毒,极易溶于水(常温常压下1∶500)HCl气体溶于水即得盐酸
Cl2与氢气反应发生爆炸
PCl3 + 3H2O = H3PO3 + 3HCl
PCl5 + 4H2O = H3PO4 + 5HCl
二. PCl3、PCl5均会水解生成2种酸:
关于PCl3、PCl5的2个问题:
PCl3:满足8e-稳定结构
磷在氯气中燃烧,产生白色的烟雾
应用:工业上粗硅的提纯
Cl2与非金属反应,一律作氧化剂,1mlCl2转移2mle-
③与FeCl2溶液反应: 。
②与SO2水溶液反应: 。
①与碘化钾溶液反应: 。
Cl2+2KI = 2KCl+I2
Cl2+SO2+2H2O = H2SO4+2HCl
Cl2+2FeCl2 = 2FeCl3
3)与某些还原性物质反应:
应用: 用湿润的淀粉KI试纸检验Cl2
应用: 等物质的量Cl2和SO2通入湿润的有色布条,布条不褪色
(溶液由浅绿色变棕黄色)
④氯水滴入氢硫酸中产生淡黄色浑浊:。
Cl2+H2S = 2HCl +S↓
⑤除去废水中的氯用Na2SO3溶液反应: 。
Cl2+Na2SO3+H2O=2HCl+Na2SO4
处于中间价态,因而Cl2既有氧化性又有还原性。
表现在氯气与水或碱反应
(1)氯气溶于水为何有杀菌、消毒作用?(2)干燥的Cl2有杀菌、消毒和漂白作用吗?
起漂白作用的是HClO而不是Cl2
Cl2 + H2O HCl + HClO
1mlCl2转移1mle-
问题:要使氯水中HClO浓度增大, 可采取哪些措施?
方法: 降低HCl的浓度,使平衡右移
措施: 加入酸性介于HCl与HClO之间的酸对应的盐
如CaCO3、NaHCO3、CH3COONa等
→将一盛满Cl2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的( ) A.2/3 B.1/2 C.1/3 D.1/4
但是,用氯气消毒自来水有一定的负面影响。如今,人们已开始研究并试用新的自来水消毒剂,如:二氧化氯(ClO2)、臭氧(O3)、活性炭等。
次氯酸的强氧化性能杀死水里的病菌,所以,自来水常用氯气(在1L水中通入0.002g Cl2 )来杀菌消毒。
①与烧碱反应: 。
Cl2+2NaOH = NaCl+NaClO+H2O
若Cl2与热的浓NaOH反应呢?
②与石灰乳反应: 。
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
漂白粉的主要成分是 ,有效成分是 。
Ca(ClO)2、CaCl2
工业上用于制造漂白液,实验室用于 Cl2的吸收
(写出下列反应离子方程式)
6) Cl2参与有机反应
:烯烃加成、烷烃、芳香烃的取代等
①丙烯与Cl2加成②甲烷与Cl2取代③苯与Cl2的取代④苯与Cl2的加成
制漂白粉(精),漂白棉、麻、纸张
用于冶金工业和有机化工
氯气是一种重要的化工原料。
(1)氯气的水溶液称为氯水,氯水中存在三种平衡关系:
①Cl2+H2O HCl+HClO②HClO H++ClO-③H2O H++OH-
实验室使用的氯水只能现配现用, 并放在棕色试剂瓶中。
(2)久置氯水和新制氯水有何区别?
液氯与氯水、新制氯水与久置氯水的区别?
分子: Cl2, HClO, H2O; 离子: H+, Cl-, ClO-
分子: H2O; 离子: H+, Cl-
有氧化性,无酸性和漂白性
有酸性, 强氧化性, 能漂白, 消毒, 光照时HClO分解
只有酸性(实际就是稀盐酸)
CaCO3+2H+=Ca2++CO2+H2O
2OH-+Cl2=Cl-+ClO-+H2O
Ag+ + Cl- = AgCl
2Br-+Cl2 = Br2 +2Cl-
SO32-+Cl2+H2O=SO42-+2Cl-+2H+
2HClO =2H++2Cl-+O2↑
思考:若将新制氯水滴入下列物质或溶液中,试完成下表:
1.标准状况下,11.2 L Cl2与水充分反应转移的电子数为0.5NA( )2.可以用pH试纸测定氯水的pH( )3.向新制氯水中加入碳酸钙粉末或亚硫酸钙粉末,能增强氯水的漂白效果( )4.若贮氯罐意外发生泄露,人们应用浸有一定浓度NaHCO3溶液的毛巾捂住鼻子,在低洼处等待救援( )
1.下列有关氯气的说法不正确的是A.常温下用钢瓶储运液氯B.光照H2和Cl2的混合气体时,因二者迅速化合而爆炸C.红热的铜丝在Cl2中燃烧,生成棕黄色固体CuCl2D.少量Cl2和Fe在加热时反应生成FeCl2
Fe与Cl2在加热时反应只生成FeCl3,生成物与Cl2的用量无关,D项错误
(2)装置B中发生反应的离子方程式是______________________________。
2.根据下列装置图回答问题:
(1)装置A、B通入干燥的Cl2后,观察到的现象是____________________,根据现象可得出的结论是 。
干燥的红色布条不褪色,
Cl2无漂白性,Cl2与水反应生成的HClO有漂白性
Cl2+H2O H++Cl-+HClO
(3)实验开始后,观察装置C中的现象是__________________。
(4)通入Cl2时装置D中发生反应的离子方程式是___________________。
H2O+SO32-+Cl2=2H++SO42-+2Cl-
(5)装置E中发生反应的离子方程式是_________________________。
2Fe2++Cl2=2Fe3++2Cl-
(6)装置F的作用是_________________________。
吸收氯气,防止污染环境
3.下列实验事实,分别说明氯水中含有哪些粒子?完成下列表格:
二、氯水成分及性质探究
4.用滴管将新制的氯水慢慢滴入含有酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪去。请你对发生这一现象的原因,提出两种合理的猜想。猜想一:_______________________________________。猜想二:___________________________________。请用简单的实验方法证明你的猜想:________________________________。
氯水中含有HClO,其漂白作用使溶液褪色
氯水中含有H+,中和OH-使溶液褪色
→往褪色后的溶液中加入NaOH(aq):
出现红色,证明猜想二正确;无现象,则猜想一正确。
考点二 次氯酸 次氯酸盐
写出HClO的电子式和结构式
2NaOH+Cl2=NaCl+NaClO+H2O
(酸性:H2CO3 > HClO > HCO3- )
阳极:2Cl - -2e- = Cl2↑
阴极:2H2O+2e- =H2↑+2OH-
→84消毒液和洁厕剂(主成分:浓盐酸)不能混用, 请写出反应的离子方程式?
ClO - + Cl- + 2H+ = Cl2 ↑ + H2O
CaCl2和Ca(ClO)2
Ca(ClO)2+CO2+H2O=CaCO3+2HClO
工业上:用稀盐酸或稀硫酸
Ca(ClO)2+2HCl=CaCl2+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
①过量CO2通入Ca(ClO)2溶液
②SO2通入Ca(ClO)2溶液
③可用Ca(ClO)2溶液与浓盐酸反应制备Cl2
Ca(ClO)2+2CO2 +2H2O
Ca(HCO3)2+ 2HClO
HCO3—+ HClO
Ca(ClO)2+ 2SO2 + 2H2O
CaSO4↓+ 2HCl
Ca(ClO)2+ 4HCl(浓)== CaCl2+ 2Cl2↑+ 2H2O
ClO—+ CO2 + H2O
有漂白性的物质 Na2O2 O3 HClO 氯水 Ca(ClO)2 SO2 活性炭等
Na2O2、O3、HClO、氯水、漂白粉、H2O2等
纸浆、毛、丝、草帽、品红等
品红等色素臭味,小颗粒
1.使有机色素褪色才叫漂白
2.SO2不能漂白酸碱指示剂
1. 用Cl2消毒的自来水配制下列溶液,不会引起药品变质的是
A. NaCl B. AgNO3 C. NaOH D. Ca(OH)2
2. 下列物质中,不能使有色布条褪色的是
A. NaClO溶液 B . Ca(ClO)2 溶液
C. 氯水 D. CaCl2溶液
3. 浓盐酸和Ca(ClO)2能发生如下反应:Ca(ClO)2+4HCl(浓)== CaCl2+2Cl2↑+2H2O用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是 ①CO2 ②HCl ③H2O ④O2A.①②③ B.②③④ C.②③ D.①④
4.如图所示,A处通入湿润的Cl2,关闭B阀时,C处的红布看不到明显现象,当打开B阀后,C处红布条逐渐褪色,则D中装的是( ) A. 浓H2SO4 B. NaOH溶液 C. H2O D. 饱和NaCl溶液
5.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO = 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是 ( )。 A.NaCl、NaClO B.NaCl、NaClO3C.NaClO、NaClO3 D.NaClO3、NaClO4
6.将一定量的Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO、NaClO3的混合液。当混合液中Cl-和ClO3-的个数比为15:2时,混合液中ClO-和ClO3-的个数比为 .
氧化还原反应中“得失电子守恒”
1.漂白粉在空气中长时间放置,最终得到的固体产物为CaCO3( )2.NaClO是“84”消毒液的主要成分,在使用“84”消毒液时, 在空气中放置一段时间后,漂白效果更好( )3.“84”消毒液和酒精同时使用可增强杀菌效果( )4.用Cl2消毒的自来水中可能含有有机氯化物,对人体有害( )
NaClO具有强氧化性,会与乙醇发生氧化还原反应,降低杀菌效果
1.某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH- = Cl-+ClO-+H2OB.该消毒液的pH约为12:ClO-+H2O HClO+OH-C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒的Cl2: 2H++Cl-+ClO- = Cl2↑+H2OD.该消毒液加白醋生成HClO,可增强漂白作用: CH3COOH+ClO- = HClO+CH3COO-
2.二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用于饮用水消毒。按要求回答下列问题:(1)NaClO2在酸性条件下反应生成ClO2和NaCl,写出反应的离子方程式: ___________________________________。
(2)ClO2在强碱性环境中失效,可能的原因是会发生歧化反应生成ClO3-和ClO2- ,写出反应的离子方程式 。
5ClO2-+4H+=Cl-+4ClO2↑+2H2O
2ClO2+2OH-=ClO3-+ClO3-+H2O
3.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是_____>____>_________(填化学式)。
ClO2 Cl2 Na2FeO4
第24讲 硫及其化合物的相互转化-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第24讲 硫及其化合物的相互转化-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共26页。PPT课件主要包含了复习目标等内容,欢迎下载使用。
第21讲 卤族元素 溴、碘单质的提取-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第21讲 卤族元素 溴、碘单质的提取-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共41页。PPT课件主要包含了复习目标,内容索引,专项突破,归纳整合等内容,欢迎下载使用。
第18讲 铜 金属材料 金属冶炼-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第18讲 铜 金属材料 金属冶炼-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共46页。PPT课件主要包含了专项突破,归纳整合,结构决定性质等内容,欢迎下载使用。












