



第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
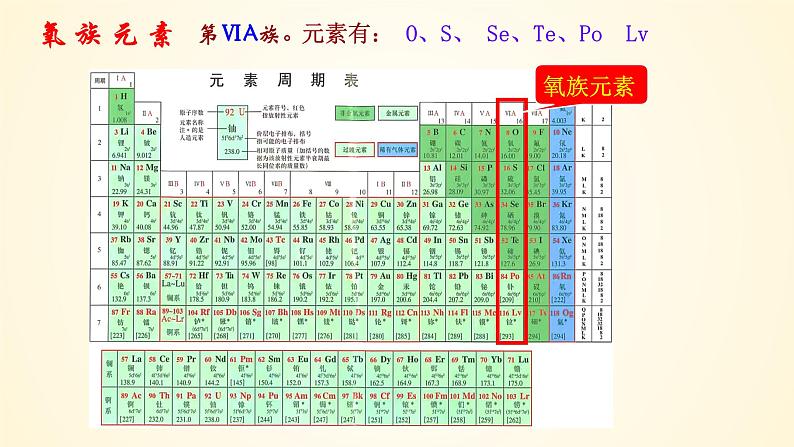
展开元素有: O、S、 Se、Te、P Lv
O S Se Te P 116Lv
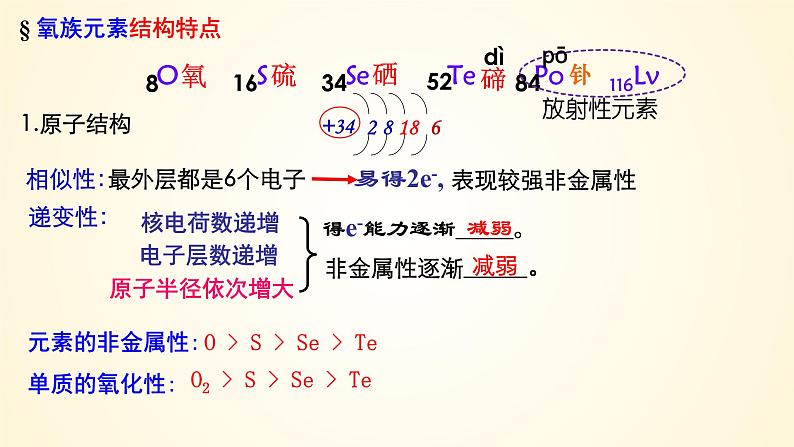
得e-能力逐渐 。
非金属性逐渐 。
元素的非金属性:单质的氧化性:
O > S > Se > Te
O2 > S > Se > Te
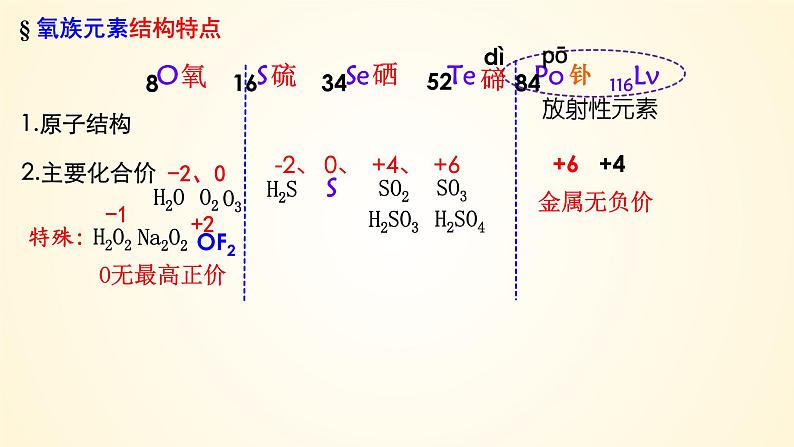
-2、 0、 +4、 +6
O S Se Te
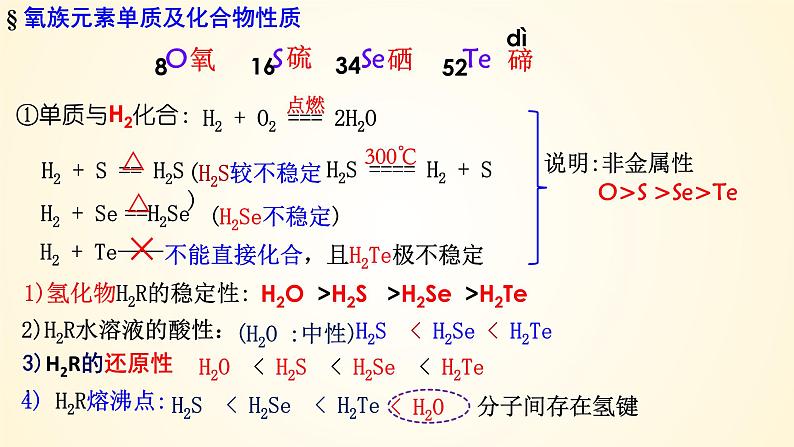
1)氢化物H2R的稳定性:
H2O >H2S >H2Se >H2Te
(H2S较不稳定 )
2)H2R水溶液的酸性:
H2S < H2Se < H2Te
H2O < H2S < H2Se < H2Te
H2S < H2Se < H2Te
不能直接化合,且H2Te极不稳定
§ 氧族元素单质及化合物性质
> >
O2 S Se Te
低 高
一、臭氧的性质和用途
色气体、特殊 味,比O2易溶与水
O3 与 O2互为 。
1)不稳定性 2O3 = 3O2
①O3能氧化Ag、Hg等不活泼金属
③漂白剂:O3能使有色物质褪色(其褪色原理与HClO类似)
②能使湿润的淀粉KI试纸变蓝色
(高温、紫外线等条件)
2Ag + 3O3 = Ag2O2 + 2O2
O3 + 2KI + H2O =I2 + 2KOH + O2
如将O3通入石蕊试液中,溶液变为无色。
既不是氧化产物也不是还原产物
①可用作脱色剂、消毒剂; ②臭氧层可以吸收来自太阳的紫外线
无色粘稠液体,其水溶液称为双氧水
→应用:杀菌、消毒、漂白剂
H2O2+2KI+ H2SO4 =I2+H2O+K2SO4
(与Fe2+\ SO32-\ SO2\ I- \ Br- \ S2- 等反应)
H2O2作氧化剂 还原产物为H2O ,不会引入新杂质
2KMnO4+5H2O2+3H2SO4=2MnSO4+5O2↑+8H2O+K2SO4
(如与酸性KMnO4溶液反应)
(请写出其电离方程式)
(Cu2+、Fe3+等也能催化该反应)
1. 将双氧水滴入含酚酞的NaOH(aq)中,红色褪去。甲认为:H2O2是二元弱酸,消耗了OH—,红色褪去;乙认为:H2O2具有强氧化性,将酚酞氧化,红色褪去。 请设计实验证明:甲、乙谁解释正确?
取褪色后的溶液,滴加少量NaOH(aq):
出现红色,则甲正确;无明显现象,则乙正确
2. Cu与稀H2SO4不反应,若在稀H2SO4中滴加双氧水后,则可使Cu顺利溶解,请推测其中发生的反应方程式: 。
Cu + H2SO4 + H2O2 = CuSO4 + 2H2O
3.已知干燥的CO2不与Na2O2反应,但潮湿的CO2可以与Na2O2反应,试写出潮湿的CO2与Na2O2发生反应的过程 ;(2) .
Na2O2 + CO2+ H2O = Na2CO3+ H2O2
2H2O2 = 2H2O+O2↑
(较强酸制较弱酸原理)
考点一 硫 单 质 的性质
②固态硫化物和硫酸盐:
芒硝 :Na2SO4.10H2O
①气态化合物 :H2S、SO2、SO3
黄铜矿: CuFeS2
石膏 :CaSO4.2H2O
③硫也是一种生命元素,组成某些蛋白质时不可离开它。因此化石燃料中经常含有硫元素。
硫单质俗称 ,是一种 色晶体;不溶于 ,微溶于 ,易溶于 ;有多种同素异形体,如单斜硫、斜方硫等。
2. 硫单质的物理性质
S2、S4、S6、S8等
问题1:熔过硫的试管可用 或 洗涤。
问题2:硫单质难溶于水,易溶于CS2,其原因是什么?
硫单质、CS2均属于非极性分子,而H2O属于极性分子,根据“相似相溶”规律,非极性分子易溶于非极性分子形成的溶剂中。
3.从化合价的角度认识硫单质的化学性质
S单质:既有氧化性又有还原性,以氧化性为主
S可与大多数金属反应,但遇变价金属只能氧化得到低价态
2Na + S = Na2S
Hg + S = HgS(常温下反应 ,除去洒落在地上的Hg珠)
2Ag + S = Ag2S(常温下反应 ,银器久置变黑)
表现S的 性
H2: ,表现 性
O2: ,表现 性
纯氧中:明亮的蓝紫色火焰;空气中:淡蓝色火焰;并有刺激性气味的气体产生
只能生成SO2,不能得到SO3
试写出S分别与浓硫酸、浓硝酸的反应方程式
4)可与强碱溶液反应:
【可用热的NaOH溶液洗去附着在试管上的S】
制H2SO4、硫化橡胶、医药、农药、火柴、黑火药等
3C + S+2KNO3= K2S+3CO2+N2
下列事实中能用来说明氯的非金属性比硫强的是( )①与Fe反应:2Fe +3Cl2 ==== FeCl3 Fe +S === FeS②稳定性:HCl>H2S ③酸性:HClO4>H2SO4④酸性:HCl>H2S⑤Cl2通入H2S溶液中的反应: Cl2+H2S = 2HCl+S↓A、全部 B、②③ C、①②③ D、除④外
无色有臭鸡蛋气味的气体,能溶于水(1:2.6),有剧毒。
2)还原性:较强(硫元素呈现最低价——–2价)
常温下,H2S与SO2、Cl2不能共存
2H2S + SO2 = 3S + 2H2O
H2S + Cl2 = S + 2HCl
[加热到300℃可分解]
H2S + Cl2 = S↓ + 2HCl
H2S(少量) + NaOH ——
H2S(足量) + NaOH ——
Na2S + H2O
2H2S + O2 = 2S↓+ 2H2O
(与O2、Cl2、浓硫酸、硝酸、 KMnO4溶液等反应)
思考: 与H2S气体的燃烧反应有什么区别?
(Br2、Fe3+、I2均可以氧化H2S)
[知识扩展] 硫化物的溶解性
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
K2S CaS Na2S
FeS + 2HCl= FeCl2+ H2S↑
黑色,难溶于水又难溶于酸
PbS CuS Cu2S HgS Ag2S
CuSO4 +H2S =CuS↓+H2SO4
1.在下列反应中硫元素只表现氧化性的是
2.加热装有硫粉的试管,硫粉很快熔化为液体,继而有淡黄色气体产生。将光亮细铜丝伸入气体中,铜丝发光发热且有黑色物质生成。由上述现象不能得出的结论是A.硫的熔、沸点较低B.硫晶体属于分子晶体C.铜丝能在硫蒸气中燃烧D.黑色固体是Cu2S
说明硫的熔、沸点较低,因此硫晶体属于分子晶体,A、B正确;
→根据实验现象不能得出黑色固体是Cu2S,因为CuS也是黑色的
考点二 二氧化硫和三氧化硫
① 色、 气味、有毒气体
③ 溶于水(1∶40)
④易液化(-10℃)
( SO2是大气污染物)
(另有 易液化)
1. 二氧化硫 SO2
试管内水位上升;说明SO2易溶水。用PH试纸测定,溶液呈酸性。
1.具有酸性氧化物的通性
(1)SO2跟水反应:
紫色石蕊试液滴入SO2的水溶液中: (现象)
SO2通入Ca(OH)2溶液
SO2 + Ca2+ +2OH—
CaSO3↓+ H2O
不可用澄清石灰水鉴别SO2和CO2
H2SO3是一种弱酸,但酸性: H2SO3 >醋酸>碳酸
CaSO3 + SO2+ H2O = Ca(HSO3)2
写出SO2分别通入NaOH溶液、氨水中的离子方程式
(用浓NaOH溶液吸收多余的SO2)
(3)与碱性氧化物反应
2CaSO3 + O2 = 2CaSO4
(CO32—、HCO3—、SiO32—盐等)
SO2 + Na2CO3 = Na2SO3 + CO2
(相当较强酸制较弱酸)
SO2 + 2NaHCO3 = Na2SO3 +2CO2+ H2O
应用:用饱和NaHCO3溶液除去CO2中的SO2气体
或:SO2 + NaHCO3 = NaHSO3 + CO2
注意:SO2与氧化性盐[如Ca(ClO)2、Ba(NO3)2]发生氧化还原反应
1. SO2气体通入BaCl2溶液是否有白色沉淀?为什么?
2. 若分别再滴入氯水或稀氨水,是否有沉淀?为什么?
注意:SO2 + CaCl2 / BaCl2——不反应
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
H2SO4 + BaCl2 = BaSO4↓+ 2HCl
(NH4)2SO3 + BaCl2 = BaSO3↓+ 2NH4Cl
迁移练习. 在BaCl2溶液中通入SO2气体,未见沉淀生成,若再通入下列物质,则可以看到沉淀的是 。①Cl2 ②NH3 ③NO2 ④H2S ⑤HCl ⑥CO2 ⑦HNO3 ⑧NaOH ⑨FeCl3 ⑩NaClO
1)具有强氧化性的物质:
①Cl2 ③NO2 ⑦HNO3 ⑨FeCl3 ⑩NaClO
②NH3 ⑧NaOH
3) 2H2S+SO2 = 3S↓+2H2O
① ② ③④ ⑦ ⑧⑨ ⑩
2. SO2的强还原性:
→SO2可被O2、O3、X2(卤素单质)、KMnO4(H+)、HNO3、Fe3+、Na2O2 、H2O2、Ca(ClO)2等许多氧化剂氧化。
注意:SO2与浓H2SO4相邻价态,不发生氧化还原反应
(工业制硫酸,接触室)
还原性:SO2〉I -〉Fe2+〉Br-〉Cl-
写出SO2分别与Br2水、KMnO4(H+)、HNO3(稀)、Fe3+ 、H2O2、Ca(ClO)2、Ba(NO3)2反应化学方程式
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
5SO2 + 2KMnO4+ 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
(SO2使KMnO4(H+)溶液褪色)
3SO2 + 2HNO3(稀) + 2H2O = 3H2SO4 + 2NO
2Fe3++ SO2+ 2H2O = 2Fe2+ +SO42—+4H+
SO2 + H2O2 = H2SO4
Ca2++2ClO—+2SO2 +2H2O
CaSO4↓+ 2Cl—
3Ba2++2NO3—+3SO2 +2H2O
3BaSO4↓+ 2NO +4H+
3. SO2的氧化性:
注意:常温下,H2S、SO2不能共存
体现SO2氧化性的唯一反应
4. SO2的漂白性:
漂白原理: SO2跟有色物质化合生成一种无色的不稳定化合物。
应用:SO2可以用来漂白纸浆、毛、丝、草编制品等。
古代用燃烧硫的方法漂白布料
2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是__________ 溶液;加热时溶液由无色变为红色的原因是: 。
迁移练习.某学生课外活动小组利用右图所示装置分别做如下实验:1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是: 。
稀氨水中的NH3气逸出,所以溶液的颜色变浅
SO2气体逸出,品红溶液恢复红色
或SO2 + NaHCO3=NaHSO3 + CO2
饱和的NaHCO3溶液
1.怎样除去CO2中的SO2?
2.怎样检验某混合气体中含有CO2和SO2?
Br2水或KMnO4(H+)
3.怎样检验C2H4中混有CO2和SO2杂质?
不可用KMnO4(H+)溶液
5C2H4 +12KMnO4+ 18H2SO4 = 6K2SO4 + 12MnSO4 + 10CO2+ 28H2O
SO2 + 2NaHCO3=Na2SO3 +2CO2+ H2O
A、工业上制硫酸B、漂白纸浆、毛、丝、草编制品等。 C、杀菌消毒,做食物和干果的防腐剂D、食品添加剂(不可超标)、抗氧化剂(葡萄酒中)等
SO3 + H2O = H2SO4
作为葡萄酒中十分重要的添加剂,二氧化硫的使用历史已达200余年之久。到目前为止仍未找到能取代二氧化硫的添加剂。
杀死葡萄皮表面的杂菌、抗氧化、改善风味的作用,没有它,葡萄酒会很快氧化。
Na2SO3 + H2SO4(70%)= Na2SO4 + H2O +SO2↑
Na2SO3粉末和70%的浓硫酸
(3)SO2的实验室制法
用NaOH溶液吸收(注意防倒吸)
用浓H2SO4或P2O5固体
注 意:少量SO2也可以用Cu与浓H2SO4制备
2. 三氧化硫(SO3)
(1)物理性质:熔点为16.8℃,沸点为44.8℃。
(2)化学性质:硫酐,具有酸性氧化物的通性
SO3 + Ca(OH)2 = CaSO4 + H2O
SO3 + CaO = CaSO4
SO3 + H2O=H2SO4
反应放热。工业上用98.3%的浓硫酸吸收SO3
常温下为 态,标况下为无色 。
1.欲除去SO2中的SO3,应选用的试剂是( ) A.NaOH溶液 B.水 C.饱和NaHSO3溶液 D.浓硫酸
2.为方便某些化学计算,有人将98%的浓硫酸表示成下列形式,其中合理的是( )A. H2SO4 ∙ H2O B. SO3 ∙ H2O C. H2SO4 ∙ SO3 D. H2SO4 ∙H2O
1.判断下列有关SO2性质的叙述不正确的是________(填序号)。①能使澄清石灰水变浑浊。②能使湿润的蓝色石蕊试纸变红。③能使品红溶液褪色。④通入BaCl2溶液生成白色沉淀。⑤通入足量的NaOH溶液中再加BaCl2溶液产生白色沉淀,该沉淀能溶于盐酸。⑥通入溴水中能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀生成。⑦1 ml二氧化硫与足量水反应生成1 ml亚硫酸。⑧实验室制备SO2时,多余的SO2可用碱液吸收。
2、高温下硫酸亚铁发生如下反应: 2FeSO4==Fe2O3+SO2↑+SO3↑ 若将生成的气体通入BaCl2溶液中,得到的沉淀物是 ( ) A、BaSO4和BaSO3 B、BaS C、BaSO3 D、BaSO43、向FeCl3和BaCl2的酸性混合溶液中通入SO2气体, 有白色沉淀生成,此沉淀是( ) A、BaSO4 B、FeS C、BaSO3 D、S
4.如图所示,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。表中对实验现象的描述或解释不正确的是( )
5.有一瓶无色气体,可能含有 HCl、CO2、H2S、HBr、SO2中的一种或几种。将其通入氯水中,得无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的氯化钡溶液,出现白色沉淀;另一份加入硝酸酸化的硝酸银溶液,也有白色沉淀。回答:(1)原气体中一定含有 ; (2)原气体中一定不含有 ; (3)不能确定原气体中是否含有 。
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的硫酸为原料制取SO2,采用MnO2和浓盐酸(12 ml/L)为原料制取Cl2。在此实验中,F仪器的作用是 ;
6.为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。
(2)发生装置B应选择右边三种装置中的____(填序号)。
(3)D装置中主要反应的离子方程式为 。
Cl2+SO2+2H2O=4H++SO42-+2Cl-
第24讲 硫及其化合物的相互转化-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第24讲 硫及其化合物的相互转化-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共26页。PPT课件主要包含了复习目标等内容,欢迎下载使用。
第21讲 卤族元素 溴、碘单质的提取-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第21讲 卤族元素 溴、碘单质的提取-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共41页。PPT课件主要包含了复习目标,内容索引,专项突破,归纳整合等内容,欢迎下载使用。
第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合,生活小知识等内容,欢迎下载使用。












