





第28讲 硅、无机非金属材料-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
展开1.掌握Si元素的单质及其重要化合物的性质及应用。2.掌握无机非金属材料的性质和用途。
考点一 碳族元素 硅和二氧化硅
考点二 无机非金属材料
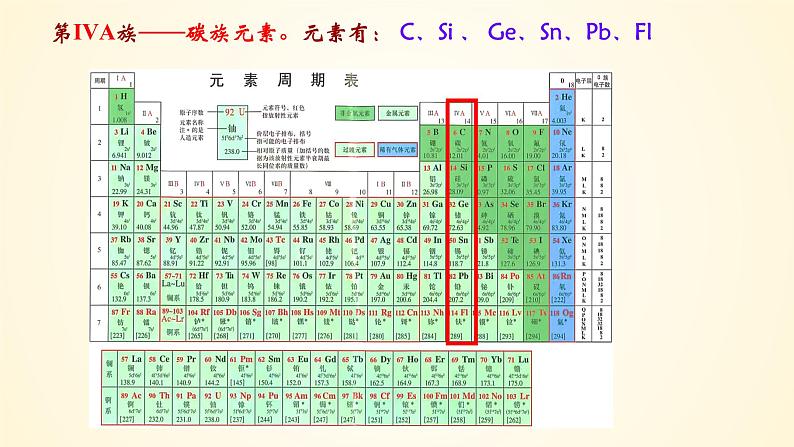
第IVA族——碳 族 元 素
第IVA族——碳族元素。元素有: C、Si 、 Ge、Sn、Pb、Fl
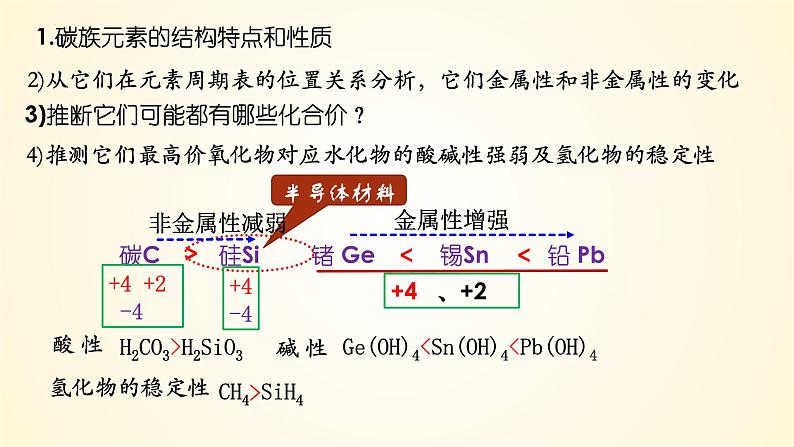
1.碳族元素的结构特点和性质
[难得e-,也难失e-,易形成共价键]
1.某原子难失电子,则一定易得电子( )
2.碳族元素形成化合物种类最多 ( )
3.碳族元素只存在单质和共价化合物中 ( )
碳族元素易形成共价键,但同样可以存在离子化合物中,如CaC2、Na2CO3
碳C 硅Si 锗 Ge 锡Sn 铅 Pb
其价电子排布式为 。
2)从它们在元素周期表的位置关系分析,它们金属性和非金属性的变化
3)推断它们可能都有哪些化合价?
4)推测它们最高价氧化物对应水化物的酸碱性强弱及氢化物的稳定性
碳C 硅Si 锗 Ge 锡Sn 铅 Pb
< <
H2CO3>H2SiO3
Ge(OH)4
故: CO、SnCl2具有强还原性,PbO2具有强氧化性
而CO2、SiO2在反应中不表现出氧化性,或只表现出弱的氧化性
已知:还原性 Sn2+>Fe2+,氧化性PbO2>Cl2,试写出下列化学方程式:①氯气与锡共热:___________________②氯气与铅共热:___________________③PbO2浓盐酸共热__________________④能说明Sn2+还原性比Fe2+还原性强的离子方程式是 . ⑤把棕色的PbO2投入亚硫酸溶液中充分反应,可观察到把棕色的PbO2逐渐变成白色固体物质
PbO2+H2SO3 = PbSO4+H2O
Sn2++2Fe3+ = Sn4++2Fe2+
2.碳族元素单质的物理性质
碳C 硅Si 锗 Ge 锡Sn 铅 Pb
1.科学家已发现的114号元素具有稳定的同位素,关于它的结构和性质预测,错误的是( )
A.它的原子最外层上有4个电子B.它的金属性比Pb强C.电解它的硝酸盐和硝酸铜的混合液时,先析出铜D.它的主要化合价为+2和+4价,且以+4价化合物最稳定
2.下列气态氢化物最不稳定的是( )PH3 B. H2S C. HCl D. SiH4
3.下列关于碳族元素性质的叙述正确的是( ) ①随原子序数的增加单质的熔点逐渐升高;②单质中硅的熔点最高;③单质均为无色晶体;④是由非金属向金属过渡的典型族;⑤碳族元素的价电子是4个,介于易失电子与易得电子的元素之间,故一般不易形成离子化合物;⑥碳族元素形成的化合物种类最多;⑦它们均以+4价为稳定价态;⑧从碳到铅,ⅣA族元素最高价氧化物对应水化物酸性逐渐增强。 A ①②③ B ④⑤⑥ C ⑥⑦⑧ D ①④⑦
4.下列关于C、Si两种非金属元素的说法中,正确的是( )A.两者结合形成的化合物是共价化合物B.在自然界中都能以游离态存在C.氢化物的热稳定性比较:CH4<SiH4D.最高价氧化物都能与水反应生成相应的酸
5.GBO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在GBO中,锗处于其最高价态 ②在GBO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构 ③GBO可看作是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在GBO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:(1)锗和铋的元素符号分别是 和 。 (2)GBO晶体的化学式是 。
2Bi2O3•3GeO2 或 Bi4(GeO4)3
6.已知Fe3O4可以改写成“混合氧化物”形式: FeO·Fe2O3, 或者“盐的形式”: Fe(FeO2)2。请用类比的方法写出Pb3O4 “混合氧化物”和“盐的形式”
Fe3O4+8HCl(浓)=FeCl2+2FeCl3+4H2O
请写出Pb3O4与浓HCl反应的化学方程式
Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
C → CO、CO2 → H2CO3 → CO32-盐、HCO3-盐
1.C单质的存在形态、物理性质及用途
金刚石、石墨、无定形碳、炭黑、足球烯C60等
CO、CO2 、H2CO3 、CaCO3、NaHCO3、CaC2等
存在形式:金刚石、石墨、无定形碳、足球烯[互为同素异形体]
②每个碳原子都采取____杂化;
③所有的C—C键长相等,键角相等,键角为_________.
④晶体中最小的碳环由___个碳组成, 且_____同一平面内;
①在金刚石晶体中每个碳原子周围紧邻的碳原子有 个
⑤每个碳原子被 个六元环共用。
知识回顾: 金刚石的结构
⑦在金刚石晶胞中占有的碳原子数____
8×1/8+6×1/2+4=8
→12g金刚石含有___个C原子,含有____个C-C键
⑥晶体中每个C参与了 条C—C键的形成,而在每条键中的贡献只有 ,故C原子与C—C键数之比为: 。
→即金刚石中,1mlC平均拥有 ml C—C键
用作电极、铅笔芯、润滑剂等
未参与杂化的p轨道上电子可在层内运动
→既有共价键又有范德华力,同时还存在类似金属键的作用力,兼具共价晶体、分子晶体、金属晶体特征的晶体,称为混合型晶体。
构成σ键的sp2杂化轨道
知识回顾: 石墨的结构
③1ml石墨(C)中含有____mlC-C键 。
个C-C键。
每个环中,平均含有 个C原子,
①石墨中C原子以sp2杂化;层内C-C之间夹角为____。
②石墨晶体中最小环为 元环,
④层平面内,C原子的配位数为3,共价键的键长很短,键能很大,石墨的熔点很高。
60个碳原子构成球形,共32面体, 包括12个五边形,20个六边形。
②每个碳原子只跟相邻的三个碳原子形成共价键.
①笼状分子,固态时是分子晶体.
下列对碳的同素异形体:金刚石、石墨和C60的说法中,正确的是﹙ ﹚A 它们都是共价化合物B 1ml金刚石和石墨都含有1mlC-C键C 在一定条件下与O2反应生成CO2D 它们的熔点都很高
→ C60:分子晶体熔点低
CuO: (冶炼金属)
碳: 常温下,稳定。高温时,一般表现还原性。
SiO2: (制取粗硅)
H2O: (制取水煤气)
浓H2SO4:
浓HNO3:
Si → SiO2 → H2SiO3 、H4SiO4 → SiO32-盐
①硅在地壳中含量第二,因有亲氧性,所以仅有化合态。
②硅是构成岩石和矿物的主要成分。
(主要以SiO2和硅酸盐形式存在)
③单质Si:有晶体硅和无定形硅两大类
晶体硅: 带有金属光泽,硬而脆的灰黑色固体,熔点高,硬度大,结构类似金刚石
1、晶体硅的结构、性质
常温下,能与F2、氢氟酸(HF)、强碱溶液反应
Si + 2F2 = SiF4
Si + 4HF = SiF4↑ + 2H2↑
Si + 2NaOH + H2O=Na2SiO3 + 2H2↑
硅: 常温下,很稳定。高温时,一般表现还原性。
加热时, 能与O2、Cl2、C等反应
(将Si粉碎, 在O2中燃烧)
该反应中,氧化剂 : 还原剂 =
①粗硅的制取:工业上用焦炭还原石英砂
碳化硅(俗名:金刚砂)
④制铝合金、铁合金等多种合金
电脑中央处理器(CPU)
例如:含硅元素4%的硅钢具有导磁性
水晶、石英、玛瑙、沙子、硅石、硅藻土、脉石等主要成分都是SiO2
2.SiO2晶体结构
SiO2是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α-SiO2)。
低温石英晶体的空间结构模型
其结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构。
→这一结构决定了它具有手性,被广泛用作压电材料,如石英手表。
封闭的环状结构SiO2晶体
①每个Si原子都采取 杂化和 个O原子形成 个Si—O键.
②没有单个SiO2分子存在,只存在硅、氧原子,Si:O比例: .
每个Si周围结合 个O;
每个O周围结合 个Si
③最小的环是由6个Si原子和6个O原子组成的12元环。
④1ml SiO2中含 ml Si—O键
⑴酸性氧化物:但是不溶于水,也不与水反应
与碱性氧化物化合:
(3)特殊性:与HF反应:SiO2+4HF=SiF4↑+2H2O
(氢氟酸用于雕刻玻璃)
SiO2+2NaOH = Na2SiO3+H2O
(1)不能依据反应2C+SiO2==== Si+2CO↑来说明C的还原性比Si强,也不能依据反应SiO2+Na2CO3====Na2SiO3+CO2↑来说明SiO2水化物的酸性比H2CO3强。
(3)SiO2虽然能与NaOH溶液、HF溶液反应,但不属于两性氧化物,属于酸性氧化物,但与水不能直接反应。
(2)氢氟酸能腐蚀玻璃并用于雕刻玻璃,盛放氢氟酸不用玻璃瓶而用塑料瓶。盛放碱性溶液的试剂瓶不能用玻璃塞,因为SiO2与碱溶液反应生成具有黏性的Na2SiO3。
(2)制作首饰与工艺品(水晶、玛瑙)
(3)制作光学仪器(石英玻璃、石英坩埚)
1、半导体材料—硅芯片、硅整流器、集成电路等
★总结提升 含硅化合物的特殊性
(4)水晶、石英、玛瑙的主要成分是SiO2; 珍珠的主要成分是CaCO3; 钻石是金刚石; 红、蓝宝石的主要成分是Al2O3。
(3)不要混淆二氧化硅和硅的用途 用于制作光导纤维的是SiO2, 用于制作半导体材料、计算机芯片的是晶体硅。
(2)酸性氧化物一般不与酸作用, 但SiO2能跟HF作用:SiO2+4HF=SiF4↑+2H2O。
(1)SiO2是H2SiO3的酸性氧化物, 但它不溶于水,不能直接与水作用制备H2SiO3。
补充一:硅酸(H2SiO3)
(1)制备:硅酸盐 + 酸
Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl
Na2SiO3+CO2+H2O=H2SiO3(胶体)+Na2CO3
硅酸在水中易聚合形成胶体
H2SiO3 硅酸凝胶 硅酸干凝胶 “硅胶”
硅胶多孔,吸附水份能力强,常用作干燥剂,也可以用作催化剂的载体。
②不稳定(比H2CO3稳定),受热易分解
H2SiO3 + 2NaOH = Na2SiO3 + 2H2O
硅酸不溶于水,其酸性比碳酸弱,不能使紫色石蕊溶液变红色。
原硅酸: H4SiO4
H4SiO4 = H2SiO3+H2O
回顾:怎样由SiO2制取H2SiO3?
Na2SiO3+2HCl=2NaCl+H2SiO3↓
或 Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
SiO2+2NaOH=Na2SiO3+H2O
反应原理:较强酸制较弱酸
讨论:将过量的CO2分别通入: ① CaCl2溶液; ② Na2SiO3溶液; ③ Ca(OH)2溶液;④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是 ( )A.①②③④ B.②④ C.①②③ D.②③
1、存在:地壳岩石的主要成分
硅酸盐是由硅、氧和金属元素组成的化合物的总称。
多数硅酸盐结构复杂、种类繁多
是构成地壳岩石的主要成分。
硅酸及其缩水结合而成的各种酸所对应的盐统称为硅酸盐
由硅、氧、氢和金属元素等组成
绝大多数不溶于水。(碱金属硅酸盐除外)
硅酸钠(Na2SiO3)是少数 于水的硅酸盐,为白色晶体,其水溶液呈 性,故其水溶液俗称 ,固体称为 。
硅酸钠溶液用途:木材等防火剂、肥皂填料及黏胶剂(矿物胶)
(用离子方程式表示原因)
SiO32- +2H2O H2SiO3+2OH-
Na2SiO3+2HCl = 2NaCl + H2SiO3↓
Na2SiO3+2HCl+H2O = 2NaCl + H4SiO4↓
硅酸钠:Na2SiO3
沸石:Na2A12(SiO3)2(OH)4
粘土(高岭石):Al2 (Si2O5) (OH)4
原则:活泼金属氧化物·较不活泼金属氧化物·xSiO2 ·nH2O
Na2O · SiO2
Al2O3 · 2SiO2· 2H2O
Na2 O · Al2O3 · 2SiO2· 2H2O
K2O· Al2O3 · 6SiO2
Ⅰ.氧化物之间以“·”隔开;Ⅱ.系数配置出现分数应化为整数。
1.将下列硅酸盐用“氧化物形式”表示
:Na2O·3FeO·Fe2O3·8SiO2·H2O
钾云母(KH2Al3Si3O12):
K2O·3Al2O3·6SiO2·2H2O
石棉:Na2Fe5Si8O22(OH)2
[注意: 元素化合价不变]
[注意: 原子个数比例不变]
①书写原则:活泼金属氧化物·较不活泼金属氧化物·xSiO2 ·nH2O
(含同种金属不同价态时: 低价金属氧化物∙高价金属氧化物)
②各元素的化合价保持不变,各元素原子个数比例不变。
2.镁橄榄石(2MgO·SiO2)中阴离子是( )A.SiO44- B.SiO64- C.SiO32- D.SiO54-
3.《青花瓷》中所描绘的“瓶身描绘的牡丹一如你初妆”“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜。近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为+2价),下列关于硅酸铜钡的说法不正确的是( )A.可用氧化物形式表示为BaO·CuO·2SiO2B.性质稳定,不易脱色C.易溶解于强酸和强碱D.x等于6
4.仿照硅酸盐改写成氧化物的形式, 将下列物质改写成氧化物形式。
[注意: 原子个数比例不变,化合价不变]
5.已知一定条件下,Fe在Cl2中燃烧可生成Fe3Cl8,可以写出FeCl2∙2FeCl3,那么,类似地,I2和Fe在一定条件下可得到Fe3I8,则可看成 。
考点二 无机非金属材料
(1)高温结构陶瓷,如SiC、BN、Si3N4、Al2O3等。(2)碳纳米材料:富勒烯、碳纳米管、石墨烯等。(3)特殊功能的含硅材料
:铜、铁、铝等及各种合金。
[光导纤维(SiO2)]
淀粉、纤维素、蛋白质、天然橡胶等
塑料、合成纤维、合成橡胶、粘合剂、涂料等
石灰石,黏土,辅料(石膏CaSO4•2H2O)等
硅酸三钙(3CaO•SiO2) 硅酸二钙(2CaO•SiO2)铝酸三钙(3CaO•Al2O3)等
复杂的物理的、化学的变化
建筑、修路。如:水泥砂浆、混凝土、钢筋混凝土。
一.传统无机非金属材料
用途:水泥、沙子和碎石等与水混合可以得到混凝土,大量用于建筑和水利工程
纯碱(Na2CO3)、石灰石(CaCO3)、石英砂(SiO2)
原料粉碎,玻璃窑中强热,成型冷却
Na2SiO3、CaSiO3、SiO2玻璃态物质
没有固定的熔点,可在一定温度范围内软化
化性:性质稳定,但易被氢氟酸和强碱腐蚀
[或者Na2O·CaO·6SiO2]
生产中采用不同的原料和工艺,可以制得多种具有不同性能和用途的玻璃。例如,①用含有铅的原料制造的光学玻璃,透光性好,折射率高,可以用来制造眼镜、照相机和光学仪器的透镜;②加入硼酸盐制成耐化学腐蚀、耐温度急剧变化的玻璃,可用于实验室使用的玻璃仪器;③加入一些金属氧化物或盐可以得到彩色玻璃,常用于建筑和装饰。
加入金属氧化物或盐的彩色玻璃
玻璃的用途:建筑材料、光学仪器、各种器皿、 还可制造玻璃纤维用于高强度复合材料
黏土(主要成分是Al2O3·2SiO2·2H2O,铝硅酸盐)
混合→成型→干燥→烧结→冷却→陶瓷器
陶瓷的种类很多,主要分为土器、陶器、炻器、瓷器。
抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型
复杂的物理、化学变化
陶瓷的用途:建筑材料、绝缘材料、日常器皿、卫生洁具
硅酸三钙(3CaO·SiO2)硅酸二钙(2CaO·SiO2)铝酸三钙(3CaO·Al2O3)
(1)高温结构陶瓷,如SiC、BN、Si3N4、Al2O3等。(2)碳纳米材料①类型:富勒烯、碳纳米管、石墨烯等。②用途:在能源、信息、医药等领域有广阔的应用前景。(3)特殊功能的含硅材料①碳化硅SiC共价晶体,具有金刚石结构,可用作磨料。②含硅元素4%的硅钢具有导磁性。
二. 新型无机非金属材料
③光导纤维(SiO2)
高温结构陶瓷(SiC、Si3N4)
与传统陶瓷相比,在 上有很大的变化,在 等方面具有很多新的特性和功能。
碳原子和硅原子通过共价键连接
碳化硅(SiC)俗称金刚砂
碳纳米材料是近年来人们十分关注的一类新型无机非金属材料,主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广阔的应用前景。
富勒烯是由碳原子构成的一系列笼形分子的总称,其中的C60是富勒烯的代表物。C60的发现为纳米科学提供了重要的研究对象,开启了碳纳米材料研究和应用的新时代。
碳纳米管可以看成是由石墨片层卷成的管状物,具有纳米尺度的直径。碳纳米管的比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
石墨烯是只有一个碳原子直径厚度的单层石墨,其独特的结构使其电阻率低、热导率高,具有很高的强度。作为一种具有优异性能的新型材料,石墨烯在光电器件、超级电容器、电池和复合材料等方面的应用研究正在不断深入。
新型无机非金属材料——光导纤维
光导纤维成分:超纯石英玻璃(SiO2)
想一想新型无机非金属材料的成分是硅酸盐吗?提示 不一定是硅酸盐。新型无机非金属材料可能是某些元素的氧化物、氮化物、也可能是硅酸盐、磷酸盐等含氧酸盐为主要成分的无机材料。
第26讲 氨和铵盐-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第26讲 氨和铵盐-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了考点一氨,专项突破,归纳整合,NH3等内容,欢迎下载使用。
第25讲 氮及其氧化物 硝酸-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第25讲 氮及其氧化物 硝酸-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了氮族元素,内容索引,专项突破,归纳整合,迁移应用等内容,欢迎下载使用。
第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共55页。PPT课件主要包含了氧族元素,易得2e-,专项突破,归纳整合,CS2,氧化性,还原性,漂白性,迁移应用,思考与交流等内容,欢迎下载使用。












