





第20讲 氯气的实验室制法及应用-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
展开掌握实验室制取氯气的原理、装置和操作注意事项。增强设计物质制备实验方案的绿色环保意识。
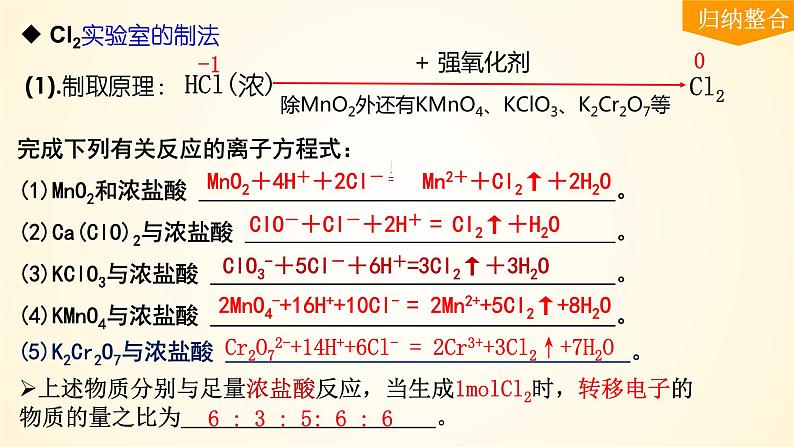
除MnO2外还有KMnO4、KClO3、K2Cr2O7等
完成下列有关反应的离子方程式:(1)MnO2和浓盐酸 。(2)Ca(ClO)2与浓盐酸 。(3)KClO3与浓盐酸 。(4)KMnO4与浓盐酸 。
2MnO4-+16H++10Cl- = 2Mn2++5Cl2↑+8H2O
ClO3-+5Cl-+6H+=3Cl2↑+3H2O
ClO-+Cl-+2H+ = Cl2↑+H2O
(5)K2Cr2O7与浓盐酸 。
Cr2O72-+14H++6Cl- = 2Cr3++3Cl2↑+7H2O
上述物质分别与足量浓盐酸反应,当生成1mlCl2时,转移电子的物质的量之比为 。
6 : 3 : 5: 6 : 6
②Ca(ClO)2 + 4HCl (浓) = CaCl2 +2Cl2 ↑ + 2H2O
ClO— + Cl— + 2H+ = Cl2↑+H2O
注意:HClO、 ClO—都有很强的氧化性
MnO4—、NO3—(H+) 、Cr2O72—、Fe3+
S2-、SO32—、I-、Fe2+、Br-
①Ca(ClO)2 + 2HCl = CaCl2 + 2HClO
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
①缓慢加热,防止HCl大量挥发;
(盐酸变稀之后就不再反应)
④参与反应的4份HCl:2份被氧化,2份做酸性
③一定要加热 ;
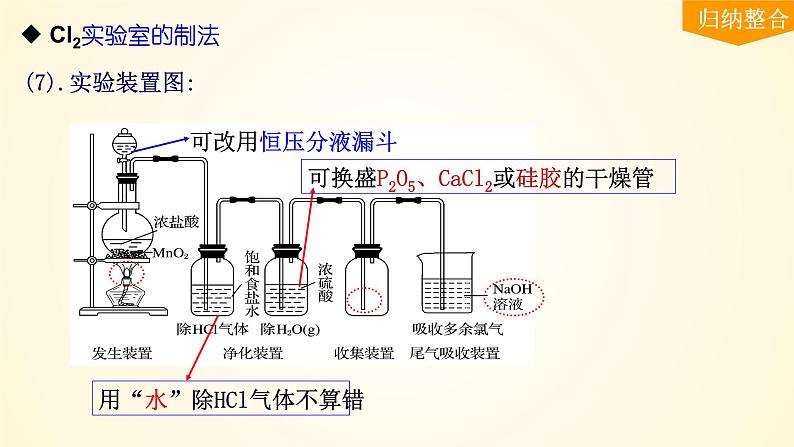
(2).实验制气装置:
除HCl气体和除H2O(g)
①用饱和食盐水除去HCl气体
→→直接用“水”也可以
②再用浓H2SO4除去水蒸气
→→→P2O5、CaCl2或硅胶均可以
向上排气法或排饱和食盐水法。
用强碱溶液(如NaOH溶液)吸收
能否用澄清石灰水吸收多余的氯气?
不可以。因为石灰水的浓度太小,吸收效果不好。
(6)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。
③湿润的淀粉KI试纸靠近盛Cl2的瓶口
②湿润的蓝色石蕊试纸靠近盛Cl2的瓶口
①根据氯气的颜色直接判断
→→ 试纸先变红后褪色
Cl2+2KI = 2KCl+I2
用“水”除HCl气体不算错
可换盛P2O5、CaCl2或硅胶的干燥管
问题:工业上是如何制备氯气的?
⑴.电解饱和食盐水(氯碱工业)
⑵.电解熔融的氯化钠(可制得金属钠)
无色有刺激性气味,极易溶于水(1:500),可作喷泉实验。
强酸性、弱氧化性(H+)、弱还原性(Cl-)
实验室制备Cl2时,若无浓HCl可用NaCl(s)+浓H2SO4代替
NaCl+ H2SO4(浓)
(与制备Cl2装置相同)
制备HBr、HI可用浓硫酸吗?
1.实验室制备氯气的装置如下图。图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( ) A. ① B. ② C. ③ D. ④
2.实验室用下列两种方法制氯气:①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气( )A.①比②多 B.②比①多 C.一样多 D.无法比较
注意:稀盐酸与MnO2不反应
3.实验室用浓盐酸和MnO2制Cl2,并以Cl2为原料制备FeCl3(FeCl3易吸水潮解),装置如下图所示。
(1)装置B、C中应盛放的试剂名称分别为________、________;
(2)实验时,先点燃A处的酒精灯,让Cl2充满装置,再点燃D处酒精灯,写出D中反应的化学方程式: 。
(3)从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是______________________。
HCl和水蒸气随Cl2进入D中能和铁反应生成H2,H2和Cl2混合受热会发生爆炸
(4)F装置所起的作用是__________________________________。
②防止空气中的水蒸气进入D、E中使FeCl3潮解
①吸收多余的Cl2,防止污染环境;
(5)用石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式: 。
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
1.含0.4 ml HCl的浓盐酸与足量的MnO2共热,能得到0.1 ml Cl2( )2.用饱和NaHCO3溶液除去Cl2中混有的HCl( )3.常用饱和石灰水吸收尾气中的Cl2( )4.用干燥的淀粉碘化钾试纸检验Cl2是否收集满( )
1.实验室用MnO2和浓盐酸制Cl2时,有如下操作:①连好装置,检查装置气密性;②缓缓加热;③加入MnO2粉末;④从装有浓盐酸的分液漏斗中加入浓盐酸;⑤将多余氯气用NaOH溶液吸收;⑥用向上排空气法收集氯气。顺序排列正确的是A.①②③④⑥⑤ B.③④②①⑥⑤C.①④③②⑥⑤ D.①③④②⑥⑤
2.下列方法中,可制得Cl2的正确组合是①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热;③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合;⑤KClO3和浓盐酸混合;⑥KMnO4和浓盐酸混合A.①②⑥ B.②④⑥C.①④⑥ D.①②③④⑤⑥
3.某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
(1)该实验中A部分的装置是___(填字母)。
(2)装置B中的现象是_____________。
2KI+Cl2=2KCl+I2
(3)请写出装置D中发生反应的离子方程式: _____________________,装置E的作用是_____________________________。
Cl2+2Fe2+=2Cl-+2Fe3+
吸收多余的Cl2,防止污染空气
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)____________________________________________________
取少量C中溶液于小试管中,加入足量稀盐酸,充分振荡后滴加BaCl2溶液,若有白色沉淀生成且沉淀不消失,则证明洗气瓶C中亚硫酸钠已被氧化
(5)制取Cl2的方法有多种,若A部分的装置是a,请再写出一种制备方法: (用化学方程式表示)。
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7+14HCl(浓)=2KCl+2CrCl3+3Cl2↑+7H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
重要含氯化合物制备探究
许多含氯化合物的制备都涉及氯气实验室制法,除考虑氯气的净化、尾气处理外,还应考虑所制取物质的特殊性质(一般题干信息中提供)。如在制取易水解的氯化物时要特别注意,排尽装置中空气,前挡后堵防水解;制取二氧化氯、次氯酸盐、亚氯酸盐时要注意控制温度等。
1. 已知FeCl3呈棕红色、易潮解,100 ℃左右时升华。某化学实验小组利用氯气与金属铁反应制备无水三氯化铁,并设计(Ⅰ)和(Ⅱ)两套不同的收集方案。
题组一 易水解无水氯化物的制备
(1)B中反应的离子方程式为____________________________________________。
(2)(Ⅰ)和(Ⅱ)中装置F的作用分别是___________________________________;___________________________________。如果选用(Ⅱ)来完成实验,则必须采取的改进措施是_____________________。
防止空气中的水蒸气进入E装置
吸收未反应完的氯气,防止污染空气
在瓶E和F之间连接装有干燥剂的装置
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去;②装置Ⅰ中充满黄绿色气体后,再加热盛有铝粉的硬质玻璃管;③装置Ⅱ是收集装置,用于收集氯化铝;④装置Ⅲ可盛放碱石灰也可盛放无水氯化钙,二者的作用相同;⑤a处使用较粗的导气管实验时更安全A.①② B.②③⑤ C.①④ D.③④⑤
2.某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔、沸点都很低(178 ℃升华),且易水解。下列说法中完全正确的一组是
①氯气能够与氢氧化钠反应,故错误;②用图示装置制取少量氯化铝,为防止铝与氧气反应,反应之前需要用氯气排尽装置中的空气,即装置Ⅰ中充满黄绿色气体后,再加热盛有铝粉的硬质玻璃管,故正确;③氯化铝熔、沸点都很低(178 ℃升华),装置Ⅱ可以用于收集氯化铝,故正确;④装置Ⅲ中盛放的物质需要能够吸收水蒸气和除去多余的氯气,因此盛放碱石灰可以达到目的,盛放无水氯化钙不能除去多余的氯气,故错误;⑤氯化铝熔、沸点都很低,a处使用较粗的导气管,不容易造成堵塞,实验时更安全,故正确。
3.常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示,下列说法不正确的是
A.实验时需后点燃E处的酒精灯B.C、D中所盛试剂分别为饱和氯化钠溶液、浓硫酸C.二氯化二硫(S2Cl2)水解反应产物为S、H2S、HClD.G、H之间应加上D装置
根据元素守恒,S2Cl2+H2O反应产物中一定有含氧元素的化合物,且元素的化合价必须有升有降.
因为装置中有空气,所以实验时应先点燃最左边酒精灯,产生氯气排出空气,再点燃E处酒精灯,故A正确;因为S2Cl2遇水易水解,所以E中应为纯净干燥的氯气与S反应,C瓶中盛饱和氯化钠溶液,吸收挥发出的HCl气体,D瓶中盛浓硫酸吸水干燥,故B正确根据元素守恒,二氯化二硫(S2Cl2)水解反应产物中一定有含氧元素的化合物,且元素的化合价必须有升有降,故C错误;因为二氯化二硫遇水易水解,所以G、H之间应加上D装置,以防止右侧水蒸气扩散进入E中,故D正确。
4.(2022·重庆模拟)便携式消毒除菌卡主要活性成分为亚氯酸钠(NaClO2),通过与空气作用释放低浓度二氧化氯(ClO2)杀菌消毒从而起到防护效果。一种制备NaClO2粗产品的工艺流程如下:
注:纯ClO2易分解爆炸,一般用空气稀释到10%以下。下列说法错误的是
题组二 有关ClO2、NaClO2等含氯氧化剂的制备
A.母液中含有的溶质有NaHSO4B.氧化性:H2O2>ClO2>ClO3-C.发生器中鼓入空气的主要目的是稀释ClO2以防爆炸D.吸收塔中温度不宜过高,否则会导致H2O2分解
制备NaClO2粗产品
发生器:NaClO3+SO2 →ClO2+Na2SO4
母液中回收的主要物质是Na2SO4,溶液呈酸性,还含有NaHSO4
A.母液中含有的溶质有NaHSO4
B.氧化性:H2O2>ClO2>ClO3-
吸收塔:ClO2+H2O2+NaOH→NaClO2+O2+H2O
氧化性:ClO3- > ClO2 > H2O2
C.发生器中鼓入空气的主要目的是稀释ClO2以防爆炸D.吸收塔中温度不宜过高,否则会导致H2O2分解
NaClO3和SO2在发生器中发生氧化还原反应生成ClO2和Na2SO4,则母液中回收的主要物质是Na2SO4,溶液呈酸性,还含有NaHSO4,故A正确;
根据信息,纯ClO2易分解爆炸,发生器中鼓入空气的主要作用是将空气中ClO2的体积分数降至安全范围,故C正确;H2O2不稳定,温度过高,H2O2容易分解,故D正确。
5.二氧化氯(ClO2)是一种黄绿色气体,沸点为11 ℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。ClO2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照如图实验装置制备ClO2并验证其某些性质。回答下列问题:
(1)实验时A装置需要控制温度为60~80 ℃,则A装置加热的方式是__________,该加热方式的优点是__________________________。
受热均匀,易控制反应温度
(2)通入氮气的主要作用有两个,一是可以起到搅拌作用, 二是_______________________________________________。
降低ClO2的浓度(或减小ClO2的体积分数),防止爆炸
(3)B装置的作用是____________________。 C装置用来吸收ClO2,则C中液体宜选用_____(填序号)。 ①热水 ②冰水 ③饱和食盐水
(4)D装置中ClO2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,D装置中生成这两种钠盐的化学方程式为__________。
2ClO2+2NaOH = NaClO2+NaClO3+H2O
→饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2·3H2O,在温度高于38℃时析出晶体NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.________;b.________;c.洗涤;d.干燥。
取少量品红溶液于试管中,通入ClO2,观察到品红溶液褪色,再加热已褪色的溶液,溶液不恢复红色
(5)设计一个简易实验证明ClO2具有永久的漂白性: 。
2.(2020·全国卷Ⅲ,26)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
(1)盛放MnO2粉末的仪器名称是__________,a中的试剂为____________。
(2)b中采用的加热方式是__________,c中化学反应的离子方程式是_________________________________,采用冰水浴冷却的目的是_______________。
Cl2+2OH- = ClO-+Cl-+H2O
(3)d的作用是______________,可选用试剂______(填标号)。 A. Na2S B. NaCl C. Ca(OH)2 D. H2SO4
解析:d是尾气处理装置,吸收氯气可以用Na2S溶液或Ca(OH)2浊液
(4)反应结束后,取出b中试管,经冷却结晶,______,__________________,干燥,得到KClO3晶体。
解析:此处用少量冷水洗涤的目的是降低KClO3的损耗。
第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共55页。PPT课件主要包含了氧族元素,易得2e-,专项突破,归纳整合,CS2,氧化性,还原性,漂白性,迁移应用,思考与交流等内容,欢迎下载使用。
第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合,生活小知识等内容,欢迎下载使用。
第12讲 钠及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第12讲 钠及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了复习目标,内容索引,专项突破,归纳整合,钠的化学性质等内容,欢迎下载使用。












