



新高考化学一轮复习精品课件 第5章 第20讲 氯气的实验室制法及应用 (含解析)
展开完成下列有关反应的离子方程式:(1)MnO2和浓盐酸: _________________________________________。(2)Ca(ClO)2与浓盐酸: ______________________________。(3)KClO3与浓盐酸: ___________________________________。(4)KMnO4与浓盐酸: _____________________________________________。
ClO-+Cl-+2H+===Cl2↑+H2O
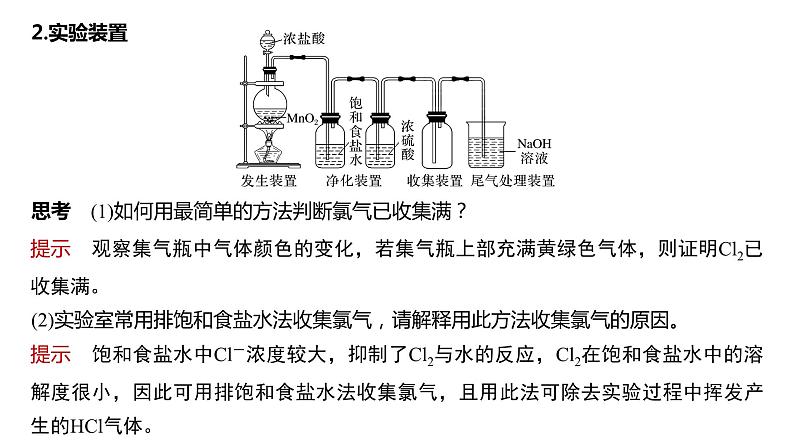
思考 (1)如何用最简单的方法判断氯气已收集满?
提示 观察集气瓶中气体颜色的变化,若集气瓶上部充满黄绿色气体,则证明Cl2已收集满。
(2)实验室常用排饱和食盐水法收集氯气,请解释用此方法收集氯气的原因。
提示 饱和食盐水中Cl-浓度较大,抑制了Cl2与水的反应,Cl2在饱和食盐水中的溶解度很小,因此可用排饱和食盐水法收集氯气,且用此法可除去实验过程中挥发产生的HCl气体。
3.注意事项(1)反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。(2)加热温度:不宜过高,以减少HCl挥发。(3)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。(4)尾气处理时,用NaOH溶液吸收Cl2,不能用澄清石灰水吸收,因为澄清石灰水中含Ca(OH)2的量少,吸收不完全。
1.含0.4 ml HCl的浓盐酸与足量的MnO2共热,能得到0.1 ml Cl2( )2.用饱和NaHCO3溶液除去Cl2中混有的HCl( )3.常用饱和石灰水吸收尾气中的Cl2( )4.用干燥的淀粉碘化钾试纸检验Cl2是否收集满( )
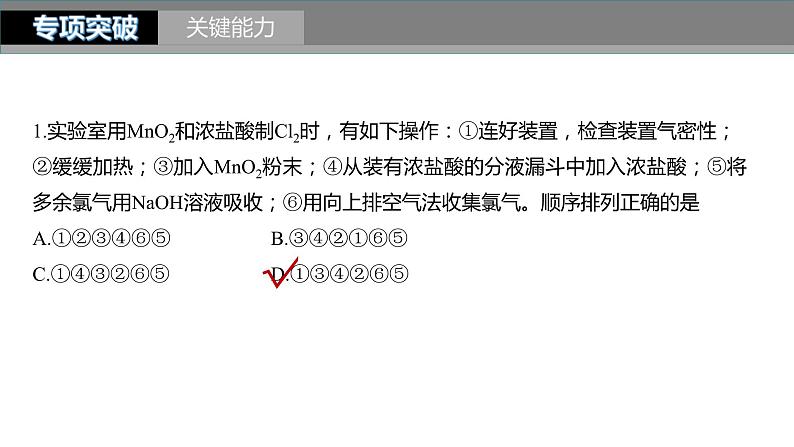
1.实验室用MnO2和浓盐酸制Cl2时,有如下操作:①连好装置,检查装置气密性;②缓缓加热;③加入MnO2粉末;④从装有浓盐酸的分液漏斗中加入浓盐酸;⑤将多余氯气用NaOH溶液吸收;⑥用向上排空气法收集氯气。顺序排列正确的是A.①②③④⑥⑤ B.③④②①⑥⑤C.①④③②⑥⑤ D.①③④②⑥⑤
制取氯气的正确操作步骤:先连接装置、检查装置气密性,然后装入药品,先向烧瓶中装入二氧化锰,再向分液漏斗中装入浓盐酸,再加热制取、收集氯气,由于氯气有毒,最后需要进行尾气吸收,故正确的排序为①③④②⑥⑤。
2.下列方法中,可制得Cl2的正确组合是①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热;③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合;⑤KClO3和浓盐酸混合;⑥KMnO4和浓盐酸混合A.①②⑥ B.②④⑥C.①④⑥ D.①②③④⑤⑥
3.某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
(1)该实验中A部分的装置是___(填字母)。
从化学方程式可知反应物是固体和液体,反应条件是加热,所以应选固液混合加热型装置。
(2)装置B中的现象是_____________。
氯气具有强氧化性,与碘化钾发生反应:2KI+Cl2===2KCl+I2,淀粉溶液遇碘变蓝色。
(3)请写出装置D中发生反应的离子方程式: _________________________,装置E的作用是_____________________________。(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):____________________________________________________________________________________________________________________________________。
Cl2+2Fe2+===2Cl-+2Fe3+
吸收多余的Cl2,防止污染空气
取少量C中溶液于小试管中,加入足量稀盐酸,充分振荡后滴加BaCl2溶液,若有白色沉淀生成且沉淀不消失,则证明洗气瓶C中亚硫酸钠已被氧化
(5)制取Cl2的方法有多种,若A部分的装置是a,请再写出一种制备方法:__________________________________________________(用化学方程式表示)。
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
1.(2022·广东,8)实验室用MnO2和浓盐酸反应生成Cl2后,按照净化、收集、性质检验及尾气处理的顺序进行实验。下列装置(“→”表示气流方向)不能达到实验目的的是
浓盐酸易挥发,制备的氯气中含有HCl,可用饱和食盐水除去HCl,Cl2可用浓硫酸干燥,故A不符合题意;氯气的密度大于空气,可用向上排空气法收集,故B不符合题意;湿润的红布条褪色,干燥的红布条不褪色,可验证干燥的氯气不具有漂白性,故C不符合题意;氯气在水中的溶解度较小,应用NaOH溶液吸收尾气,故D符合题意。
2.(2020·全国卷Ⅲ,26)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:(1)盛放MnO2粉末的仪器名称是__________,a中的试剂为____________。
由题干信息及装置图分析各装置的作用,a装置用于除杂,b装置用于制备氯酸钾,c装置用于制备次氯酸钠,d装置用于尾气处理。盛放MnO2粉末的仪器是圆底烧瓶。产生的氯气中混有氯化氢杂质,除掉氯化氢需要将气体通过饱和食盐水。
(2)b中采用的加热方式是__________,c中化学反应的离子方程式是_________________________________,采用冰水浴冷却的目的是________________。
===ClO-+Cl-+H2O
b装置的加热方式为水浴加热。c装置中氯气与氢氧化钠发生反应的离子方程式为Cl2+2OH-===ClO-+Cl-+H2O。根据b、c装置水浴温度的不同推知,生成氯酸盐时需要酒精灯加热,生成次氯酸盐时需要冰水冷却,所以c中冰水浴的目的是避免氯酸钠的生成。
(3)d的作用是______________,可选用试剂______(填标号)。A.Na2S (OH)2 D.H2SO4
d是尾气处理装置,吸收氯气可以用硫化钠溶液或氢氧化钙浊液。
(4)反应结束后,取出b中试管,经冷却结晶,________,__________________,干燥,得到KClO3晶体。
从溶液中获得纯净氯酸钾的操作是冷却结晶,过滤,少量冷水洗涤,干燥,此处用少量冷水洗涤的目的是降低氯酸钾的损耗。
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显________色。可知该条件下KClO3的氧化能力________NaClO(填“大于”或“小于”)。
碘在四氯化碳中呈紫色;碘在水中的颜色为棕色或褐色,主要由碘的浓度决定。2号试管中溶液变棕色说明生成I2,1号试管中没有颜色变化,说明没有生成I2,由此可以判断氯酸钾的氧化能力小于次氯酸钠的氧化能力。
1.实验室既可用浓盐酸与MnO2在加热条件下反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法不正确的是A.KMnO4的氧化性比MnO2的强B.制备Cl2的整个实验过程中,只需要使用氧化剂与还原剂C.用排气法收集Cl2时,不需要利用其他试剂就能确定集气瓶中已收集满D.制备等质量的Cl2,消耗MnO2与KMnO4的物质的量之比为5∶2
2.实验室中利用MnO2制备干燥的Cl2及少量氯水并收集Cl2,下列图示装置和原理不能达到实验目的的是
A.连接图1、图2装置,向分液漏斗中注水, 打开K1,关闭K2,检查装置气密性B.图1装置中,滴加浓盐酸,点燃酒精灯, 可制备Cl2C.可通过图2装置干燥并收集一定量的Cl2D.连接图1、图3装置,打开K1,点燃酒精灯,可制备少量氯水
图1装置中为恒压分液漏斗,注水后无论气密性是否良好,水都能顺利流下,不能检查装置的气密性,故A符合题意;图1装置中,浓盐酸与二氧化锰在加热的条件下反应可制备Cl2,故B不符合题意;饱和食盐水除去氯气中的HCl气体,浓硫酸干燥氯气,且氯气密度比空气的大,可通过图2装置干燥并收集一定量的Cl2,故C不符合题意;连接图1、图3装置,打开K1,点燃酒精灯,制备氯气,氯气进入水中,可制备少量氯水,故D不符合题意。
3.(2022·哈尔滨第二中学质检)某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置如图所示(可重复使用,不含制气装置)。下列说法正确的是
A.按气流流动的先后顺序,装置连接顺序依次为DACBEB.按气流流动的先后顺序,装置连接顺序依次为DABAEC.装置E的主要用途是制备NaClOD.若实验中使用到装置C且有色布条褪色,则说明湿润的氯气有漂白性
用浓盐酸与MnO2加热制取Cl2,由于盐酸具有挥发性,在Cl2中含有HCl杂质及水蒸气,先通过D装置除去HCl,再通过A装置除去水蒸气,得到干燥纯净的氯气,然后通过B验证干燥的Cl2没有漂白性,再通过C验证湿润的氯气具有漂白性,最后通过NaOH溶液进行尾气处理,故使用装置的先后顺序为DABCE,故A、B错误;装置E的主要用途是吸收多余的氯气,防止污染空气,故C错误;湿润的有色布条褪色是因为氯气与水反应生成的HClO有漂白性,故D正确。
4.(2022·长春模拟)如图是实验室制备氯气并进行相关实验的装置(夹持与加热装置已省略),下列有关说法不正确的是A.若无加热装置,则装置a蒸馏烧瓶中可用高锰酸 钾或次氯酸钠B.检验氯气是否有漂白性,则Ⅰ、Ⅱ、Ⅲ分别为湿 润的石蕊试纸、碱石灰、干燥的石蕊试纸C.装置b既可以洗气又可以作安全瓶监测装置c是否堵塞D.含有4 ml HCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4 L
高锰酸钾、次氯酸钠具有强氧化性,在不加热条件下,能与浓盐酸反应产生氯气,故A正确;氯气能与碱石灰发生反应,因此干燥氯气时不能用碱石灰,应用无水氯化钙,故B错误;饱和食盐水能吸收氯气中的HCl,b装置有长颈漏斗,还起到安全瓶的作用,可以监测后续装置是否发生堵塞,平衡气压,故C正确;含4 ml HCl的浓盐酸与足量二氧化锰发生反应,盐酸浓度降到某一浓度时反应停止,因此产生标准状况下氯气的体积小于22.4 L,故D正确。
5.某化学小组采用下图所示装置制备Cl2并探究其化学性质,下列说法错误的是
A.加入药品之前,应先检查装置的气密性B.通过对装置C和E中的产物分析,可判断温度对Cl2与碱溶液反应的影响C.装置D中的现象为溶液逐渐变成浅黄绿色D.装置B中NaOH溶液的作用为吸收挥发出来的HCl
实验时应该先检查装置的气密性然后再装药品,A正确;由图可以发现,装置C和E中温度不同,故可以通过对装置C和E中的产物分析来判断温度对Cl2与碱溶液反应的影响,B正确;装置D中通入氯气,形成氯水,故其现象为溶液逐渐变成浅黄绿色,C正确;装置B中NaOH溶液的作用是处理反应后多余的氯气,D错误。
6.实验室利用氯气与NaOH溶液反应制备NaClO溶液,下列装置和原理能达到目的的是
A.用装置甲制取并收集氯气B.用装置乙除去Cl2中的HClC.用装置丙制备NaClO溶液D.用装置丁吸收多余的Cl2
二氧化锰和浓盐酸反应需要加热,装置甲没有加热装置,A错误;应该用饱和食盐水除去Cl2中的HCl,B错误;氯气和氢氧化钠反应可以制备次氯酸钠,C正确;饱和食盐水不能吸收氯气,应该用氢氧化钠溶液来吸收多余的氯气,D错误。
7.某学习小组探究MnO2与FeCl3能否反应产生Cl2。已知FeCl3固体易升华,其蒸气为黄色。实验装置如图,下列说法不正确的是
A.加热前需要先通氮气,排尽空气,并检查装置的气密性B.加热一段时间后,装置A中产生黄色气体,说明反应生成了氯气C.从安全角度出发,在装置A、B之间应添加防止堵塞导管D.除了氯气外,升华的FeCl3、未除尽的O2都可使B中溶液变蓝
FeCl3升华后产生的气体也为黄色,B错误;FeCl3固体易升华,对于易升华的物质要注意采取安全措施,C正确;空气中的O2、Cl2、FeCl3都有氧化性,均可将KI氧化为I2,D正确。
8.(2022·山东日照模拟)实验室利用如图所示装置制备SbCl5。已知:SbCl3的沸点为220.6 ℃,易水解;SbCl5在常压下沸点约为140 ℃(同时分解),易水解,可与氢氟酸反应制备HSbF6。下列说法错误的是
A.仪器Ⅰ中的a为冷凝水的进水口B.仪器Ⅱ的主要作用是吸收Cl2和空气中的水蒸气C.SbCl5制备完成后,可减压蒸馏分离出SbCl5D.用SbCl5制备HSbF6时,可在玻璃仪器中进行
冷凝管中冷凝水应该“低进高出”,仪器Ⅰ中的a为冷凝水的进水口,故A正确;氯气有毒,污染空气,SbCl3、SbCl5易水解,仪器Ⅱ中碱石灰的主要作用是吸收Cl2和空气中的水蒸气,故B正确;SbCl5在常压下沸点约为140 ℃(同时分解),比SbCl3的低,为防止SbCl5分解,制备完成后应减压蒸馏分离出SbCl5,故C正确;SbCl5与氢氟酸反应制备HSbF6,玻璃中的二氧化硅和氢氟酸反应,故D错误。
9.实验室测盐酸与亚氯酸钠制备二氧化氯气体的速率,装置如图所示。4 mL 0.2% NaClO2溶液预先装入二氧化氯发生器,37.5% HCl溶液装入分液漏斗。开启真空泵抽气,反应开始后,每隔2 min用注射器取样1 mL,测定NaClO2溶液的浓度。已知ClO2浓度过高时易爆炸。下列说法错误的是A.碘化钾吸收瓶中发生的反应为2ClO2+ 10I-+8H+===2Cl-+5I2 +4H2OB.做实验时整套装置要先抽真空,再加入 37.5%HCl溶液,防止ClO2聚集C.分液漏斗作为空气入口,起到搅拌作用D.实验过程中分液漏斗活塞保持关闭,防止ClO2逸出
ClO2污染空气,可用酸性KI溶液吸收,A项正确;实验前先打开真空泵,再打开分液漏斗活塞,让盐酸一次性加入发生器,产生的ClO2快速被抽走,防止聚集爆炸,B项正确;实验过程中,为使真空泵工作顺畅,分液漏斗活塞应保持打开状态,空气从分液漏斗进入发生器,起到搅拌的作用,C项正确、D项错误。
10.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,下列说法错误的是
A.NaClO2的名称是亚氯酸钠B.“尾气吸收”是吸收“电解”过程排 出的少量ClO2,此反应的离子方程式 为2OH-+H2O2+2ClO2=== + O2↑+2H2OC.“电解”中阴极反应的主要产物是Cl2D.“一系列操作”为蒸发浓缩、趁热过滤、洗涤、干燥
电解装置中阴极上ClO2得电子生成 ,阳极上Cl-失电子生成Cl2 ,C错误。
11.(2022·山东枣庄模拟)已知氯气和空气按体积比1∶3混合通入潮湿的碳酸钠中能生成Cl2O,且反应放热;不含Cl2的Cl2O易与水反应生成HClO;Cl2O在42 ℃以上会分解生成Cl2和O2。设计如图装置(部分夹持装置略)制备HClO,每个虚线框表示一个装置单元,其中存在错误的是A.②③⑤ B.①④⑤C.①②④ D.①③④
①用MnO2和浓盐酸制备氯气需要加热装置,错误;②是将制备的Cl2通入饱和食盐水中除去挥发出来的HCl,同时可以控制通入氯气和空气的体积比,并在实验结束后可以将多余的氯气排出进行尾气处理,正确;③由题干信息可知,制备Cl2O的反应是放热反应,且Cl2O在42 ℃以上会分解生成Cl2和O2,则发生装置③需放置在冰水浴中,错误;④为除去Cl2O中的Cl2的装置,导管应该长进短出,错误;⑤除去Cl2的Cl2O通入⑤中进行反应,生成HClO,正确。
12.(2022·湖南岳阳一中模拟)反应2NaClO+C3H3N3O3===C3N3O3Cl2Na+NaOH+H2O可制备广谱消毒剂C3N3O3Cl2Na,装置如图所示(夹持装置已略去)。下列说法错误的是
A.按气流从左至右,装置中导管连接顺序为f→c→d→a→b→eB.升高温度有利于装置A中产品的生成C.当加入4 ml NaOH时,消耗氰尿酸(C3H3N3O3)的量大于1 mlD.装置D中橡胶管可平衡气压,便于浓盐酸顺利流下
A为制取C3N3O3Cl2Na的装置,B为除去氯气中的HCl的装置,C为尾气处理装置,D为制取氯气装置,所以为完成实验,按气流从左至右,导管连接顺序为f→c→d→a→b→e,A正确;升高温度,氯气和NaOH溶液反应生成NaClO3,生成NaClO的浓度减少,不利于装置A中产品的生成,B错误;
由反应方程式:Cl2+2NaOH===NaCl+NaClO+H2O、2NaClO+C3H3N3O3===C3N3O3Cl2Na+NaOH+H2O,可得关系式:4NaOH~2NaClO~C3H3N3O3,加入4 ml NaOH时,可消耗1 ml C3H3N3O3,由于产物也生成NaOH,则消耗氰尿酸的量大于1 ml,C正确;装置D中浓盐酸和Ca(ClO)2反应生成Cl2,由于产生气体,装置D内压强较大,使用橡胶管可平衡气压,便于浓盐酸顺利流下,D正确。
13.(2022·山西临汾模拟)亚硝酰氯(NOCl)是重要的有机合成试剂,可由NO与Cl2在常温下合成。某学习小组在实验室利用如图装置制备亚硝酰氯。
已知:①亚硝酰氯易水解,能与O2反应;②沸点:NOCl为-5.5 ℃,Cl2为-34 ℃,NO为-152 ℃;③常温下,2NO + Cl2===2NOCl、2NO2+Cl2===2NO2Cl。
请回答下列问题:(1)NOCl中N元素的化合价为________;NOCl水解生成两种酸,其化学方程式为__________________________。
NOCl+H2O===HCl+HNO2
NOCl中N的非金属性最弱,为正价,O为-2价,Cl为-1价,所以N元素的化合价为+3价;NOCl水解生成两种酸,分别为盐酸和亚硝酸,其化学方程式为NOCl+H2O===HCl+HNO2。
(2)实验所需的NO在A装置中制得,反应的离子方程式为____________________________________________。
Fe3++NO↑+H2O
(3)装置B中所盛试剂为________,其作用是__________________。
装置A中生成了NO,装置A的液面上方有空气,空气中的氧气能将NO氧化为NO2,所以装置B中装有水,可以将NO2转化为NO。
(4)实验开始时,先关闭K3,打开K2、K4,从a处通一段时间氩气,其目的是______________________________________________________。 然后在a处接废气处理装置,关闭K1、K4,打开K3,再打开分液漏斗的活塞,滴加酸性FeSO4溶液,当观察到D中________________时, 关闭K2,打开K1、K4 ,通干燥纯净的Cl2。
将E、F装置中的空气排出,防止亚硝酰氯水解和被氧气氧化
亚硝酰氯易水解,能与O2反应,实验开始时,先关闭K3,打开K2、K4,从a处通一段时间氩气,其目的是将装置E、F中的空气排出,以免生成的NOCl和空气中的水蒸气、氧气反应。 然后在a处接废气处理装置,关闭K1、K4,打开K3,再打开分液漏斗的活塞,滴加酸性FeSO4溶液,装置A产生的NO气体进入B中,混有的NO2被B中的水转化为NO,但装置B、C的液面上方有空气,NO会被氧化为NO2,装置D中的空气也能将NO氧化为NO2,所以在D中能观察到红棕色的气体,A装置中不断产生的NO将生成的NO2从K2排出,当观察到D中红棕色消失时,D中充满了纯净的NO, 此时关闭K2,打开K1、K4 ,通干燥纯净的Cl2和NO反应。
(5)为收集产物和分离未反应的两种原料, E、F装置采用不同温度的低温浴槽,其中装置E的温度(T)区间应控制在_____________________,装置F 的U形管中收集到的是_____。
-34 ℃≤T<-5.5 ℃
为收集产物NOCl和分离未反应的两种原料NO和Cl2,根据三种物质的沸点,装置E的温度应控制在-34 ℃≤T<-5.5 ℃,可收集NOCl,装置F的温度要低于-34 ℃,可将未反应的原料氯气冷凝。
14.2022年,新型冠状病毒在全球范围内肆虐,次氯酸钠溶液是常用的环境消毒剂。此外,次氯酸钠溶液也是常用的漂白剂。某研究性学习小组在实验室制备次氯酸钠溶液,测定其中NaClO的含量并探究其漂白棉布的效果。回答下列问题:
(一)制备NaClO溶液(1)装置B的作用是________________;若没有装置B,且D中氢氧化钠不足量,对次氯酸钠产率的影响是________(填“增大”“减小”或“无影响”)。
氯气难溶于饱和食盐水,装置B中饱和食盐水的作用是除去HCl气体,降低Cl2在水中的溶解度;若没有装置B除去Cl2中混有的HCl,D中氢氧化钠不足量,HCl会消耗一定量的氢氧化钠,次氯酸钠的产率减小。
(2)装置D中反应的离子方程式为__________________________________。
Cl2+2OH-===Cl-+ClO-+H2O
(3)有同学提出三点意见:①装置A中不需要酒精灯;②装置C没有必要;③在装置D后再连接一个盛有NaOH溶液的尾气处理装置,以降低氯气逸出污染空气的可能性。合理的是________(填序号)。
①反应需要加热,装置A中不用酒精灯反应难以进行,不合理;②装置C中浓硫酸用于吸收氯气中的水,没有装置C不会对实验造成影响,合理;③氯气有毒会污染环境,在装置D后接一个盛有NaOH溶液的装置,用于尾气处理,合理。
(二)测定消毒液中NaClO的含量步骤①:取制得的消毒液20 mL于锥形瓶中,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。步骤②:加入淀粉做指示剂,用Na2S2O3标准溶液滴定至终点,重复滴定操作3次。(4)步骤①中在暗处反应的原因是_______________。
步骤①中NaClO在酸性条件与KI反应生成碘单质和氯化钠,离子方程式为ClO-+2H++2I-===Cl-+I2+H2O,ClO-与H+结合形成HClO,见光易分解,所以要在暗处进行。
(5)步骤②中判断滴定终点的现象是_______________________________________,已知 。平均用去25.00 mL 0.100 0 ml·L-1 Na2S2O3标准溶液,测得NaClO的含量为________ g·L-1(结果保留2位小数)。
溶液由蓝色变为无色且30 s内不恢复
(三)探究次氯酸钠漂白棉布的效果已知:棉布用次氯酸钠漂白液漂白会受到一定损伤。织物断裂强度是指织物在被拉断时,所能承受的最大荷重,单位为kg。使用次氯酸钠漂白液漂白棉布,不同pH对于漂白的结果如图所示。
(6)漂白速率随pH减小而加快,但酸性条件易产生黄绿色气体,该气体已被实验证明没有漂白作用,说明起漂白作用的主要是________(填粒子符号);pH最好选择9~11,虽然漂白速率较慢,但可延长漂白时间达到效果。不宜选择酸性或中性的原因分别是_________________________________________________________。
酸性条件易产生氯气导致环境污染;中性条件下对棉布损伤较大
第18讲 氯气的实验室制法及应用-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第18讲 氯气的实验室制法及应用-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共34页。PPT课件主要包含了复习目标,必备知识,易错辨析,专项突破,真题演练,化学装置图的正误判断,热点强化等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第4章 第17讲 氯气的实验室制法及应用: 这是一份2024年高考化学一轮复习课件(鲁科版)第4章 第17讲 氯气的实验室制法及应用,文件包含第4章第17讲氯气的实验室制法及应用pptx、第4章第17练氯气的实验室制法及应用docx、第4章第17讲氯气的实验室制法及应用docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第5章 第20讲 氯气的实验室制法及应用: 这是一份2024年高考化学一轮复习(新高考版) 第5章 第20讲 氯气的实验室制法及应用,文件包含2024年高考化学一轮复习新高考版第5章第20讲氯气的实验室制法及应用pptx、2024年高考化学一轮复习新高考版第5章第20讲氯气的实验室制法及应用docx、第5章第20练氯气的实验室制法及应用docx、第5章第20讲氯气的实验室制法及应用docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。