初中科学华师大版九年级下册1 物质的转化第1课时教案
展开课题
物质的转化 第1课时
章
三
学科
科学
年级
九
学习
目标
知识与技能:
1.通过实验从得氧、失氧的角度来理解金属的氧化和金属氧化物的还原。
2.通过氢气还原氧化铜实验来认识其他还原物质。
3.学会利用物质之间的转化规律,寻求制取物质的方法。
过程与方法:
1.通过观察实验过程,学生提高收集信息和处理信息的能力,提高表达、交流和合作的能力
情感、态度与价值观目标:
1.学生通过知识的学习,养成从个例归纳出共性,总结出规律的科学思维,为下面的学习做准备
重点
1.从得氧、失氧的角度来理解金属的氧化和金属氧化物的还原
2.铜的氧化、氧化铜的还原
难点
1.从得氧、失氧的角度来理解金属的氧化和金属氧化物的还原
2.氧化剂、还原剂、氢气还原氧化铜实验装置的注意点及原因
教学过程
教学环节
教师活动
学生活动
设计意图
导入新课
请你仔细地观察周围的各种物质。它们是从哪里来的?又会到哪里去?在这些过程中物质之间是否发生了转化?
由一种物质转化成另一种物质,这种转化一定是化学变化。你能否运用已经学过的知识,举出日常生活中你遇到过的物质之间转化的例子,说出物质之间转化的一些规律?下面我们将进一步探究物质转化的一些重要规律。
引入新课
讲授新课
一、金属的氧化和金属氧化物的还原
1.金属的氧化
(1)金属获得氧的过程被称为金属的氧化
活动1:铜与氧化铜之间的转化。
视频:铜加热
实验步骤及现象:
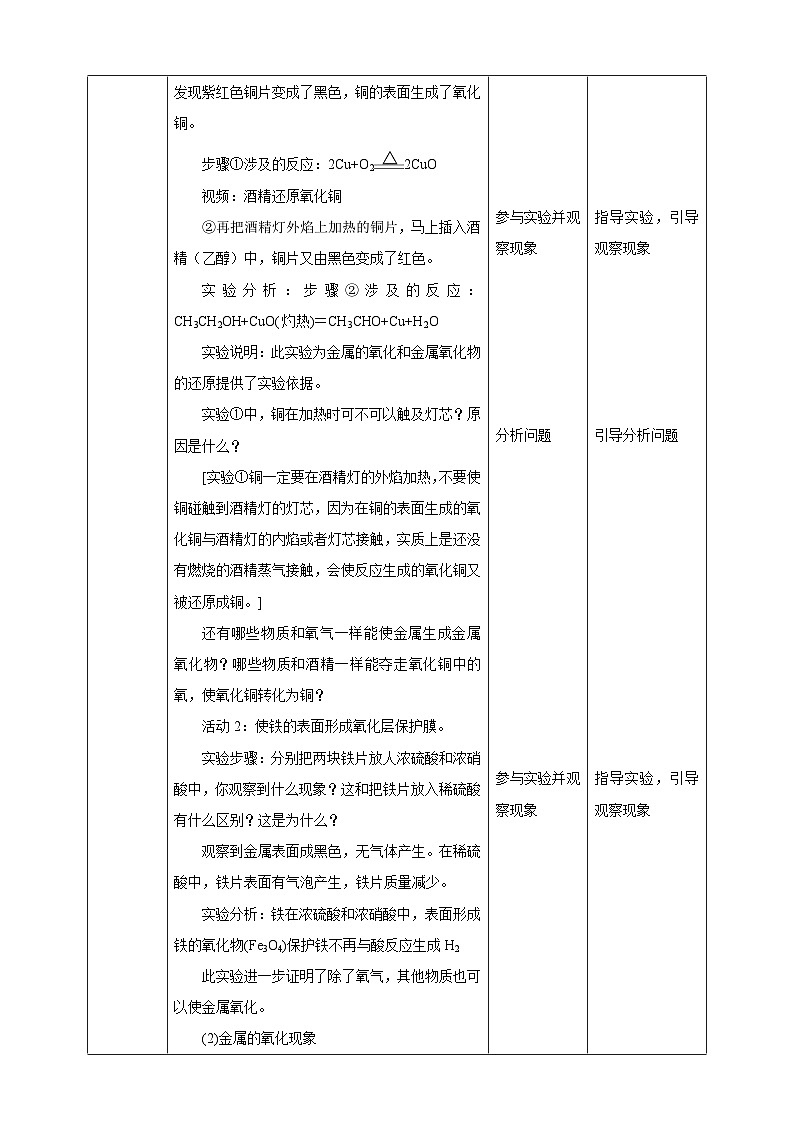
①用坩埚钳夹着铜片在酒精灯的外焰上加热,发现紫红色铜片变成了黑色,铜的表面生成了氧化铜。
步骤①涉及的反应:2Cu+O22CuO
视频:酒精还原氧化铜
②再把酒精灯外焰上加热的铜片,马上插入酒精(乙醇)中,铜片又由黑色变成了红色。
实验分析:步骤②涉及的反应:CH3CH2OH+CuO(灼热)=CH3CHO+Cu+H2O
实验说明:此实验为金属的氧化和金属氧化物的还原提供了实验依据。
实验①中,铜在加热时可不可以触及灯芯?原因是什么?
[实验①铜一定要在酒精灯的外焰加热,不要使铜碰触到酒精灯的灯芯,因为在铜的表面生成的氧化铜与酒精灯的内焰或者灯芯接触,实质上是还没有燃烧的酒精蒸气接触,会使反应生成的氧化铜又被还原成铜。]
还有哪些物质和氧气一样能使金属生成金属氧化物?哪些物质和酒精一样能夺走氧化铜中的氧,使氧化铜转化为铜?
活动2:使铁的表面形成氧化层保护膜。
实验步骤:分别把两块铁片放人浓硫酸和浓硝酸中,你观察到什么现象?这和把铁片放入稀硫酸有什么区别?这是为什么?
观察到金属表面成黑色,无气体产生。在稀硫酸中,铁片表面有气泡产生,铁片质量减少。
实验分析:铁在浓硫酸和浓硝酸中,表面形成铁的氧化物(Fe3O4)保护铁不再与酸反应生成H2
此实验进一步证明了除了氧气,其他物质也可以使金属氧化。
(2)金属的氧化现象
①绝大部分金属能在一定条件下与氧气化合生成金属氧化物,但一些不活泼金属如金、铂等很难与氧化合生成氧化物。
如a.3Fe+2O2Fe3O4
b.2Mg+O22MgO
c.4Al+3O22Al2O3
d.4Na+O2=2Na2O
②金属也能与某些能提供氧的物质(如浓硫酸和硝酸等)反应生成金属氧化物。
H2SO4(浓)+2Cu=2CuO+SO2↑+H2O
(3)金属氧化的利弊
①有利的一面:金属氧化形成了氧化膜,对金属起保护作用。如铝的金属活动性强,在空气中就能被O2氧化为氧化铝,进而保护内部的铝不再被氧化。
②不利的一面:使金属锈蚀,如铁和铜在潮湿的空气中能锈蚀为铁锈和铜锈。
在海洋钻探平台中,以锌的腐蚀来防止钢铁的腐蚀
铝制品表面有一层起保护作用的致密氧化膜
2.金属氧化物的还原
金属氧化物失去氧的过程称为金属氧化物的还原。
活动3:氢气还原氧化铜。
视频:氢气还原氧化铜
实验步骤:(1)在干燥的硬质试管里铺一薄层黑色氧化铜粉末,固定在铁架台上。
(2)将直导管伸到硬质试管底部,通人氢气一会儿,排尽空气。
(3)加热氧化铜。
(4)反应完成后,先停止加热。
(5)继续通入氢气,直到试管冷却。
[注意
(1)为使实验现象更加明显,在硬质试管中加入的氧化铜的量要少,并且要平铺以增加与氢气的接触面积。
(2)通入氢气的导管要伸到硬质试管的底部,利于排出管中的空气;硬质试管要略向下倾斜,防止反应生成的水倒流使试管炸裂。
(3)加热前先通一会儿氢气,目的是排尽试管内空气以防爆炸。
(4)停止加热,继续通氢气,是为了防止刚被还原的铜重新被氧化。]
实验现象:
(1)黑色的氧化铜变为光亮的红色;
(2)试管口有水珠生成。
有关反应的化学方程式:H2+CuOCu+H2O
实验分析:反应物中,氧化铜失去氧,是金属氧化物被还原,称为金属氧化物的还原。而氢气得到氧,被氧化,是物质的氧化,氢气使氧化铜还原,因而具有还原性。
能使金属氧化物还原为金属的物质有氢气、一氧化碳、碳、金属镁、金属铝、酒精等。一氧化碳、碳、镁还原氧化铜的化学方程式为:
CO+CuOCO2+Cu
CuO+H2Cu+H2O
C+2CuO CO2↑+2Cu
CuO+MgMgO+Cu
Fe2O3+3CO2Fe+3CO2↑
注意
“氧”与“氧气”不同,氧是指氧元素,而氧气是一种单质,氧的范围大,因而金属与氧气化合形成金属氧化物一定属于金属的氧化。
氧化还原反应规律总结
CuO+H2Cu+H2O
C+2CuO CO2↑+2Cu
Fe2O3+3CO2Fe+3CO2↑
氢气+金属氧化物→金属+水
碳+金属氧化物→金属+二氧化碳
一氧化碳+金属氧化物→金属+二氧化碳
得氧物质一一被氧化一一发生的是氧化反应。
失氧物质一一被还原—一发生的是还原反应。
3.金属的锈蚀和冶炼
(1)金属的冶炼:就是要把金属从化合态变成游离态,其实质是金属的氧化和金属氧化物的还原,方法是在高温条件下,碳、氢气、一氧化碳等还原性物质夺去金属氧化物中的氧,使金属氧化物还原成金属单质。
例如:铁矿石炼铁主要原理:
3CO+Fe2O32Fe+3CO2
(2)金属的锈蚀:其实质是金属的氧化。金属生锈是与周围环境里的水、空气等物质的作用有关。因此,常见的防锈方式有保护膜法(刷油漆、涂机油、封塑料膜、电镀)改变钢铁内部结构法(如制成不锈钢)。
(教材第58页思考与讨论)
防止锈蚀:
1.隔绝氧气(涂油、刷漆、镀其他金属,如铝可以形成致密的氧化膜)。
2.制成合金。
3.电化学保护,多用于船舶保护,连一块锌,牺牲阳极保护。
冶炼金属:
可以通过金属氧化物与还原剂反应从而获得相应的金属。
4.许多物质在一定条件下都会发生氧化反应和还原反应
(1)呼吸作用就是有机物与氧气反应,氧化生成CO2和H2O,释放能量的过程。如食物的腐败变质等。
(2)维生素C和维生素E等药品的主要功能之一就是防止人体的某些组织发生不恰当的氧化,以延缓衰老。
参与实验并观察现象
参与实验并观察现象
分析问题
参与实验并观察现象
知道金属的氧化现象
知道金属氧化的利弊
知道金属氧化物的还原
参与实验并分析各步骤的注意事项
明确实验现象
理解氧化还原反应
知道一些常见的还原反应
对氧化还原反应进行规律总结
知道金属冶炼的方法
了解金属的锈蚀及防锈方法
知道氧化反应和还原反应广泛存在
指导实验,引导观察现象
指导实验,引导观察现象
引导分析问题
指导实验,引导观察现象
介绍金属的氧化现象
分析归纳金属氧化的利弊
介绍金属氧化物的还原
指导实验,引导分析各步骤的注意事项
归纳实验现象
分析归纳氧化还原反应
介绍一些常见的还原反应
引导规律总结
介绍金属冶炼的方法
分析归纳金属的锈蚀及防锈方法
介绍氧化反应和还原反应广泛存在
课堂练习
1.下列关于氢气还原氧化铜的实验,叙述错误的是( C )
A.黑色的氧化铜粉末逐渐变成亮红色
B.试管口出现水滴
C.实验完毕应先撤氢气导管后撤酒精灯
D.看到黑色粉末完全变红后应撤掉酒精灯,使铜在氢气流中冷却
2.在反应H2+Fe3O4Fe+H2O的反应中,被还原的是( B )
A. H2 B. Fe3O4 C. Fe D. H2O
3.做氢气还原氧化铜实验,有以下几步实验操作:①加热盛有氧化铜的试管 ②通入氢气 ③撤去酒精灯 ④继续通氢气至试管冷却。以上各步操作的顺序正确的是( C )
A.①②③④ B.①②④③
C.②①③④ D.②①④③
4.现有Fe2O3和CuO的混合物W g,在高温条件下用足量的CO还原,得到金属混合物2.4g,将生成的CO2气体用足量的澄清石灰水全部吸收后,产生白色沉淀5.0g,则W的数值为( C )
A.7.4 B.4.6 C.3.2 D.3.8
5.铝的化学性质很活泼,但为什么铝制品却很耐腐蚀?为什么不宜用钢刷、沙等来擦洗铝制品?
[铝在常温下与空气中的氧气发生化学反应,使铝的表面生成了一层致密的氧化铝薄膜,从而阻止了内部的铝进一步氧化.用钢刷、沙等来擦洗铝制品,能使铝的表面生成的致密的氧化铝薄膜除掉,使内部的铝进一步氧化]
6.我国古代的钱币为什么多用金、银、铜呢?
[金、银、铜等不活泼,很难和氧化合生成氧化物]
习题训练
知识应用与理解
课堂小结
知识小结
总结概括
板书
初中科学华师大版九年级下册1 科学就是力量教学设计及反思: 这是一份初中科学华师大版九年级下册<a href="/kx/tb_c6044_t8/?tag_id=27" target="_blank">1 科学就是力量教学设计及反思</a>,共8页。教案主要包含了科学精神是维系探究的动力等内容,欢迎下载使用。
华师大版九年级下册2 生物的变异第1课时教学设计及反思: 这是一份华师大版九年级下册<a href="/kx/tb_c6036_t8/?tag_id=27" target="_blank">2 生物的变异第1课时教学设计及反思</a>,共6页。教案主要包含了变异现象,变异的类型等内容,欢迎下载使用。
华师大版九年级下册1 生物的遗传第2课时教学设计及反思: 这是一份华师大版九年级下册<a href="/kx/tb_c6035_t8/?tag_id=27" target="_blank">1 生物的遗传第2课时教学设计及反思</a>,共8页。教案主要包含了遗传是有规律的,人类遗传病,优生,人类的遗传病等内容,欢迎下载使用。