



- 1.1.3 物质的转化(教学课件) 课件 0 次下载
- 1.2.1 电解质的电离(教学课件) 课件 0 次下载
- 1.2.3 离子反应的应用(教学课件) 课件 0 次下载
- 1.3.1 氧化还原反应(教学课件) 课件 0 次下载
- 1.3.2 氧化剂与还原剂(教学课件) 课件 0 次下载
高中化学人教版 (2019)必修 第一册第二节 离子反应教学ppt课件
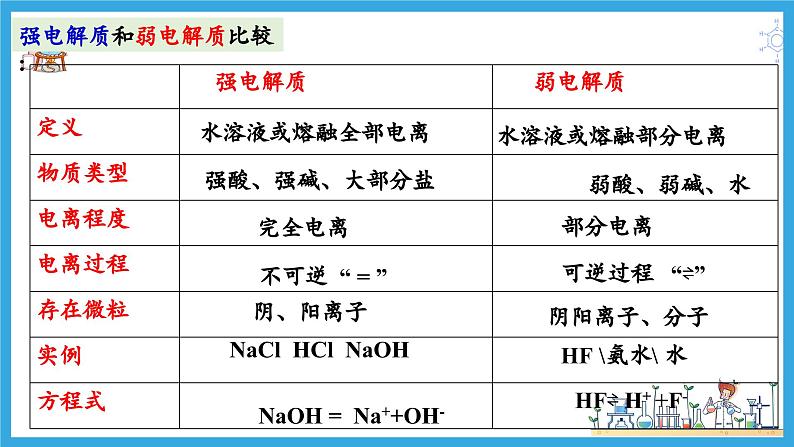
展开可逆过程 “⇌”
NaOH = Na++OH-
NaCl HCl NaOH
强电解质和弱电解质比较:
1.2 离子反应第二课时 离子反应
1.通过实验事实认识离子反应及其发生的条件,能利用电离、离子反应等概念,对常见的反应进行分类和分析说明。2.能用离子方程式正确表示典型物质的主要化学性质,初步掌握离子能否大量共存的判断方法,培养证据推理与模型认知的化学核心素养。
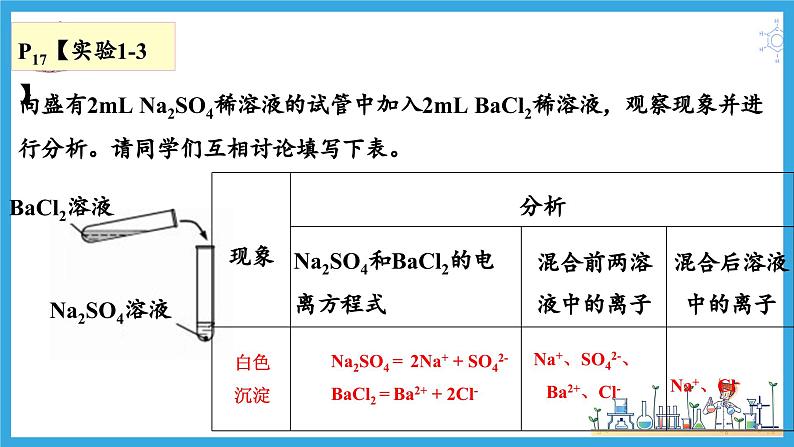
向盛有2mL Na2SO4稀溶液的试管中加入2mL BaCl2稀溶液,观察现象并进行分析。请同学们互相讨论填写下表。
Na2SO4 = 2Na+ + SO42-BaCl2 = Ba2+ + 2Cl-
Na+、SO42-、Ba2+、Cl-
Na2SO4稀溶液与 BaCl2稀溶液的反应
Ba2+、 Cl-、
BaSO4Na+、Cl-
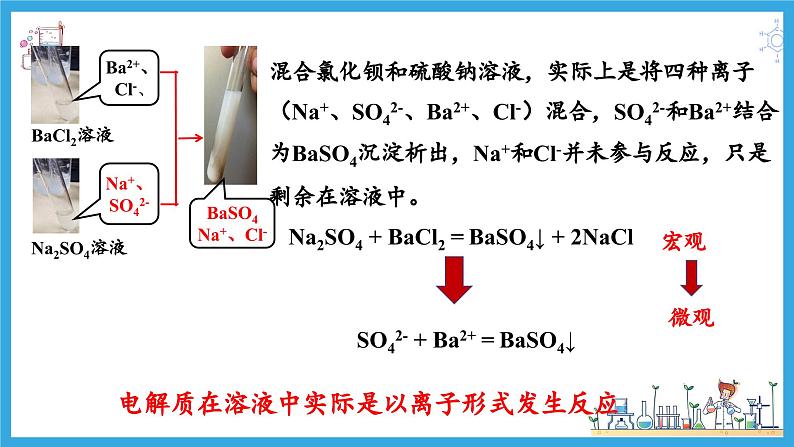
混合氯化钡和硫酸钠溶液,实际上是将四种离子(Na+、SO42-、Ba2+、Cl-)混合,SO42-和Ba2+结合为BaSO4沉淀析出,Na+和Cl-并未参与反应,只是剩余在溶液中。
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
SO42- + Ba2+ = BaSO4↓
电解质在溶液中实际是以离子形式发生反应
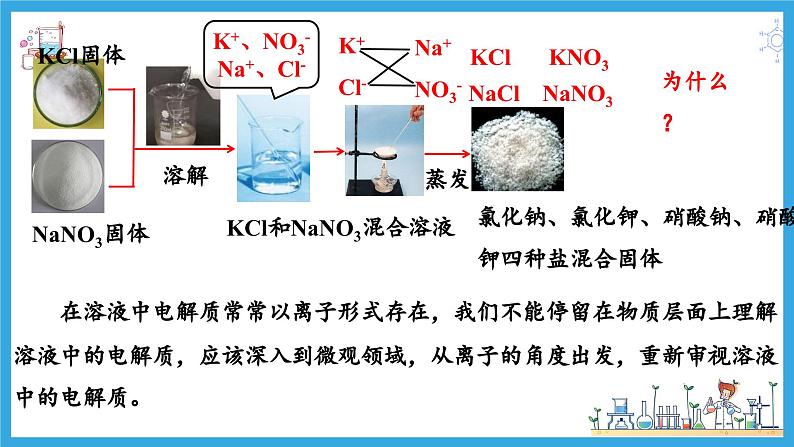
KCl和NaNO3混合溶液
氯化钠、氯化钾、硝酸钠、硝酸钾四种盐混合固体
K+、NO3-Na+、Cl-
K+ Cl-
Na+ NO3-
在溶液中电解质常常以离子形式存在,我们不能停留在物质层面上理解溶液中的电解质,应该深入到微观领域,从离子的角度出发,重新审视溶液中的电解质。
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
生成沉淀、气体挥发性物质
离子反应除了复分解型外,还有其他类型,如有离子参加的置换反应等,这些类型的离子反应发生条件与复分解型不同。
(1)从微观角度,酸、碱、盐在水溶液中发生的复分解反应,实质上是两种电解质在溶液中 的反应。
(2)离子反应使溶液中某些离子的浓度 。
例1:下列实验中,能发生离子反应的是A.氢气还原氧化铜 B.Na2SO4溶液与KCl溶液混合C.降低饱和KNO3溶液的温度 D.KOH溶液与CuSO4溶液混合
你还记得中和反应的实质是什么?
【过渡】能代表所有中和反应吗?若能的话说出理由?若不能话举出反例。
用实际参加反应的离子符号表示离子反应的式子
例如:BaCl2 与Na2SO4反应
2、离子方程式的书写步骤
(1)写出化学方程式:
(2)把易溶于水、易电离的电解质拆成离子的形式
以客观事实为依据写出反应的化学方程式
BaCl2+Na2SO4 = BaSO4↓+2NaCl
可以拆的电解质:强酸、强碱、可溶于水的盐(写成离子形式)弱酸、弱碱、单质、气体、氧化物、沉淀以及水等仍用化学式表示。
2Na++SO42-+Ba2++2Cl- = BaSO4↓+2Na++2Cl-
(3)删去方程式两边形式相同的离子:
(4)整理方程式并检查两边各元素的原子个数和电荷总数是否相等
小结:一写、二拆、三删、四整理、五整理
SO42-+Ba2+ = BaSO4↓
(4)查:检查离子方程式两边各元素的原子个数和电荷总数是否相等以及反应条件、沉淀符号、气体符号等。
3、特别提醒-物质的溶解性
①盐的溶解性:钾、钠、铵盐、硝酸盐,均能溶于水中见;盐酸盐不溶氯化银;硫酸盐不溶钡和铅碳酸盐只溶钾、钠、铵;OH-中只溶钾、钠、铵、钡、钙。
PbSO4、BaSO4不可拆
亚硫酸盐与碳酸盐溶解性相似
只有NaOH、KOH、Ca(OH)2、Ba(OH)2
②对微溶物,如Ca(OH)2,如果反应物为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物、石灰乳、石灰浆等,则保留化学式Ca(OH)2(不拆)。
③物质“拆分”原则: 物质在离子方程式中“拆”与“不拆”,关键看该物质在溶液中的存在形式。如CaCO3难溶于水,在溶液中以CaCO3固体的形式存在,故CaCO3写成化学式。
Ca(OH)2、Ag2SO4、CaSO4、MgCO3、
【例2】写出下列反应的化学方程式和离子方程式:
HCl+NaOH = NaCl+H2O
H++OH- = H2O
HCl+KOH = KCl+H2O
H2SO4+2NaOH=Na2SO4+2H2O
强酸电离出的H+和强碱电离出的OH-结合生成水
根据上表,分析说明离子方程式不仅可以表示 的化学反应,还可以表示 的离子反应。
【例3】 (1)H2SO4溶液与Ba(OH)2溶液反应的离子方程式:_____ ;NaHSO4溶液与KOH溶液反应的离子方程式: 。(2)判断正误①酸碱中和反应的离子方程式都是H++OH-=H2O ( )②H++OH-===H2O仅表示强酸与强碱的中和反应 ( )
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
例4:(2022·广东惠州高一上期末)下列离子方程式正确的是A.用小苏打治疗胃酸过多: +2H+===CO2↑+H2OB.氢氧化钡溶液与稀硫酸反应:Ba2++ ===BaSO4↓C.铜片插入硝酸银溶液:Cu+Ag+===Cu2++AgD.稀盐酸与石灰石反应:CaCO3+2H+===Ca2++H2O+CO2↑
温馨提示:掌握离子方程式正误判断的方法
1.依据现有知识分析判断,下列选项中不满足离子反应发生条件的是A.NaOH+KCl = NaCl+KOHB.AgNO3+HCl = AgCl↓+HNO3C.Na2CO3+Ca(OH)2 = 2NaOH+CaCO3↓D.BaCO3+2HNO3 = Ba(NO3)2+H2O+CO2↑
2.甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录如下:
其中记录合理的是A.甲 B.乙 C.丙 D.丁
3.下列离子方程式正确的是( )
A.铜与硝酸银溶液反应:Cu+Ag+ = Cu2++AgB.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+= BaSO4↓C.石灰乳与盐酸反应:H++OH- = H2OD.碳酸镁与稀硫酸反应:MgCO3+2H+ = Mg2++CO2↑+H2O
4.下表中对离子方程式的评价合理的是
5.(2023·无锡质检)离子方程式与化学方程式的本质区别在于化学方程式表示的是一个具体的化学反应,而离子方程式还可以表示同一类型的离子反应。从这个角度讲,可用离子方程式 2H+ + CO32- =H2O+CO2↑表示的反应是A.碳酸盐与盐酸反应B.可溶性碳酸盐与稀硫酸反应C.二氧化碳与酸溶液反应D.盐酸与可溶性银盐溶液反应
人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应教学ppt课件: 这是一份人教版 (2019)必修 第一册第一章 物质及其变化第二节 离子反应教学ppt课件,文件包含第1课时初步认识比热容pptx、加热水和煤油mp4、比较水沙石的比热容mp4、比较金属的比热熔冰mp4、水和煤油的吸热能力对比mp4、水和煤油的吸热能力对比swf等6份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应课文配套课件ppt: 这是一份人教版 (2019)必修 第一册第二节 离子反应课文配套课件ppt,共23页。PPT课件主要包含了为什么,什么是复分解反应,不符合反应事实,不该拆的拆了,澄清石灰水应该拆,氧化物不该拆,电荷不守恒,漏了一些离子的反应等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应课堂教学课件ppt: 这是一份人教版 (2019)必修 第一册第二节 离子反应课堂教学课件ppt,共20页。PPT课件主要包含了实验1-3,离子反应,判断依据,发生的条件,1沉淀,2气体,4氧化还原反应,离子方程式,电解质在溶液中的反应,氢氧化铜溶于盐酸等内容,欢迎下载使用。













