






高教版(2021)农林牧渔类第二节 常见金属单质及其化合物公开课ppt课件
展开1.能从原子的结构和组成出发,初步
【学习目标】 1.通过辨识钠、铝、铁的原子结构,认识钠、铝、铁的金属性。能从微观角度出发,立足物质类别通性,掌握单质及其化合物的性质及应用,逐步建立“元素观”,形成研究物质性质的一般思路。2. 通过观察实验现象认识金属钠的活泼性等,理解化学实验规范操作的重要性,增强安全意识,发展认知规律和总结规律的能力。3.通过实践活动了解侯德榜制碱法等化学史实,感受学科榜样的力量,树立崇尚科学的精神,提升民族自豪感和爱国主义情怀。
防毒面具是如何为我们提供氧气的?
主题四·常见无机物及其应用
4.1常见非金属单质及其化合物
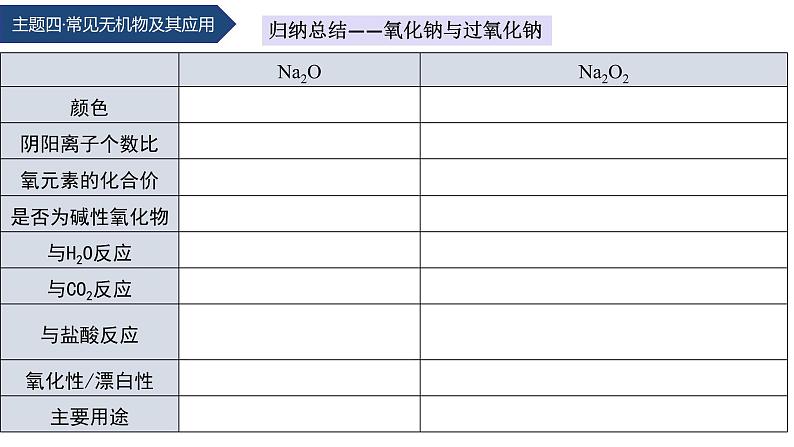
1. 物理性质:氧化钠是一种白色固体。2. 化学性质:氧化钠是碱性氧化物,具有碱性氧化物的通性,如能与水、酸、酸性氧化物等反应。(1)与水反应:__________________________________(2)与盐酸反应:________________________________(3)与CO2反应:________________________________
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
1. 物理性质:过氧化钠是一种_______色固体。2. 化学性质:Na2O2不是碱性氧化物,但能与水、酸、酸性氧化物等发生反应,具有强氧化性。
(1)与水反应:_________________ ___________(2)与盐酸反应:______ ______________ ______(3)与CO2反应:____________________ _______
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+4HCl===4NaCl+2H2O+O2↑
2Na2O2+2CO2===2Na2CO3+O2↑
防毒面具的填料中含有过氧化钠,因此,Na2O2 常用作氧化剂、漂白剂、氧气发生剂,还可用作防毒面具的填料,在高空飞行及潜水作业时可作为氧气的来源。
(a)防毒面具 (b) 潜水作业
归纳总结——氧化钠与过氧化钠
常温下为白色半透明结晶状固体,NaOH极易溶于水。
NaOH极易溶于水,同时放出大量的热,较浓的氢氧化钠溶液溅到皮肤上,会腐蚀表皮,造成烧伤,因此,NaOH又称烧碱、火碱、苛性钠。NaOH溶液呈强碱性,具备碱的一切通性。
NaOH 应用十分广泛,是实验室的常用试剂。NaOH 固体或浓溶液一般使用塑料容器贮存。如果用玻璃容器贮存,要用橡胶塞而不使用玻璃瓶塞。
因为NaOH 能与玻璃的主要成分SiO2 反应,化学反应方程式如下 : 2NaOH + SiO2=Na2SiO3 (硅酸钠)+ H2O 生成的硅酸钠具有黏性,可将玻璃瓶塞与瓶口黏在一起。
易溶于水 ,得无色溶液
化学式:
(一)碳酸氢钠的物理性质
实验一:向Na2CO3 、NaHCO3 溶液中滴加酚酞试剂
思考:通过滴加酚酞的对比实验,能说明一个什么问题?
推测:它们都能与什么物质反应?
实验二:分别向两支试管中滴加稀盐酸,振荡,观察现象
Na2CO3和NaHCO3都能和盐酸反应,产生二氧化碳气体,NaHCO3与盐酸的反应比Na2CO3与盐酸的反应要剧烈
Na2CO3+ 2HCl =2NaCl + H2O + CO2↑ NaHCO3+ HCl= NaCl + H2O + CO2↑
实验三:碳酸钠与碳酸氢钠的热稳定性比较
治疗胃酸过多的一种药剂
铝的氧化物只有氧化铝(Al2O3)。
Al2O3是一种不溶于水的白色粉末,熔点高达2050℃,硬度也很高。天然纯净的Al2O3是无色的,俗称刚玉,其硬度仅次于金刚石,因混有少量其他氧化物而呈现不同的颜色。通常所说的红宝石和蓝宝石的主要成分都是Al2O3,红色的称为红宝石,其他颜色的统称为蓝宝石。
Al2O3耐高温、高强度的性能,使其成为一种比较好的耐火材料,常被用来制成耐火砖、坩埚、砂轮、研磨纸或研磨石等。 工业上将在高温电炉中烧结制成的Al2O3,称为人造刚玉,不但可用作装饰品,还可用来制作精密机械或钟表中的轴承,广泛应用在冶金、机械、化工、电子、航空和国防等众多领域。
Al2O3难溶于水,也不与水发生反应,但新制的Al2O3既能与酸反应,也能与碱反应,都生成盐和水。
Al2O3+ 6HCl = 2AlCl3+ 3H2OAl2O3+ 2NaOH =2NaAlO2(偏铝酸钠)+ H2O
Al2O3与盐酸的反应中表现出碱性氧化物的性质,而与氢氧化钠的反应中,则表现出酸性氧化物的性质。因此,Al2O3是一种两性氧化物。
铝的氢氧化物只有氢氧化铝[Al(OH)3]。
①向盛有10 mL 0.5 ml/L硫酸铝[Al2(SO4)3]溶液的试管中,逐滴加入氨水至过量,观察现象;②将上述反应所得白色难溶物,分装在2 支试管中,向一支试管中滴加 2 ml/L HCl溶液,向另一支试管中滴加2 ml/L NaOH 溶液,振荡,观察现象。
实验现象:从实验可以看到向硫酸铝溶液中加入氨水至过量,有白色难溶物生成,这种白色难溶物在酸或强碱溶液里都能溶解。
探究结果:Al2(SO4)3与氨水反应生成Al(OH)3,Al(OH)3是一种白色难溶的胶状物质,且不溶于过量的氨水,反应方程式如下: Al2(SO4)3+6NH3·H2O =2Al(OH)3↓+3(NH4)2SO4
Al(OH)3是制造铝盐、瓷釉耐火材料的原料,是用量最大的无机阻燃添加剂,其作为阻燃剂不仅能阻燃还能防止发烟,减少有毒气体的生成。 Al(OH)3是一种白色难溶的胶状物质,能凝聚水中的悬浮物,又有吸附色素的性能,可用于制造吸附剂、净水剂、离子交换剂等。 Al(OH)3碱性不强,在医药上是一种良好的抗酸剂,用于治疗消化道溃疡和胃酸过多症等。
铁的氧化物有三种,分别是氧化亚铁(FeO)、氧化铁(Fe2O3)、四氧化三铁(Fe3O4)。
观察下图中铁的三种氧化物的颜色状态,认识它们的性质和用途。
(a)氧化亚铁 (b)氧化铁 (c)四氧化三铁
铁的氧化物都不溶于水,也不与水发生反应。FeO和Fe2O3都能与稀盐酸、稀硫酸发生反应,生成相应的亚铁盐或铁盐。离子反应方程式如下:FeO+ 2H+= Fe2++ H2OFe2O3+ 6H+= 2Fe3++ 3H2O
铁有两种氢氧化物,分别是氢氧化亚铁[Fe(OH)2]和氢氧化铁[Fe(OH)3]。
FeSO4溶液与NaOH溶液
Fe2++2OH===Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O===4Fe(OH)3(红褐色)
2、白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
先有白色沉淀生成,在空气中迅速变成灰绿色,最后变成红褐色。
Fe(OH)3是红褐色沉淀,可在铁盐的溶液中滴加碱制得。Fe(OH)3受热易分解,生成红棕色的Fe2O3粉末,反应方程式如下:2Fe(OH)3 Fe2O3+ 3H2O Fe(OH)2和Fe(OH)3都是不溶性的弱碱,都能与酸反应分别生成亚铁盐和铁盐,反应离子方程式如下:Fe(OH)2+ 2H+= Fe2++ 2H2OFe(OH)3+ 3H+= Fe3++ 3H2O
常见的铁盐有亚铁盐和铁盐两种,如硫酸亚铁(FeSO4)和氯化铁(FeCl3)等。
FeSO4通常是以晶体形式存在,呈淡绿色,俗称绿矾(FeSO4·7H2O),晶体失去结晶水后变为无水FeSO4(白色粉末)。
FeSO4易溶于水,水溶液因发生水解而显酸性,因此配制和保存FeSO4溶液时要加入一定量的稀硫酸抑制水解。
FeSO4不稳定,在潮湿的空气中能逐渐被氧化而变成黄棕色,反应方程式如下:4FeSO4+ O2+ 2H2O = 4Fe(OH)SO4(碱式硫酸铁)
FeSO4容易被动物体吸收,在医药上常制成补血剂,用于治疗缺铁性贫血病。在农业上,FeSO4是一种微量元素肥料也是一种杀菌剂,施用FeSO4可防治苹果的花叶病。
氯化铁(FeCl3·6H2O)是棕黄色固体,在空气中易潮解,易溶于水。
氯化铁在水溶液中易水解生成氢氧化铁,其水溶液呈酸性,水解方程式如下:FeCl3+ 3H2O ⇌Fe(OH)3 + 3HCl
为了防止水解,在配制氯化铁溶液时,应先将氯化铁固体溶解于少量盐酸中,再进行稀释,溶液配好后也要使溶液保持酸性
二价铁的化合物,在较强的氧化剂的作用下,会被氧化成三价铁的化合物。
例如,FeCl2溶液遇氯水会被氧化生成FeCl3,反应方程式如下:2FeCl2+ Cl2=2FeCl3
Fe3+有一定的氧化性,能与较强的还原性物质反应。
例如:2FeCl3+ H2S =2FeCl2 +2HCl +S↓2FeCl3+ Fe =3FeCl22FeCl3+ Cu=2FeCl2+ CuCl2
在蔬菜生长过程中,常喷洒农药来防治病虫害。据有关专家介绍,用碱性溶液或清水浸泡,可使残留在蔬菜上农药的毒性降低。因此,买来的蔬菜在食用前最好用稀碱水或清水浸泡一段时间。厨房里有纯碱、白糖、白酒、食醋等日常生活用品,可在水中加入适量的什么物质来浸泡蔬菜,为什么?
答:加入适量纯碱。因为用碱性溶液或水浸泡,可使残留在蔬菜上的农药毒性降低。
化学农林牧渔类第二节 常见金属单质及其化合物公开课ppt课件: 这是一份化学农林牧渔类第二节 常见金属单质及其化合物公开课ppt课件,共42页。PPT课件主要包含了学习目标与核心素养,主要内容,金属的通性,常见金属单质,物理性质,化学性质,钠Na,实验探究,②化学性质,钠的密度比水小等内容,欢迎下载使用。
高教版(2021)农林牧渔类第一节 常见非金属单质及其化合物优秀课件ppt: 这是一份高教版(2021)农林牧渔类第一节 常见非金属单质及其化合物优秀课件ppt,共42页。PPT课件主要包含了学习目标与核心素养,主要内容,课堂小结等内容,欢迎下载使用。
中职化学高教版(2021)农林牧渔类第一节 常见非金属单质及其化合物优秀ppt课件: 这是一份中职化学高教版(2021)农林牧渔类第一节 常见非金属单质及其化合物优秀ppt课件,共35页。PPT课件主要包含了学习目标与核心素养,主要内容,硫的存在方式,物理性质,硫化亚铁,硫化亚铜,硫化氢,课堂小结等内容,欢迎下载使用。












