资料中包含下列文件,点击文件名可预览资料内容



还剩52页未读,
继续阅读
【核心素养目标】粤教版初中化学九年级下册8.2《 常见的酸和碱》课件+教案(含教学反思)
展开
这是一份【核心素养目标】粤教版初中化学九年级下册8.2《 常见的酸和碱》课件+教案(含教学反思),文件包含粤教版初中化学九年级下册82《常见的酸和碱》pptx、核心素养目标粤教版初中化学九年级下册《82常见的酸和碱》教学设计docx等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
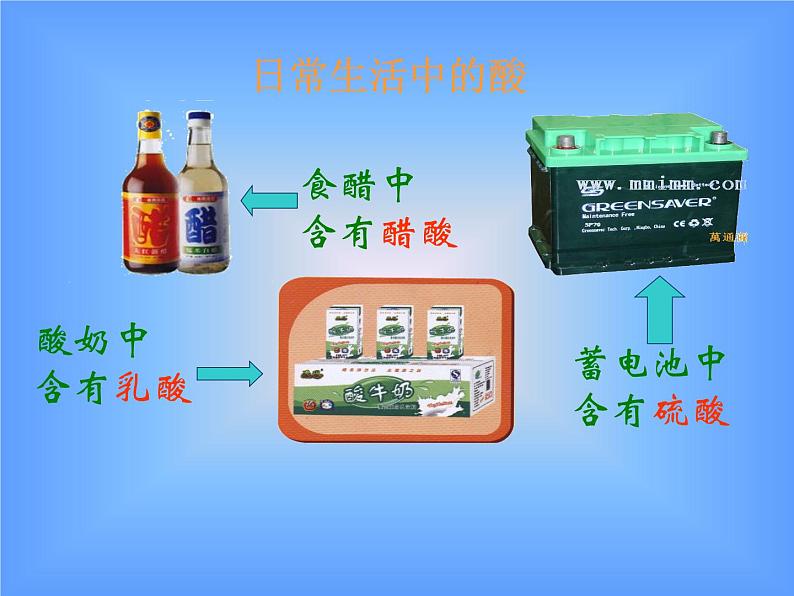
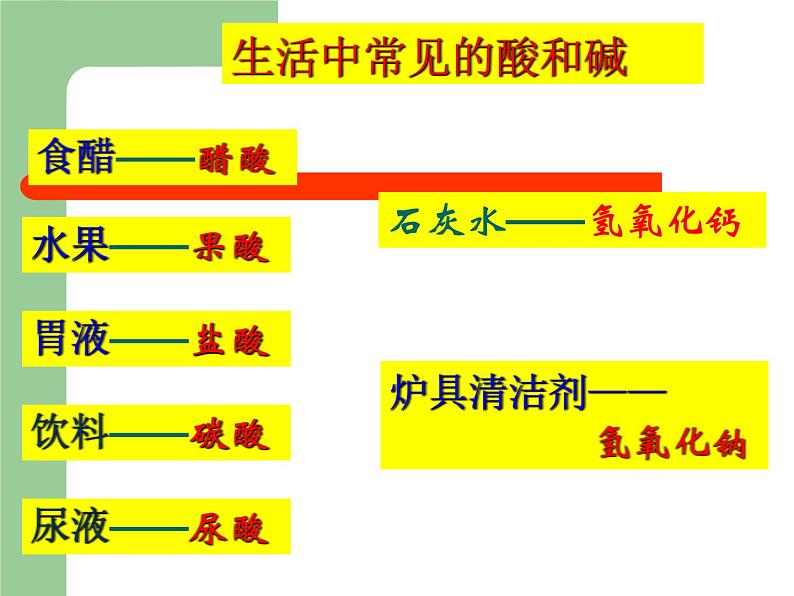
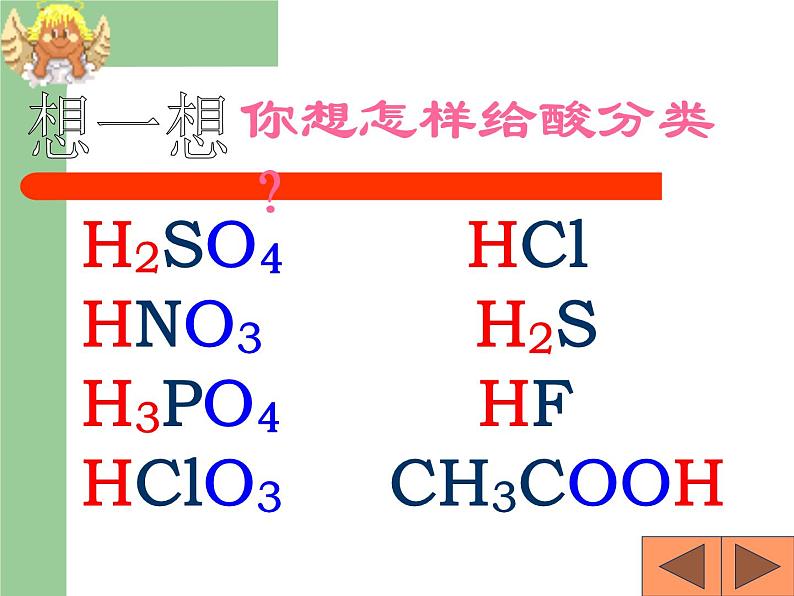
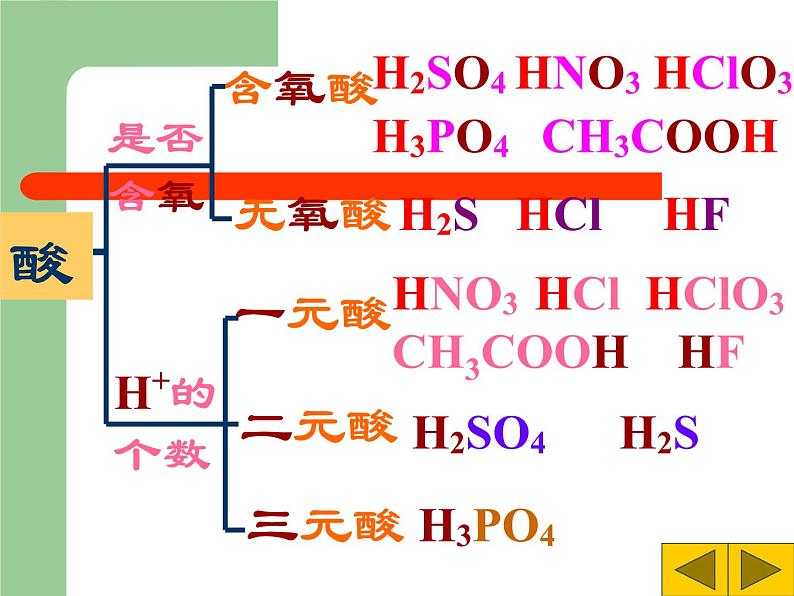
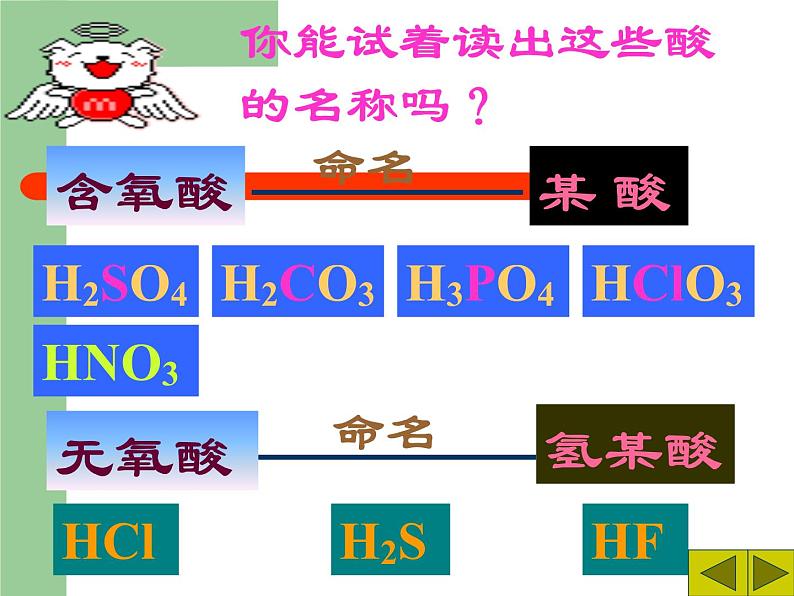
8.2 常见的酸和碱科粤版 九年级化学 下册日常生活中的酸酸奶中含有乳酸生活中常见的酸和碱食醋——醋酸水果——果酸胃液——盐酸饮料——碳酸石灰水——氢氧化钙炉具清洁剂—— 氢氧化钠尿液——尿酸1、人的胃液里含有盐酸(HCl);2、汽车电瓶里含有硫酸(H2SO4);3、食醋里含有醋酸,也叫乙酸;4、酸雨里含有亚硫酸(H2SO3),也可能含有硝酸(HNO3)。酸:组成特点:H+ + 酸根定义:在溶液中电离时阳离子全部是氢离子且能使紫色石蕊试液变红的化合物H2SO4 HCl HNO3 H2S H3PO4 HF HClO3 CH3COOH你想怎样给酸分类?想一想是否含氧含氧酸无氧酸H+的个数一元酸二元酸三元酸H2SO4 HNO3 HClO3 H3PO4 CH3COOH H2S HCl HFHNO3 HCl HClO3 CH3COOH HF H2SO4 H2S H3PO4酸你能试着读出这些酸的名称吗?H2SO4H2CO3H3PO4HClO3HNO3某 酸HClH2SHF氢某酸无氧酸含氧酸命名命名硝酸盐酸硫酸 常见的酸盐酸,即氢氯酸,无色液体,易挥发,有刺激性气味; (瓶口有白雾)硫酸,无色油状液体,强腐蚀性,密度较大(1.84g/cm3);硝酸,无色液体,强腐蚀性,有特殊刺激性气味。 (瓶口有白雾) ③浓硫酸的腐蚀性1.浓硫酸的特性 【实验8-5】 能夺取纸张、木材、棉布、 皮肤(由含C、H、O等元素的化合物组成)里的水分,生成黑色的炭。①浓硫酸的脱水性②浓硫酸的吸水性-----做干燥剂脱水性吸水性腐蚀性稀释浓硫酸时,一定 要把浓硫酸沿容器壁 慢慢注入水里,并不 断搅拌。切不可将水 倒进浓硫酸里 浓硫酸的稀释【实验8-6】化学晚会上小豆把一张白纸的正反两面向大家展示清楚,然后把白纸用电吹风的热风吹片刻,不一会,白纸上出现了一只小黑猫,大家惊奇不已.你知道这是怎么回事吗?请你用学过的化学知识来解释:(1)小豆事先用 ________画了一只猫;(2)使白纸出现黑猫的物质是_______;表现该物质具有______性。稀硫酸浓硫酸脱水稀酸的化学性质 1、在碳酸溶液中,紫色石蕊溶液由 色变成了 色。2、稀硫酸跟锌可发生什么反应?3、盐酸跟碳酸钙能发生反应吗? 紫红H2SO4 + Zn= H2 ↑ + ZnSO42HCl + CaCO3 =CaCl2 + H2O + CO2 ↑知识回顾1、酸与指示剂的作用使紫色的石蕊溶液变红色,但不能使无色的酚酞溶液变色。这是稀酸的化学通性之一。2、酸与金属的反应(1)回顾:较活泼金属(如铁)跟稀硫酸的置换反应: Fe + H2SO4 = FeSO4 + H2 ↑ (金属) (酸) (盐) (氢气) FeSO4这类由 金属离子 和 酸 根离子 组成的化合物通称为盐。 FeSO4Fe 2+SO4 2-+(金属离子)(酸根离子)CuSO4、CaCO3、NaCl、KNO3等均属于盐。 酸与金属的反应拓展:镁或锌与稀盐酸的反应。【实验8-7】现象: 在金属表面产生气泡(生成气体)。 化学方程式: Mg + 2HCl = MgCl2 + H2 ↑ Zn + 2HCl = ZnCl2 + H2 ↑ (金属) (酸) (盐) (氢气) 结论: 性质2 酸能跟较活泼金属(如镁、铝、锌和铁) 发生置换反应,放出氢气,并生成盐。 硝酸性质较特殊它与金属反应时,一般不生成氢气,而是氮氧化物请写出镁、铝、锌、铁分别与稀硫酸的反应。Mg + H2SO4 === MgSO4 + H2↑2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑Zn + H2SO4 === ZnSO4 + H2↑Fe + H2SO4 === FeSO4 + H2↑浅绿色3、酸跟金属氧化物的反应实验:【实验8-8】在试管中,加入少量氧化铜粉末,再加入约2ml稀硫酸,在酒精灯上加热,不停振荡,观察变化现象。 现象: 黑色粉末逐渐减少,无色溶液变蓝色。化学方程式: CuO + H2SO4 = Cu SO4 + H2O(金属氧化物)(酸) (盐) (水) 酸跟金属氧化物的反应实验(2) 把生锈的铁钉浸入盛有稀盐酸溶液的试管中,过一段时间后,取出,洗净,并观察它的变化。 现象: 铁锈消失,同时无色溶液变黄色。 化学方程式: Fe2O3 + 6HCl = 2FeCl3 + 3H2O (金属氧化物) (酸) (盐) (水) 结论: 性质3:酸能跟某些金属氧化物反应,生成盐和水 4、酸跟盐的反应 拓展:将稀盐酸与硝酸银进行实验 [实验8-9]现象: 生成白色沉淀(此实验常用于检验Cl- 阅读 P231)。化学方程式:HCl + AgNO3 = AgCl ↓ + HNO3 (酸) (盐) (新盐) (新酸)结论:性质4:酸能跟某些盐反应,生成其他酸和盐。 2HCl + CaCO3 = CaCl2 + H2O+CO2 ↑2HCl + CaCO3 = CaCl2 + H2CO3 ∟ H2O+CO2 ↑回顾:实验室制备二氧化碳的化学反应:(酸) (盐) (新盐) (新酸)长话短说——酸的化学通性检查站1、写出下列反应的化学方程式:(1)硫酸跟氧化镁反应,生成硫酸镁和水 (2)硫酸跟氯化钡反应,生成硫酸钡和盐酸。 (3)稀硫酸跟锌反应,生成硫酸锌和氢气。 H2SO4 + MgO = MgSO4 + H2OH2SO4 + BaCl2 = BaSO4 ↓+ 2HClH2SO4 +Zn = ZnSO4 + H2↑2、举例说明以下转变关系(参照上题,把题号填在下面的括号内):1、H2SO4 + MgO = MgSO4 + H2O2、H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl3、H2SO4 +Zn = ZnSO4 + H2↑132 实验室内常用的碱 碱性的日常用品 1.请你说出你所知道的碱还有哪些?他们有哪些用途你知道吗?请阅读课本232了解常见的碱的用途。 2.阅读课本232页了解生石灰与熟石灰,了解它们是如何制得。 常见三种碱的常见用途碱:电离后阴离子全部是氢氧根例子的化合物。氢氧化钙的物理性质及用途1.氢氧化钙的俗名叫熟石灰, (白色固体,微溶于水)用来 石灰水,就是它的水溶液。2.在生产中,人们大量用熟石灰作 。 检验二氧化碳的 建筑材料和改良土壤 氧化钙还可通过与水反应来产生大量的热,常用于自动加温包装。虎门销烟时,当时林则徐一为防止废气,二为避免鸦片污染土壤,就采用向水中加入鸦片和氧化钙的方法来分解鸦片。 二、氢氧化钙 [ Ca(OH)2 ] 在检验二氧化碳时用到的石灰水就是氢氧化钙的水溶液。产生大量的热(生石灰) (熟石灰) 氧化钙 氢氧化钙 (消石灰) 生石灰 CaO(白色块状固体)(白色粉末)该反应能放出大量的热。它可由生石灰(CaO)与水反应得到:制取熟石灰CaO+H2O=Ca(OH)2生石灰煮鸡蛋?北京奥运期间大量供应的自加热盒饭,加热包中就发生了如下反应, CaO+H2O== Ca(OH)2 此食品干燥剂的主要成分是什么?为什么要注明“请勿食用”?在你打开食品后,见到此类干燥剂,应如何处理? 在打开食品后,取出此类干燥剂,如何设计实验检验此干燥剂是否变质?《石灰吟》明朝---于谦千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。CaCO3 === CaO + CO2↑ CaO + H2O === Ca(OH)2生石灰遇水放出大量的热, 并转变成熟石灰[Ca(OH)2] Ca(OH)2 + CO2 === CaCO3 ↓+ H2O高温【实验8-10】氢氧化钠的潮解性、水溶性和腐蚀性1、实验现象:氢氧化钠固体逐渐溶解在水溶液中,试管壁发烫。 3、实验现象:氢氧化钠表面潮湿并逐渐溶解。2、实验现象:鸡爪肉被腐蚀,变色。4、 氢氧化钠 [NaOH] 的用途 肥 皂 石 油 造 纸 纺 织 印 染 含NaOH 氢氧化钠的物理性质及用途NaOH苛性钠 火 碱 烧 碱氢氧化钠碱的通性 1、碱与指示剂的作用 实验现象:无色酚酞溶液变红,紫色石蕊溶液变蓝。 性质1:碱能使无色酚酞溶液变红,使紫色石蕊溶液变蓝2、碱与非金属氧化物的反应【实验8-11】碱与非金属氧化物的作用实验现象: 解释:性质2: 碱能跟多种非金属氧化物起反应,生成盐和水。 回顾:二氧化碳与石灰水发生的反应CO2+Ca(OH)2=CaCO3↓+H2O 非金属氧化物 碱 盐 水倒插在氢氧化钠溶液中的试管里的液面上升较高。说明氢氧化钠溶液可以跟二氧化碳反应。Ca(OH)2 +CO2 = CaCO3 ↓ +H2O NaOH + CO2 = NaOH + SO2 =Ca(OH)2 +CO2 =2NaOH + CO2 =Na2CO3 + H2O2NaOH + SO2 =Na2SO3 + H2O1、氢氧化钠与硫酸铜反应 3、碱与盐的反应 【实验8-12】实验现象:有蓝色的沉淀生成CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4 2、氢氧化钠与氯化铁反应 实验现象:有红褐色的沉淀生成3NaOH +FeCl3 ==Fe(OH)3↓+3NaCl 性质3:碱能跟某些盐发生复分解反应,生成其他碱和盐。 碱 + 盐 → 新碱 + 新盐畅谈收获碱的物理性质碱的化学性质碱能使紫色石蕊溶液变蓝碱能使无色酚酞溶液变红碱+非金属氧化物→盐+水碱+某些可溶性盐→新碱+新盐小结 一、几种常见的碱1、氢氧化钠(NaOH) 俗名:火碱、烧碱、苛性钠2、氢氧化钙(Ca(OH)2) 俗名:熟石灰、消石灰二、碱的通性性质1 碱能使无色酚酞溶液变红,使紫色的石蕊溶液变蓝。性质2 碱 + 酸 盐 + 水 性质3 碱 + 某些非金属氧化物 盐 + 水NaOH和Ca(OH)2的保存和鉴别CO2的方法。性质4 碱 + 盐 新盐 + 新碱 一、三酸的物理性质无色有刺激性气味易挥发的液体无色无味难挥发易吸水的液体,可用作干燥剂。无色有刺激性气味易挥发的液体因溶质挥发,质量减少质量分数减小质量分数减小质量分数减小因溶质挥发,质量减少因吸收水分,质量增加 列表比较氢氧化钠和氢氧化钙的物理性质白色固体极易溶于水,放出大量的热微溶于水,水溶液俗称石灰水极易潮解烧碱 苛性钠 火碱熟石灰、消石灰、石灰浆白色固体易潮解的物质:1、氢氧化钠 2、粗盐溶于水放出大量热的物质1、浓硫酸 2、生石灰 3、氢氧化钠氢氧化钠具有强烈的腐蚀性,切不可用嘴尝和用手拿,万一手上或衣服上碰到,要立即用水冲洗。氢氧化钙也有腐蚀性,也不能用嘴尝和用手拿。浓盐酸和浓硫酸物理性质比较无色液体无色;粘稠、油状、液体有白雾出现无现象有刺激性气味无气味1.19g/mL1.84g/mL? 浓盐酸在空气中会生成白雾,是因为从浓盐酸中挥发出来的氯化氢气体跟空气中的水蒸气接触,形成盐酸小液滴,白雾就是大量盐酸小液滴暂时聚集并悬浮在有限空间时出现的现象。它反映了氯化氢极易溶于水的性质,也反映了盐酸极易挥发的性质。 小结:盐酸、硫酸、硝酸的性质比较盐酸硫酸硝酸物理性质 化学性质指示剂金属金氧碱盐Zn+HCl——Zn+H2SO4——能反应,但是不生成氢气Fe2O3+HCl——CuO+H2SO4——MgO+HNO3——NaOH+HCl——NaOH+H2SO4——KOH+HNO3——AgNO3+HCl——BaCl2+H2SO4——CaCO3+HNO3——讨论:NaOH 与CO2反应时是没有什么现象看到的,是不是它们不反应呢?那你如何设计一个实验来证明它们确实发生了化学反应呢?演示:在充满二氧化碳的集气瓶中,滴加少量氢氧化钠浓溶液,振荡集气瓶,观察现象[问题讨论] 1.为什么小橡皮泡会逐渐涨大?2.模仿CO2与Ca(OH)2溶液反应方程式书写上述反应的化学方程式?结束实验演示:在充满二氧化碳的集气瓶中,滴加少量氢氧化钠浓溶液,振荡集气瓶,观察现象[问题讨论] 1.为什么小橡皮泡会逐渐涨大?2.模仿CO2与Ca(OH)2溶液反应方程式书写上述反应的化学方程式?www.themegallery.com证明氢氧化钠与二氧化碳反应的实验⑸红墨水被压入左端或集气瓶 里⑴试管内液面上升,烧杯内液面下降⑷烧杯内的水流入锥形瓶中⑶气球胀大⑵软塑料瓶变瘪⑹ 烧瓶中形成红色喷泉 ⑺a瓶的长导管有气泡冒出,而b瓶的长导管没有气泡冒出,石灰水不变浑浊。 解释:在⑴~⑹中,CO2+2NaOH=Na2CO3+H2O,使容器里的压强减小。能说说实验现象吗?试管中水面上升B高A低水倒吸到烧瓶中广口瓶中冒气泡烧瓶中有红色喷泉为探究二氧化碳与氢氧化纳确实发生化学反应,某实验小组设计了如下装置进行实验。 请回答: 选择任意一种实验装置,简述出现的实验现象,解释产生该实验现象的原因:选择的实验装置是( ),实验现象为( ),产生该实验现象的原因是( )。8.完成下列化学方程式并指出反应的类型:1) NaOH + CO2 =2) NaOH + SO2 =3)NaOH + HCl=4) NaOH + H2SO4=5) NaOH + CuCl2=6) NaOH + FeCl3=Na2CO3 + H2ONa2SO3 + H2O22Na2SO4 + H2O222NaCl + H2ONaCl + Cu(OH) 2↓2NaCl + Fe(OH) 3↓33课后作业《基础题与中考新考法》P107 8.2 常见的酸和碱
8.2 常见的酸和碱科粤版 九年级化学 下册日常生活中的酸酸奶中含有乳酸生活中常见的酸和碱食醋——醋酸水果——果酸胃液——盐酸饮料——碳酸石灰水——氢氧化钙炉具清洁剂—— 氢氧化钠尿液——尿酸1、人的胃液里含有盐酸(HCl);2、汽车电瓶里含有硫酸(H2SO4);3、食醋里含有醋酸,也叫乙酸;4、酸雨里含有亚硫酸(H2SO3),也可能含有硝酸(HNO3)。酸:组成特点:H+ + 酸根定义:在溶液中电离时阳离子全部是氢离子且能使紫色石蕊试液变红的化合物H2SO4 HCl HNO3 H2S H3PO4 HF HClO3 CH3COOH你想怎样给酸分类?想一想是否含氧含氧酸无氧酸H+的个数一元酸二元酸三元酸H2SO4 HNO3 HClO3 H3PO4 CH3COOH H2S HCl HFHNO3 HCl HClO3 CH3COOH HF H2SO4 H2S H3PO4酸你能试着读出这些酸的名称吗?H2SO4H2CO3H3PO4HClO3HNO3某 酸HClH2SHF氢某酸无氧酸含氧酸命名命名硝酸盐酸硫酸 常见的酸盐酸,即氢氯酸,无色液体,易挥发,有刺激性气味; (瓶口有白雾)硫酸,无色油状液体,强腐蚀性,密度较大(1.84g/cm3);硝酸,无色液体,强腐蚀性,有特殊刺激性气味。 (瓶口有白雾) ③浓硫酸的腐蚀性1.浓硫酸的特性 【实验8-5】 能夺取纸张、木材、棉布、 皮肤(由含C、H、O等元素的化合物组成)里的水分,生成黑色的炭。①浓硫酸的脱水性②浓硫酸的吸水性-----做干燥剂脱水性吸水性腐蚀性稀释浓硫酸时,一定 要把浓硫酸沿容器壁 慢慢注入水里,并不 断搅拌。切不可将水 倒进浓硫酸里 浓硫酸的稀释【实验8-6】化学晚会上小豆把一张白纸的正反两面向大家展示清楚,然后把白纸用电吹风的热风吹片刻,不一会,白纸上出现了一只小黑猫,大家惊奇不已.你知道这是怎么回事吗?请你用学过的化学知识来解释:(1)小豆事先用 ________画了一只猫;(2)使白纸出现黑猫的物质是_______;表现该物质具有______性。稀硫酸浓硫酸脱水稀酸的化学性质 1、在碳酸溶液中,紫色石蕊溶液由 色变成了 色。2、稀硫酸跟锌可发生什么反应?3、盐酸跟碳酸钙能发生反应吗? 紫红H2SO4 + Zn= H2 ↑ + ZnSO42HCl + CaCO3 =CaCl2 + H2O + CO2 ↑知识回顾1、酸与指示剂的作用使紫色的石蕊溶液变红色,但不能使无色的酚酞溶液变色。这是稀酸的化学通性之一。2、酸与金属的反应(1)回顾:较活泼金属(如铁)跟稀硫酸的置换反应: Fe + H2SO4 = FeSO4 + H2 ↑ (金属) (酸) (盐) (氢气) FeSO4这类由 金属离子 和 酸 根离子 组成的化合物通称为盐。 FeSO4Fe 2+SO4 2-+(金属离子)(酸根离子)CuSO4、CaCO3、NaCl、KNO3等均属于盐。 酸与金属的反应拓展:镁或锌与稀盐酸的反应。【实验8-7】现象: 在金属表面产生气泡(生成气体)。 化学方程式: Mg + 2HCl = MgCl2 + H2 ↑ Zn + 2HCl = ZnCl2 + H2 ↑ (金属) (酸) (盐) (氢气) 结论: 性质2 酸能跟较活泼金属(如镁、铝、锌和铁) 发生置换反应,放出氢气,并生成盐。 硝酸性质较特殊它与金属反应时,一般不生成氢气,而是氮氧化物请写出镁、铝、锌、铁分别与稀硫酸的反应。Mg + H2SO4 === MgSO4 + H2↑2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑Zn + H2SO4 === ZnSO4 + H2↑Fe + H2SO4 === FeSO4 + H2↑浅绿色3、酸跟金属氧化物的反应实验:【实验8-8】在试管中,加入少量氧化铜粉末,再加入约2ml稀硫酸,在酒精灯上加热,不停振荡,观察变化现象。 现象: 黑色粉末逐渐减少,无色溶液变蓝色。化学方程式: CuO + H2SO4 = Cu SO4 + H2O(金属氧化物)(酸) (盐) (水) 酸跟金属氧化物的反应实验(2) 把生锈的铁钉浸入盛有稀盐酸溶液的试管中,过一段时间后,取出,洗净,并观察它的变化。 现象: 铁锈消失,同时无色溶液变黄色。 化学方程式: Fe2O3 + 6HCl = 2FeCl3 + 3H2O (金属氧化物) (酸) (盐) (水) 结论: 性质3:酸能跟某些金属氧化物反应,生成盐和水 4、酸跟盐的反应 拓展:将稀盐酸与硝酸银进行实验 [实验8-9]现象: 生成白色沉淀(此实验常用于检验Cl- 阅读 P231)。化学方程式:HCl + AgNO3 = AgCl ↓ + HNO3 (酸) (盐) (新盐) (新酸)结论:性质4:酸能跟某些盐反应,生成其他酸和盐。 2HCl + CaCO3 = CaCl2 + H2O+CO2 ↑2HCl + CaCO3 = CaCl2 + H2CO3 ∟ H2O+CO2 ↑回顾:实验室制备二氧化碳的化学反应:(酸) (盐) (新盐) (新酸)长话短说——酸的化学通性检查站1、写出下列反应的化学方程式:(1)硫酸跟氧化镁反应,生成硫酸镁和水 (2)硫酸跟氯化钡反应,生成硫酸钡和盐酸。 (3)稀硫酸跟锌反应,生成硫酸锌和氢气。 H2SO4 + MgO = MgSO4 + H2OH2SO4 + BaCl2 = BaSO4 ↓+ 2HClH2SO4 +Zn = ZnSO4 + H2↑2、举例说明以下转变关系(参照上题,把题号填在下面的括号内):1、H2SO4 + MgO = MgSO4 + H2O2、H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl3、H2SO4 +Zn = ZnSO4 + H2↑132 实验室内常用的碱 碱性的日常用品 1.请你说出你所知道的碱还有哪些?他们有哪些用途你知道吗?请阅读课本232了解常见的碱的用途。 2.阅读课本232页了解生石灰与熟石灰,了解它们是如何制得。 常见三种碱的常见用途碱:电离后阴离子全部是氢氧根例子的化合物。氢氧化钙的物理性质及用途1.氢氧化钙的俗名叫熟石灰, (白色固体,微溶于水)用来 石灰水,就是它的水溶液。2.在生产中,人们大量用熟石灰作 。 检验二氧化碳的 建筑材料和改良土壤 氧化钙还可通过与水反应来产生大量的热,常用于自动加温包装。虎门销烟时,当时林则徐一为防止废气,二为避免鸦片污染土壤,就采用向水中加入鸦片和氧化钙的方法来分解鸦片。 二、氢氧化钙 [ Ca(OH)2 ] 在检验二氧化碳时用到的石灰水就是氢氧化钙的水溶液。产生大量的热(生石灰) (熟石灰) 氧化钙 氢氧化钙 (消石灰) 生石灰 CaO(白色块状固体)(白色粉末)该反应能放出大量的热。它可由生石灰(CaO)与水反应得到:制取熟石灰CaO+H2O=Ca(OH)2生石灰煮鸡蛋?北京奥运期间大量供应的自加热盒饭,加热包中就发生了如下反应, CaO+H2O== Ca(OH)2 此食品干燥剂的主要成分是什么?为什么要注明“请勿食用”?在你打开食品后,见到此类干燥剂,应如何处理? 在打开食品后,取出此类干燥剂,如何设计实验检验此干燥剂是否变质?《石灰吟》明朝---于谦千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,要留清白在人间。CaCO3 === CaO + CO2↑ CaO + H2O === Ca(OH)2生石灰遇水放出大量的热, 并转变成熟石灰[Ca(OH)2] Ca(OH)2 + CO2 === CaCO3 ↓+ H2O高温【实验8-10】氢氧化钠的潮解性、水溶性和腐蚀性1、实验现象:氢氧化钠固体逐渐溶解在水溶液中,试管壁发烫。 3、实验现象:氢氧化钠表面潮湿并逐渐溶解。2、实验现象:鸡爪肉被腐蚀,变色。4、 氢氧化钠 [NaOH] 的用途 肥 皂 石 油 造 纸 纺 织 印 染 含NaOH 氢氧化钠的物理性质及用途NaOH苛性钠 火 碱 烧 碱氢氧化钠碱的通性 1、碱与指示剂的作用 实验现象:无色酚酞溶液变红,紫色石蕊溶液变蓝。 性质1:碱能使无色酚酞溶液变红,使紫色石蕊溶液变蓝2、碱与非金属氧化物的反应【实验8-11】碱与非金属氧化物的作用实验现象: 解释:性质2: 碱能跟多种非金属氧化物起反应,生成盐和水。 回顾:二氧化碳与石灰水发生的反应CO2+Ca(OH)2=CaCO3↓+H2O 非金属氧化物 碱 盐 水倒插在氢氧化钠溶液中的试管里的液面上升较高。说明氢氧化钠溶液可以跟二氧化碳反应。Ca(OH)2 +CO2 = CaCO3 ↓ +H2O NaOH + CO2 = NaOH + SO2 =Ca(OH)2 +CO2 =2NaOH + CO2 =Na2CO3 + H2O2NaOH + SO2 =Na2SO3 + H2O1、氢氧化钠与硫酸铜反应 3、碱与盐的反应 【实验8-12】实验现象:有蓝色的沉淀生成CuSO4 + 2NaOH == Cu(OH)2↓+ Na2SO4 2、氢氧化钠与氯化铁反应 实验现象:有红褐色的沉淀生成3NaOH +FeCl3 ==Fe(OH)3↓+3NaCl 性质3:碱能跟某些盐发生复分解反应,生成其他碱和盐。 碱 + 盐 → 新碱 + 新盐畅谈收获碱的物理性质碱的化学性质碱能使紫色石蕊溶液变蓝碱能使无色酚酞溶液变红碱+非金属氧化物→盐+水碱+某些可溶性盐→新碱+新盐小结 一、几种常见的碱1、氢氧化钠(NaOH) 俗名:火碱、烧碱、苛性钠2、氢氧化钙(Ca(OH)2) 俗名:熟石灰、消石灰二、碱的通性性质1 碱能使无色酚酞溶液变红,使紫色的石蕊溶液变蓝。性质2 碱 + 酸 盐 + 水 性质3 碱 + 某些非金属氧化物 盐 + 水NaOH和Ca(OH)2的保存和鉴别CO2的方法。性质4 碱 + 盐 新盐 + 新碱 一、三酸的物理性质无色有刺激性气味易挥发的液体无色无味难挥发易吸水的液体,可用作干燥剂。无色有刺激性气味易挥发的液体因溶质挥发,质量减少质量分数减小质量分数减小质量分数减小因溶质挥发,质量减少因吸收水分,质量增加 列表比较氢氧化钠和氢氧化钙的物理性质白色固体极易溶于水,放出大量的热微溶于水,水溶液俗称石灰水极易潮解烧碱 苛性钠 火碱熟石灰、消石灰、石灰浆白色固体易潮解的物质:1、氢氧化钠 2、粗盐溶于水放出大量热的物质1、浓硫酸 2、生石灰 3、氢氧化钠氢氧化钠具有强烈的腐蚀性,切不可用嘴尝和用手拿,万一手上或衣服上碰到,要立即用水冲洗。氢氧化钙也有腐蚀性,也不能用嘴尝和用手拿。浓盐酸和浓硫酸物理性质比较无色液体无色;粘稠、油状、液体有白雾出现无现象有刺激性气味无气味1.19g/mL1.84g/mL? 浓盐酸在空气中会生成白雾,是因为从浓盐酸中挥发出来的氯化氢气体跟空气中的水蒸气接触,形成盐酸小液滴,白雾就是大量盐酸小液滴暂时聚集并悬浮在有限空间时出现的现象。它反映了氯化氢极易溶于水的性质,也反映了盐酸极易挥发的性质。 小结:盐酸、硫酸、硝酸的性质比较盐酸硫酸硝酸物理性质 化学性质指示剂金属金氧碱盐Zn+HCl——Zn+H2SO4——能反应,但是不生成氢气Fe2O3+HCl——CuO+H2SO4——MgO+HNO3——NaOH+HCl——NaOH+H2SO4——KOH+HNO3——AgNO3+HCl——BaCl2+H2SO4——CaCO3+HNO3——讨论:NaOH 与CO2反应时是没有什么现象看到的,是不是它们不反应呢?那你如何设计一个实验来证明它们确实发生了化学反应呢?演示:在充满二氧化碳的集气瓶中,滴加少量氢氧化钠浓溶液,振荡集气瓶,观察现象[问题讨论] 1.为什么小橡皮泡会逐渐涨大?2.模仿CO2与Ca(OH)2溶液反应方程式书写上述反应的化学方程式?结束实验演示:在充满二氧化碳的集气瓶中,滴加少量氢氧化钠浓溶液,振荡集气瓶,观察现象[问题讨论] 1.为什么小橡皮泡会逐渐涨大?2.模仿CO2与Ca(OH)2溶液反应方程式书写上述反应的化学方程式?www.themegallery.com证明氢氧化钠与二氧化碳反应的实验⑸红墨水被压入左端或集气瓶 里⑴试管内液面上升,烧杯内液面下降⑷烧杯内的水流入锥形瓶中⑶气球胀大⑵软塑料瓶变瘪⑹ 烧瓶中形成红色喷泉 ⑺a瓶的长导管有气泡冒出,而b瓶的长导管没有气泡冒出,石灰水不变浑浊。 解释:在⑴~⑹中,CO2+2NaOH=Na2CO3+H2O,使容器里的压强减小。能说说实验现象吗?试管中水面上升B高A低水倒吸到烧瓶中广口瓶中冒气泡烧瓶中有红色喷泉为探究二氧化碳与氢氧化纳确实发生化学反应,某实验小组设计了如下装置进行实验。 请回答: 选择任意一种实验装置,简述出现的实验现象,解释产生该实验现象的原因:选择的实验装置是( ),实验现象为( ),产生该实验现象的原因是( )。8.完成下列化学方程式并指出反应的类型:1) NaOH + CO2 =2) NaOH + SO2 =3)NaOH + HCl=4) NaOH + H2SO4=5) NaOH + CuCl2=6) NaOH + FeCl3=Na2CO3 + H2ONa2SO3 + H2O22Na2SO4 + H2O222NaCl + H2ONaCl + Cu(OH) 2↓2NaCl + Fe(OH) 3↓33课后作业《基础题与中考新考法》P107 8.2 常见的酸和碱
相关资料
更多









