



高中化学人教版 (2019)必修 第一册第二节 氯及其化合物背景图ppt课件
展开1.根据Cl2的性质,掌握Cl2的实验室制法(发生、净化、收集和尾气处理)。2.掌握 Cl-的一般检验方法
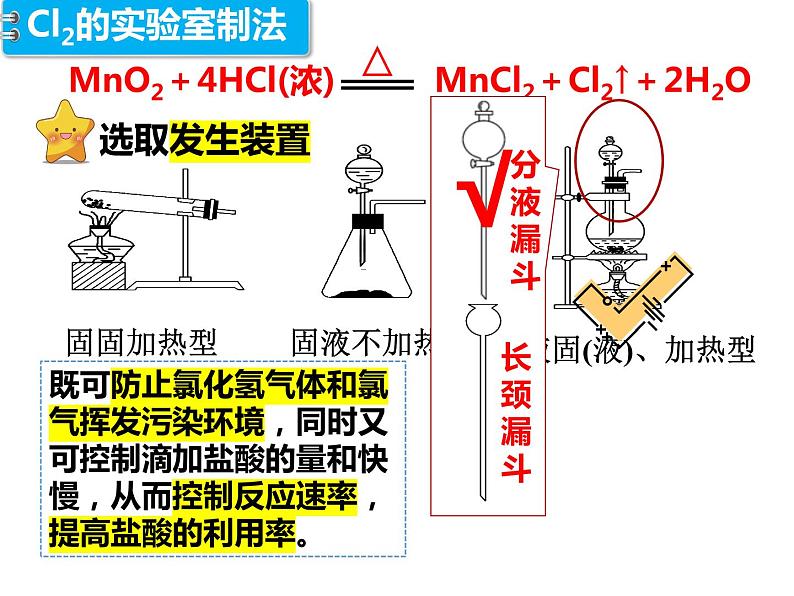
1774年,瑞典化学家舍勒在研究软锰矿(主要成分MnO2)的过程中,发现软锰矿与浓盐酸混合加热,产生了黄绿色气体、伴有强烈的刺激性气味。——氯气。
(1)化学方程式:__________________________________________________。(2)原理:利用强氧化剂氧化浓盐酸中的Cl-生成Cl2,该反应中MnO2为________,浓盐酸为_______并且该实验浓盐酸体现了_______和______性。
既可防止氯化氢气体和氯气挥发污染环境,同时又可控制滴加盐酸的量和快慢,从而控制反应速率,提高盐酸的利用率。
资料卡片:Cl2在饱和食盐水中溶解度很小
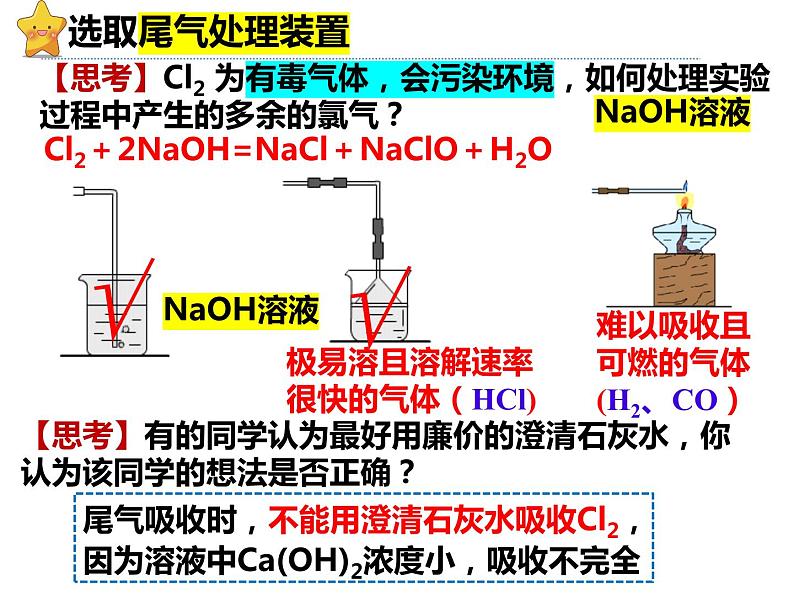
Cl2+2NaOH=NaCl+NaClO+H2O
【思考】Cl2 为有毒气体,会污染环境,如何处理实验过程中产生的多余的氯气?
极易溶且溶解速率很快的气体(HCl)
难以吸收且可燃的气体 (H2、CO)
尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全
【思考】有的同学认为最好用廉价的澄清石灰水,你认为该同学的想法是否正确?
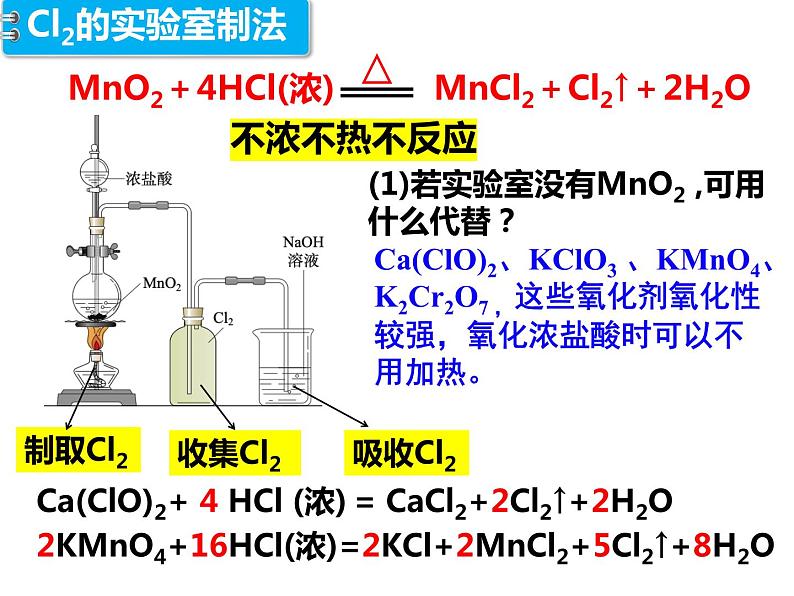
(1)若实验室没有MnO2 ,可用什么代替?
Ca(ClO)2、KClO3 、KMnO4、K2Cr2O7 ,这些氧化剂氧化性较强,氧化浓盐酸时可以不用加热。
Ca(ClO)2+ 4 HCl (浓) = CaCl2+2Cl2↑+2H2O2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
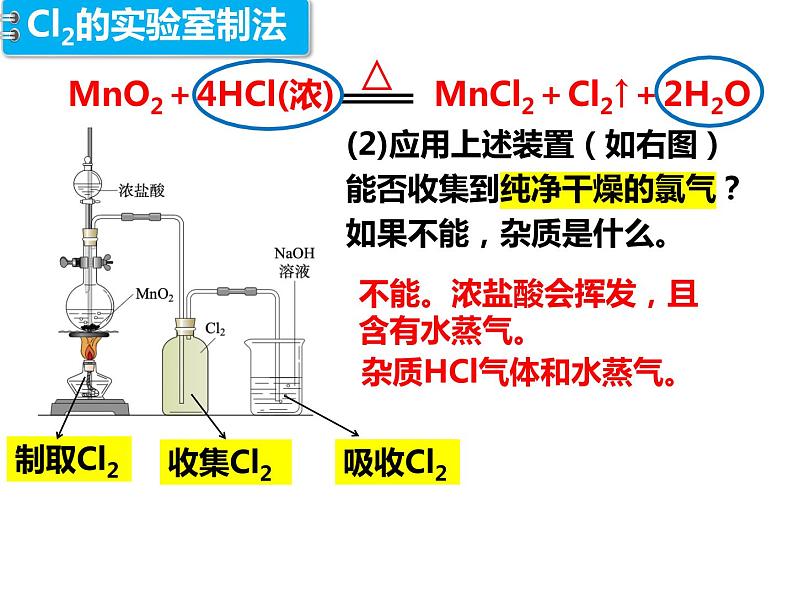
(2)应用上述装置(如右图)能否收集到纯净干燥的氯气?如果不能,杂质是什么。
杂质HCl气体和水蒸气。
不能。浓盐酸会挥发,且含有水蒸气。
(3)如果要除去以上两种杂质,得到纯净干燥的氯气,需要选择何试剂?
Cl2(HCl、 H2O)
资料卡片:HCl极易溶于水,1体积水溶解500体积的HCl。除去Cl2中HCl气体用饱和食盐水,是因为Cl2在饱和食盐水中溶解度很小
(4)请根据以上除去氯气中选择两种杂质试剂,选择需要增加的装置?
(1)溶液中加入AgNO3溶液有沉淀,说明溶液中一定含Cl-。 ( )(2)实验室制备氯气时必须用二氧化锰和浓盐酸。 ( )(3)因为氯气与水反应,所以收集氯气不能用排液法收集。 ( )(4)KClO3中含有氯元素,向KClO3溶液中加入用硝酸酸化的AgNO3溶液,可产生白色沉淀。 ( )
Ca(ClO)2、KClO3 、KMnO4、K2Cr2O7
KClO3不能电离出Cl-
一套完整的气体制取装置应该包括哪几步?
除去氯气中的H2O(g)
【思考】如何确定氯气已经收集满?
2KI+Cl2=2KCl+I2
②将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
③将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
观察到集气瓶内充满了黄绿色气体
【实验2-9】在三支试管中分别加入2~3 mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,再分别加入少量稀硝酸,观察现象,填写下表:
产生白色沉淀,沉淀不溶解
产生白色沉淀,后沉淀溶解,产生气泡
Cl- + Ag+ = AgCl↓
CO32- + 2Ag+ = Ag2CO3↓
Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O
取少量被检测溶液于试管中,滴加适量稀硝酸,然后滴入AgNO3溶液,若产生白色沉淀,则被检测溶液中含有Cl-,若无白色沉淀则无Cl-。 加入AgNO3溶液的目的是检验Cl-,加稀硝酸酸化的目的是排除 CO32- 等的干扰,因为Ag2CO3可溶于稀硝酸,而AgCl不溶。
【思考】通过上述实验探究,交流归纳氯离子的检验方法,并说明加入试剂的目的。
或者硝酸酸化的硝酸银溶液
【思考】若被检验的溶液中既有Cl-也含有SO42-,应如何检验是否含有Cl-?
因为Ag2SO4微溶于水,SO42-的存在会干扰Cl-的检验,故先加足量Ba(NO3)2溶液除去溶液中的SO42-,然后再加入硝酸酸化的AgNO3溶液,看是否产生白色沉淀,检验Cl-的存在。
1.某化学兴趣小组为探究氯气是否具有漂白性设计如图所示的实验装置(部分夹持装置已略去,Ⅰ为湿润的蓝色石蕊试纸,Ⅱ为干燥的蓝色石蕊试纸)。
下列说法错误的是( )A.装置A中发生反应的氧化剂是二氧化锰B.装置B盛有饱和食盐水,可储存多余氯气,且有安全瓶作用C.装置C中,Ⅰ处湿润的蓝色石蕊试纸先变为红色,然后褪色D.将无水氯化钙改为碱石灰也可以得到相同的实验结论
2.某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:Ⅰ.实验室制备和收集氯气的常用装置如图。
(1)利用该装置制备氯气的化学方程式为__________________________________。(2)在实验过程中饱和食盐水的作用是___________________________________。(3)实验装置接口的连接顺序为e→______→____→_____→_____→i→h→g→f。
除去氯气中的氯化氢气体
d c a b
(4)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中HCl的作用是还原性和________。
Ⅱ.漂白粉的制备( 装置如图所示)查阅资料可知:①氯气与碱反应放出热量;②6Cl2+6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O。
(5)装置C中发生反应的化学方程式为__________________________。(6)多孔球泡的作用是__________________________________________, 使用冰水浴的目的是_________________________________________
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
增大氯气和石灰乳的接触面积,提高吸收效率
1.下列关于利用二氧化锰和浓盐酸反应制备氯气的说法中错误的是( )A.该反应是一个氧化还原反应,其中二氧化锰是氧化剂B.该反应需要加热C.该反应的离子方程式为 MnO2+4H++4Cl- MnCl2+2H2O+Cl2↑D.该方法是瑞典化学家舍勒最先发现的
2.下列检验Cl-的方法正确的是( )A.向某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-B.向某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-C.向某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明溶液中有Cl-D.向某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
3.实验室利用如图所示的装置制取并收集氯气,下列有关描述正确的是( )
A.发生装置应先加热再逐滴加入浓盐酸B.饱和食盐水可以用饱和碳酸氢钠溶液代替C.若用稀盐酸代替浓盐酸不能制得氯气,说明浓盐酸的氧化性较强D.可以通过观察集气瓶中气体的颜色判断氯气是否收集满
浓盐酸易挥发,先加热会加速盐酸的挥发,所以应先加入浓盐酸,再用小火加热
高中人教版 (2019)第二节 氯及其化合物备课ppt课件: 这是一份高中人教版 (2019)第二节 氯及其化合物备课ppt课件,文件包含222氯气的实验室制法与氯离子的检验教学课件高一化学同步备课系列人教版2019必修第一册pptx、222氯气的实验室制法与氯离子的检验分层作业解析版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx、222氯气的实验室制法与氯离子的检验分层作业原卷版-上好课2022-2023学年高一化学同步备课系列人教版2019必修第一册docx等3份课件配套教学资源,其中PPT共20页, 欢迎下载使用。
高中人教版 (2019)第二章 海水中的重要元素——钠和氯第二节 氯及其化合物评课课件ppt: 这是一份高中人教版 (2019)第二章 海水中的重要元素——钠和氯第二节 氯及其化合物评课课件ppt,共1页。
化学必修 第一册第二章 海水中的重要元素——钠和氯实验活动1 配制一定物质的量浓度的溶液一等奖课件ppt: 这是一份化学必修 第一册第二章 海水中的重要元素——钠和氯实验活动1 配制一定物质的量浓度的溶液一等奖课件ppt,共14页。PPT课件主要包含了氯气有什么用途,自来水消毒,制漂白液,制氯化氢,制漂白粉漂粉精,氯气是重要的化工原料,如何制取,氯及其化合物,氯气的制取,CO2等内容,欢迎下载使用。













