






2024版新教材高考化学全程一轮总复习第二章物质的量第6讲物质的量浓度课件
展开复 习 目 标1.了解溶液浓度的表示方法。理解溶液中溶质的质量分数和物质的量浓度的概念并能进行有关计算;2.掌握配制一定溶质质量分数溶液和物质的量浓度溶液的方法;3.了解溶解度、饱和溶液的概念;掌握溶解度曲线在物质分离、提纯中的应用。
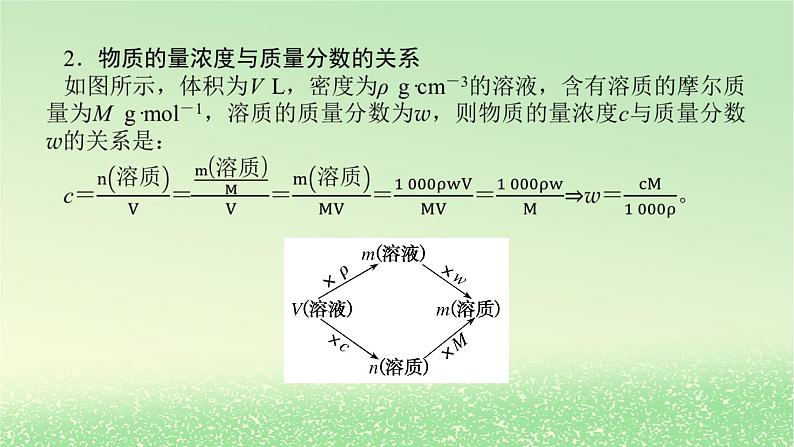
考点一 物质的量浓度必备知识整理一、溶液组成的表示方法1.物质的量浓度(cB)(1)基本概念:表示________溶液里所含溶质的物质的量的物理量。(2)数学表达式:__________。(3)常用单位为______________。(4)特点:对于某浓度的溶液,取出任意体积的溶液,其浓度、密度、质量分数________,但所含溶质的________、________则因体积不同而改变。
ml·L-1(或ml/L)
2.溶质的质量分数(w)(1)概念:用溶质的质量与溶液质量的比值来表示溶液组成的物理量,一般用百分数表示。(2)表达式:________________。
微点拨 溶质相同、质量分数不同的两溶液的混合规律溶质相同、质量分数分别为a%、b%的两溶液混合:
[正误判断] (1)将58.5 g NaCl溶于水配成1 L溶液,所得溶液的物质的量浓度为1 ml·L-1。( )(2)1 ml·L-1 NaCl溶液是指此溶液中含有1 ml NaCl( )
× n=cBV,没有体积无法计算物质的量
(3)1 L 0.5 ml·L-1 CaCl2溶液中,Ca2+与Cl-的物质的量浓度都是0.5 ml·L-1( )(4)1 ml Na2O溶于水,配成1 L溶液所得溶液的物质的量浓度为1 ml·L-1( )
× 0.5 ml·L-1的溶液中,Ca2+与Cl-的物质的量浓度分别为0.5 ml·L-1、1 ml·L-1
题组二 溶液的混合和稀释3.现有V L 0.5 ml·L-1的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是( )A.加热浓缩到原来体积的一半B.加入5 ml·L-1的盐酸0.125V LC.加入10 ml·L-1的盐酸0.1V L,再稀释至1.5V LD.标准状况下通入11.2 L氯化氢气体
4.下图是某学校实验室从市场买回的试剂标签上的部分内容。
按要求回答下列问题:(1)硫酸的物质的量浓度为____________,氨水的物质的量浓度为___________。(2)各取5 mL与等质量的水混合后,c(H2SO4)________ 9.2 ml·L-1,c(NH3)________ 6.45 ml·L-1(填“>”“<”或“=”,下同)。(3)各取5 mL与等体积水混合后,w(H2SO4)________ 49%,w(NH3)________12.5%。
18.4 ml·L-1
12.9 ml·L-1
新 情 境 新 高 考从生活中认识物质的量浓度下图是某种饮用矿泉水标签的部分内容。
考点二 一定物质的量浓度溶液的配制必备知识整理一、一定物质的量浓度溶液的配制1.主要仪器托盘天平、________、________、玻璃棒、________、________、________。2.容量瓶的构造及使用(1)构造及用途
3.配制过程(以配制500 mL 1.0 ml·L-1 NaCl溶液为例)
4.误差分析(1)分析依据
(2)常见的操作不当造成的误差
二、一定质量分数溶液的配制1.溶质的质量分数(1)概念:用________的质量与________质量的比值来表示溶液组成的物理量,一般用百分数表示。(2)表达式:w(B)=_____________。2.一定质量分数溶液的配制(以配制100 g 5% NaOH溶液为例)(1)步骤:计算→称量(量取)→溶解(稀释)。(2)仪器:托盘天平、__________________。
三、体积比浓度溶液的配制如用浓硫酸配制1∶4的稀硫酸50 mL:用50 mL的量筒量取40.0 mL的水注入100 mL的烧杯中,再用10 mL的量筒量取10.0 mL浓硫酸,然后沿烧杯内壁缓缓注入烧杯中,并用玻璃棒不停地搅拌。
[正误判断] (1)“5%硫酸铜溶液”表示100 g硫酸铜溶液中含有5 g硫酸铜溶质( )(2)要配制100 g溶质质量分数为10%的氯化钠溶液,应将10 g氯化钠固体溶于100 mL水( )(3)将25 g CuSO4·5H2O晶体溶于75 g水中所得溶质的质量分数为25%( )
× 配制100 g溶质质量分数为10%的氯化钠溶液,应将10 g氯化钠固体溶于90g水中
× CuSO4·5H2O溶于水所得溶液的溶质为CuSO4,25 g CuSO4·5H2O中CuSO4的质量为16 g,溶液质量100 g,故所得溶液溶质的质量分数为16%
(4)将40 g SO3溶于60 g水中所得溶质的质量分数为49%( )(5)配制氯化钠溶液称量氯化钠时可直接放在天平的托盘上称量( )(6)应将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签( )
× 氯化钠具有腐蚀性,不能直接放在托盘上称量
对点题组训练题组一 一定物质的量浓度溶液配制的规范操作1.实验室需用450 mL 0.1 ml·L-1硫酸铜溶液,下列有关该溶液的配制说法正确的是( )A.用天平称取12.5 g胆矾(CuSO4·5H2O)B.应选用450 mL容量瓶配制溶液C.溶解胆矾的烧杯需用蒸馏水洗涤2~3次,并将洗涤液丢弃D.定容时,眼睛盯着胶头滴管
2.用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 ml·L-1的稀盐酸。现实验室需这种盐酸220 mL,试回答下列问题:(1)配制稀盐酸时,应选用________ mL的容量瓶。(2)经计算需要________ mL浓盐酸,在量取时宜选用________(填字母)量筒。A.5 mL B.10 mL C.25 mL D.50 mL(3)在量取浓盐酸后,进行了下列操作:①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。②往容量瓶中小心加蒸馏水至液面距容量瓶刻度线1~2 cm 时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度线相切。③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅拌,使其混合均匀。④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。上述操作中,正确的顺序是________(填序号)。
题组二 一定物质的量浓度溶液配制的误差分析3.配制一定物质的量浓度的NaOH溶液时,使所配制的溶液浓度偏小的操作是( )①烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯②定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线 ③实验用的容量瓶洗净后未干燥,里面含有少量水 ④定容时俯视A.①② B.③④ C.①③ D.②④
解析:①没有洗涤烧杯导致溶质不能全部转入容量瓶,配制的溶液浓度偏低;②定容后再滴加蒸馏水至刻度线,配制的溶液浓度偏低;③实验用的容量瓶洗净后未干燥,对配制的溶液浓度无影响;④定容时俯视,导致溶液体积偏小,配制的溶液浓度偏大。
4.从溶质改变角度分析产生的误差(用“偏大”“偏小”或“无影响”填空)。(1)配制450 mL 0.1 ml·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g:______。(2)配制500 mL 0.1 ml·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g:______。(3)配制NaOH溶液用托盘天平称量NaOH时,托盘天平的两个托盘上放两张质量相等的纸片,其他操作均正确:________。(4)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒:________。(5)配制稀H2SO4溶液用量筒量取浓硫酸时,仰视读数:________。(6)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线:________。(7)烧杯及玻璃棒未经洗涤:________。
解析:(2)胆矾的摩尔质量为250 g·ml-1,所需质量为0.5 L×0.1 ml·L-1×250 g·ml-1=12.5 g。(3)NaOH易吸水潮解。(4)实际称量质量为4 g-0.4 g=3.6 g。
考点三 溶解度 溶解度曲线必备知识整理1.溶解度
2.溶解度曲线(1)常见物质的溶解度曲线
(2)溶解度曲线的含义①点:曲线上的点叫________点。a.曲线上任一点表示对应温度下该物质的溶解度;b.两曲线的交点表示两物质在该交点的温度下溶解度________。②线:溶解度曲线表示物质的溶解度随温度变化的趋势,其变化趋势分为三种:a.陡升型:大部分固体物质的溶解度随温度升高而增大,且变化较大,如硝酸钾,提纯时常采用________的方法;b.下降型:极少数物质的溶解度随温度升高反而减小,如________的饱和溶液升温时变浑浊;c.缓升型:少数物质的溶解度随温度变化不大,如氯化钠,提纯时常采用________的方法。
③面:a.溶解度曲线下方的面表示相应温度下该物质的不饱和溶液;b.溶解度曲线上方的面表示相应温度下该物质的过饱和溶液,可以结晶析出晶体。3.利用溶解度受温度影响选择不同的物质分离方法(1)溶解度受温度影响较小的物质(如NaCl)采取________的方法;若NaCl溶液中含有KNO3,应采取蒸发结晶、趁热过滤的方法。(2)溶解度受温度影响较大的物质(或带有结晶水)采取蒸发浓缩、冷却结晶的方法;若KNO3溶液中含有NaCl,应采取______________________的方法。
加热浓缩、冷却结晶、过滤
2.以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下。
氯化铵和硫酸钠的溶解度随温度变化如图所示。回答下列问题。
(1)欲制备10.7 g NH4Cl,理论上需NaCl______ g。(2)实验室进行蒸发浓缩用到的主要仪器有________、烧杯、玻璃棒、酒精灯等。(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_________。(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是___________________________________________________________。(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是________。
加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵产品纯净
解析:根据氯守恒可列关系式求m(NaCl)=10.7 g×58.5 g·ml-1÷53.5 g·ml-1=11.7 g,氯化铵的溶解度随温度变化较大,而硫酸钠在30~100 ℃变化不大,故可用冷却结晶法。但温度不能太低以防硫酸钠析出。所以应大约在33~40 ℃。
本讲真题研练1.[2020·全国卷Ⅰ,27(1)]由FeSO4·7H2O固体配制0.10 ml·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、__________________(从下列图中选择,写出名称)。
解析:根据用固体物质配制一定物质的量浓度溶液的配制方法可知,题图给出的仪器中还需要烧杯、量筒和托盘天平。
凹液面最低处与刻度线相平
蓝色褪去且半分钟内不恢复原色
解析:(1)配制溶液需要计算、称量、溶解、转移、洗涤转移、定容、摇匀等步骤,称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的容量瓶中,加蒸馏水至凹液面最低处与刻度线相平。
2024版新教材高考化学全程一轮总复习第二章物质的量第5讲物质的量气体摩尔体积课件: 这是一份2024版新教材高考化学全程一轮总复习第二章物质的量第5讲物质的量气体摩尔体积课件,共47页。PPT课件主要包含了02×1023,n·NA,g·mol-1,答案B,答案C,4NA,单位物质的量,n·Vm,数目的分子,物质的量等内容,欢迎下载使用。
2024版新教材高考化学全程一轮总复习6物质的量浓度(课件+课时作业+学生用书)(3份): 这是一份2024版新教材高考化学全程一轮总复习6物质的量浓度(课件+课时作业+学生用书)(3份),文件包含2024版新教材高考化学全程一轮总复习第二章物质的量第6讲物质的量浓度课件pptx、2024版新教材高考化学全程一轮总复习第二章物质的量第6讲物质的量浓度学生用书doc、2024版新教材高考化学全程一轮总复习课时作业6物质的量浓度doc等3份课件配套教学资源,其中PPT共52页, 欢迎下载使用。
新教材适用2024版高考化学一轮总复习第2章物质的量及其应用第5讲物质的量浓度及其溶液的配制课件: 这是一份新教材适用2024版高考化学一轮总复习第2章物质的量及其应用第5讲物质的量浓度及其溶液的配制课件,共60页。PPT课件主要包含了考点一,考点二,必备知识·梳理夯实,物质的量,mol·L-1,2溶质的质量分数,18mol,归纳拓展,②查漏操作,胶头滴管等内容,欢迎下载使用。













