
吉林高考化学三年(2021-2023)模拟题汇编-09铁及其化合物
展开吉林高考化学三年(2021-2023)模拟题汇编-09铁及其化合物
一、单选题
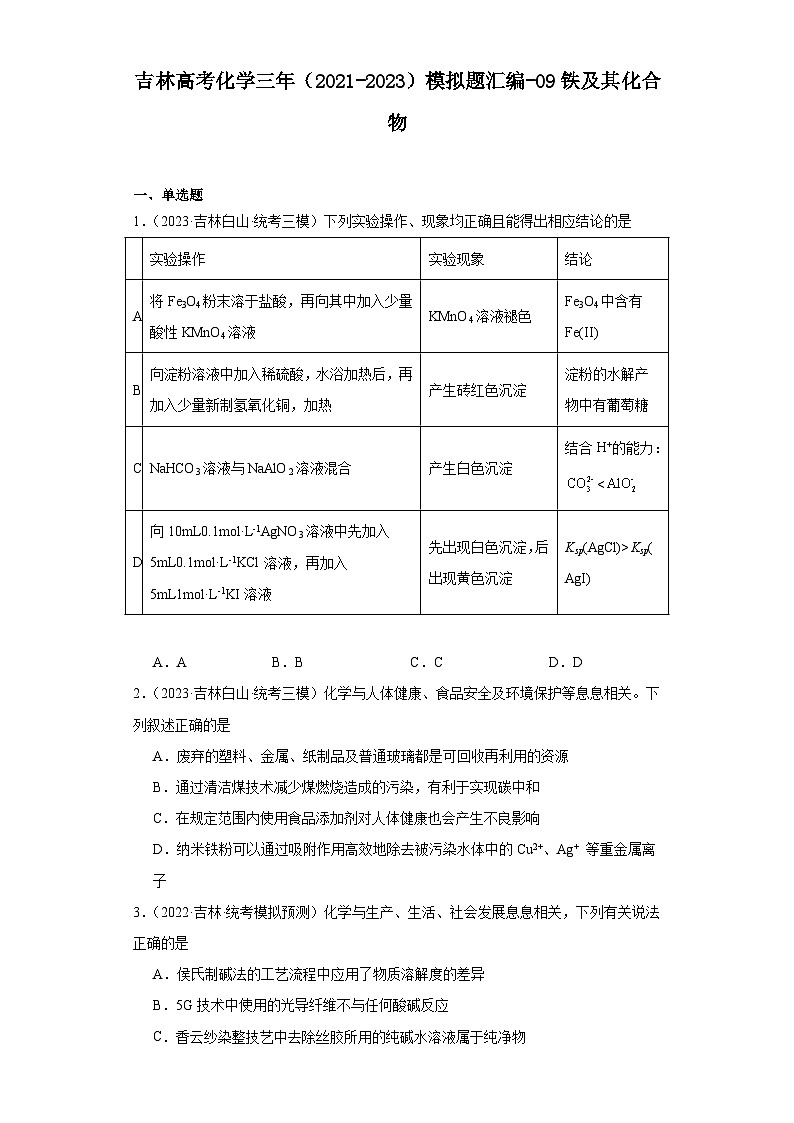
1.(2023·吉林白山·统考三模)下列实验操作、现象均正确且能得出相应结论的是
实验操作
实验现象
结论
A
将Fe3O4粉末溶于盐酸,再向其中加入少量酸性KMnO4溶液
KMnO4溶液褪色
Fe3O4中含有Fe(II)
B
向淀粉溶液中加入稀硫酸,水浴加热后,再加入少量新制氢氧化铜,加热
产生砖红色沉淀
淀粉的水解产物中有葡萄糖
C
NaHCO3溶液与NaAlO2溶液混合
产生白色沉淀
结合H+的能力:<
D
向10mL0.1mol·L-1AgNO3溶液中先加入5mL0.1mol·L-1KCl溶液,再加入5mL1mol·L-1KI溶液
先出现白色沉淀,后出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
2.(2023·吉林白山·统考三模)化学与人体健康、食品安全及环境保护等息息相关。下列叙述正确的是
A.废弃的塑料、金属、纸制品及普通玻璃都是可回收再利用的资源
B.通过清洁煤技术减少煤燃烧造成的污染,有利于实现碳中和
C.在规定范围内使用食品添加剂对人体健康也会产生不良影响
D.纳米铁粉可以通过吸附作用高效地除去被污染水体中的Cu2+、Ag+ 等重金属离子
3.(2022·吉林·统考模拟预测)化学与生产、生活、社会发展息息相关,下列有关说法正确的是
A.侯氏制碱法的工艺流程中应用了物质溶解度的差异
B.5G技术中使用的光导纤维不与任何酸碱反应
C.香云纱染整技艺中去除丝胶所用的纯碱水溶液属于纯净物
D.我国古代“灌钢法”的原料之一赤铁矿的主要成分为FeO
4.(2022·吉林长春·统考模拟预测)《天工开物》中“治铁"原典中记载:“凡治铁成器,取已炒熟铁为之……凡炉中炽铁用炭,煤炭居十七,木炭居十三……即用煤炭也别有铁炭一种,取其火性内攻、焰不虚腾者,与炊炭同行而有分类也……”。下列说法正确的是
A.熟铁是纯净的铁单质,生铁是铁和碳的混合物
B.治铁过程只涉及化合反应与置换反应,
C.铁炭和炊炭均为碳元素的同素异形体
D.治铁用到的煤炭和木炭均可还原铁的氧化物
5.(2022·吉林延边·统考一模)下列实验能达到实验目的的是
选项
实验内容
实验目的
A
将CuCl2•2H2O晶体置于坩埚中加热
制备CuCl2固体
B
加热氯化铵和氢氧化钙的混合物,并将产生的气体通过装有碱石灰的干燥管
制取氨气并干燥
C
向FeCl2溶液中滴加酸性高锰酸钾溶液
证明Fe2+具有还原性
D
向装有亚硫酸钠白色固体粉末的圆底烧瓶中加入浓硫酸,用排饱和亚硫酸钠溶液的方法收集气体
制取并收集二氧化硫
A.A B.B C.C D.D
6.(2022·吉林四平·统考模拟预测)下列转化不能通过一步实现的是( )
A.FeFe3O4 B.AlNaAlO2
C.CuCuSO4 D.CuCuS
7.(2021·吉林松原·统考模拟预测)下列离子反应方程式正确的是
A.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3Fe+2NO+8H+=3Fe2++2NO↑+4H2O
B.CuSO4与过量浓氨水反应的离子方程式:Cu2++2NH3·H2O=Cu(OH)2↓+2NH
C.向硫酸铝铵溶液滴加足量的氢氧化钡溶液:Al3++2SO+2Ba2++4OH-=AlO+2BaSO4↓+2H2O
D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO刚好沉淀完全:2H++SO+Ba2++2OH-=2H2O+BaSO4↓
8.(2021·吉林·统考三模)化学与人类生产、生活密切相关。下列说法错误的是
A.疫情期间“网课”是主要学习方式,网络光缆是利用光导纤维传输信号,光导纤维的主要成分是晶体硅
B.驰援武汉首次使用我国自主研发大飞机“运20”,其机身材料采用了大量低密度高强度的铝锂合金
C.2022年北京冬奥会吉祥物“冰墩墩”使用的聚乙烯属于高分子材料
D.白居易的《问刘十九》中“绿蚁新醅酒,红泥小火炉”,优质红泥明亮且橙中略带红光,是因其含有含量较高的氧化铁
9.(2021·吉林·统考二模)下列有关物质的性质与用途具有对应关系的是
A.硫酸铁易溶于水,可用作净水剂
B.次氯酸具有弱酸性,可用作漂白剂
C.氧化钙能与水反应,可用作食品干燥剂
D.晶体硅熔点高,可用作半导体材料
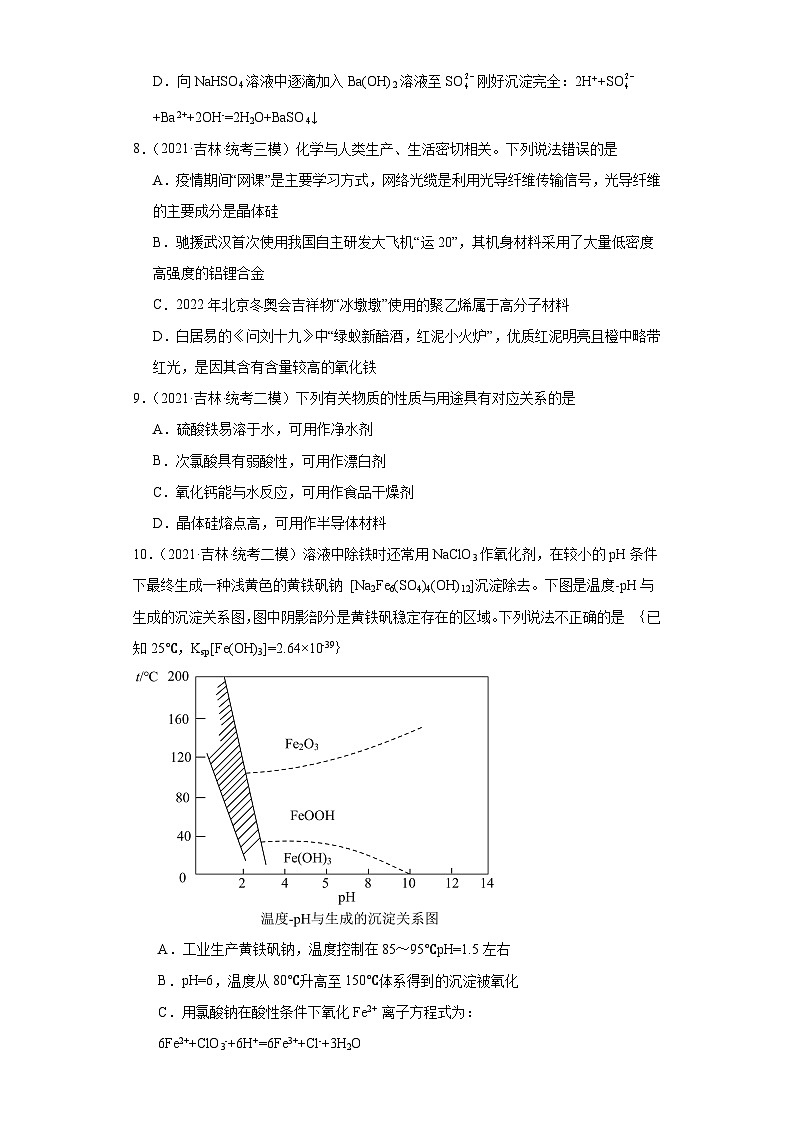
10.(2021·吉林·统考二模)溶液中除铁时还常用NaClO3作氧化剂,在较小的pH条件下最终生成一种浅黄色的黄铁矾钠 [Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域。下列说法不正确的是 {已知25℃,Ksp[Fe(OH)3]=2.64×10-39}
A.工业生产黄铁矾钠,温度控制在85~95℃pH=1.5左右
B.pH=6,温度从80℃升高至150℃体系得到的沉淀被氧化
C.用氯酸钠在酸性条件下氧化Fe2+ 离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
D.在25℃时溶液经氧化,调节溶液pH=4 ,此时溶液中c(Fe3+)=2.64×10-9 mol·L-1
二、工业流程题
11.(2022·吉林长春·统考三模)一种以钛铁矿(FeTiO3,含Fe2O3、CaO、SiO2等杂质)为主要原料制备钛白粉(TiO2)的工艺流程如图所示。
已知:①H2TiO3不溶于水和稀酸;
②“酸浸”后钛元素主要以TiO2+形式存在;
③Fe3+在pH=1.8时生成沉淀,pH=4.1时沉淀完全。
回答下列问题:
(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,其目的是 。
(2)“酸浸”时,FeTiO3发生反应的化学方程式为 。
(3)滤渣①的主要成分是 (填化学式)。
(4)流程中加入铁粉的目的是还原体系中的Fe3+。为探究最佳反应条件,某化学兴趣小组在保持反应时间相同的情况下进行探究得到结果如下图所示。
①保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH变化如图甲所示。试分析M点以后体系中Fe(Ⅲ)含量随着pH增大而增大的原因是 。
②保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度变化如图乙所示。由图可知,还原体系中Fe(Ⅲ)的最佳反应温度为 ℃。
(5)经处理后,流程中可循环利用的物质除Fe外,还有 (填化学式)。
(6)如图丙为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为 ,产生的气体中X的化学式为 。
12.(2021·吉林·统考模拟预测)三氧化二钴(Co2O3)主要用作颜料、釉料、磁性材料、催化剂和氧化剂等。用某工业含钴废料(主要成分为Co2O3,含有少量PbO、NiO、FeO、SiO2) 制备Co2O3和Ni(OH)2的流程如下。
回答下列问题:
(1)滤渣2的主要成分是 (填化学式);检验其中阳离子可选用的化学试剂为 。
(2)实验室中进行操作X用到的硅酸盐仪器除酒精灯外还有 、 ;萃取分离用到的仪器是 。
(3)“酸浸”时不使用盐酸酸化的原因 。
(4)“酸浸”时H2O2的作用是 。
(5)“沉镍”时发生反应的离子方程式为 ;此步骤需加热,温度不能太高也不能太低的原因是 。
三、实验题
13.(2022·吉林四平·统考模拟预测)绿矾(FeSO4·7H2O)外观为半透明蓝绿色单斜结晶或颗粒,无气味。受热能分解,且在空气中易被氧化。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
甘氨酸(NH2CH2COOH)
柠檬酸
甘氨酸亚铁
易溶于水,微溶于乙醇,两性化合物
易溶于水和乙醇,有强酸性和还原性
易溶于水,难溶于乙醇
(1)向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为 。
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是 。
②洗涤操作,选用的最佳洗涤试剂是 (填序号)。
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2OFe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
(1)加热前通入氮气的目的是 。
(2)实验中观察到装置B现象为 。
(3)C装置和D装置能否调换 (填“能”或“否”)。
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是 。
(5)该装置有个明显缺陷是 。
III.测定绿矾样品中铁元素的含量。
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L−1 KMnO4溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4−+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为 (用含m、c的式子表示)。
14.(2021·吉林·统考二模)2019年人教版新教材《化学必修1》新增了“研究与实践”栏目,在“检验食品中铁元素”的研究实践中设置了菠菜中铁元素的检测。某实验小组对菠菜中的铁元素(主要以难溶的FeC2O4形式存在)进行检测。实验如下:
I.水煮检验法:
II.灼烧检验法:
(1)CCl4的作用为 。
(2)操作i中起分离作用的仪器名称为 。
(3)溶液A中未能检测出Fe2+的可能原因是 。
(4)取无色溶液B,先滴加H2O2溶液,再滴加KSCN溶液,溶液呈红色。用离子方程式表示H2O2的作用: 。
(5)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,理由是 。
(6)菠菜中铁元素的含量可以用mg/100g表达,即每100g菠菜中含铁元素的含量是多少mg。Fe2+可以通过KMnO4标准溶液进行滴定的方法来测定,准确称取500.0g菠菜样品,充分燃烧成灰后,经处理后将所得溶液转移到250ml容量瓶中并定容;从中取出25.00 mL待测液置于锥形瓶中,再用2.000×10-4mol·L-1 KMnO4标准溶液进行滴定,当滴入20.00 mL KMnO4溶液时恰好完全反应。菠菜中铁元素的含量为 mg/100g。(保留3位有效数字)
四、元素或物质推断题
15.(2022·吉林·校联考模拟预测)红色固体X由两种元素组成,为探究其组成和性质,设计了如下实验:
请回答:
(1)气体Y的一种同素异形体的分子式是 ,红褐色沉淀的化学式 。
(2)X在隔绝空气条件下受高温分解为Y和Z的化学方程式 。
(3)取黄色溶液W滴加在淀粉KI试纸上,试纸变蓝色,用离子方程式表示试纸变蓝的原因 。
参考答案:
1.C
【详解】A.溶液中的氯离子也能与酸性高锰酸钾溶液反应使溶液褪色,所以溶液褪色不能说明四氧化三铁中含有Fe(II),故A错误;
B.葡萄糖在酸性溶液中不能与新制氢氧化铜共热反应生成砖红色沉淀,故B错误;
C.碳酸氢钠溶液与偏铝酸钠溶液混合产生白色沉淀说明碳酸氢钠溶液与偏铝酸钠溶液反应生成氢氧化铝沉淀和碳酸钠,由强酸制弱酸的原理可知,偏铝酸根离子结合氢离子的能力强于碳酸根离子,故C正确;
D.向过量的硝酸银溶液中先加入少量氯化钾溶液,再加入碘化钾溶液时,溶液中只存在沉淀的生成,没发生沉淀的转化,所以无法比较氯化银和碘化银的溶度积大小,故D错误;
故选C。
2.A
【详解】A.废弃的塑料、金属、纸制品及普通玻璃均可回收利用,故A正确;
B.通过清洁煤技术减少煤燃烧污染,但不能减少CO2排放,不利于实现碳中和,故B错误;
C.在规定范围内使用食品添加剂对人体健康不会产生不良影响,故C错误;
D.纳米铁粉可以从溶液中将Cu2+、Ag+等重金属离子置换成单质,与吸附性无关,故D错误;
故选:A。
3.A
【详解】A.侯氏制碱法是利用在该实验条件下NaHCO3的溶解度小促使反应发生,应用了物质溶解度的差异,A正确;
B.光导纤维主要成分为二氧化硅,二氧化硅可以和碱、HF反应,B错误;
C.染整技艺中去除丝胶所用的纯碱水溶液是溶液,属于混合物,C错误;
D.赤铁矿的主要成分为Fe2O3,不是FeO,D错误;
故答案选A。
4.D
【详解】A.生铁是铁合金,属于混合物,生铁的含碳量为2%~4.3%,熟铁指的是钢,也是铁合金,属于混合物,钢的含碳量为0.03%~2%, 选项A错误;
B.治铁过程中CO与铁的氧化物反应生成铁和CO2属于氧化还原反应,选项B错误;
C.铁炭和炊炭不互为同素异形体,铁炭指铁合金,为混合物,选项C错误;
D.治铁用到的煤炭和木炭均可还原铁的氧化物,使其还原为铁单质,选项D正确;
答案选D。
5.B
【详解】A.CuCl2溶液在加热时,会水解形成Cu(OH)2和HCl,由于氯化氢的挥发,得到氢氧化铜,灼烧Cu(OH)2,得到的是氧化铜,A错误;
B.加热氯化铵和氢氧化钙的混合物,产生的气体是氨气,氨气为碱性气体,通过装有碱石灰的干燥管可以得到干燥的氨气,B正确;
C.Cl-也具有还原性,因此如果高锰酸钾溶液褪色,也不能说明一定是Fe2+的还原性造成的,C错误;
D.向装有亚硫酸钠白色固体粉末的圆底烧瓶中加入浓硫酸,生成二氧化硫,二氧化硫与饱和亚硫酸钠溶液反应,应用排饱和亚硫酸氢钠溶液来收集二氧化硫,D错误;
答案选B。
6.D
【详解】A.Fe与氧气反应生成四氧化三铁,可一步实现转化,故A正确;
B.Al与NaOH溶液反应生成偏铝酸钠和氢气,可一步实现转化,故B正确;
C.Cu与浓硫酸加热反应生成硫酸铜,可一步实现转化,故C正确;
D.S具有弱氧化性,与Cu反应生成Cu2S,则Cu与S不能一步转化为CuS,故D错误;
答案选D。
【点睛】只有强氧化剂(如:氯气)能使变价金属在氧化还原反应中转化为最高价。氧化剂较弱的只能生成低价态的金属离子。
7.A
【详解】A.当n(Fe):n(HNO3)=1:4时,发生反应Fe+NO+4H+=Fe3++NO↑+2H2O,再增加1倍的Fe时,2Fe3++Fe=3Fe2+,铁过量,故A正确;
B.CuSO4与过量浓氨水反应Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,故B错误;
C.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液,离子反应方程式为NH +Al3++2SO+2Ba2++5OH-= AlO+2BaSO4↓+NH3·H2O+ 2H2O,故C错误;
D.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO刚好沉淀完全:H++ SO+Ba2++OH-=H2O+BaSO4↓,故D错误;
选A。
8.A
【详解】A.网络光缆的主要成分是二氧化硅,选项A错误;
B.铝锂合金由于强度高、密度小,被广泛用于航空领域,选项B正确;
C.聚乙烯塑料属于塑料,是一种合成有机高分子材料,选项C正确;
D.优质红泥明亮且橙中略带红光,是因其含有含量较高的氧化铁,氧化铁也叫铁红,选项D正确;
答案选A。
9.C
【详解】A. 硫酸铁水解形成氢氧化铁胶体,可用作净水剂,性质与用途不对应,故A错误;
B. 次氯酸具有氧化性,可用作漂白剂,性质与用途不对应,故B错误;
C. 氧化钙能与水反应,可用作食品干燥剂,故C正确;
D. 晶体硅有单向导电性,可用作半导体材料,性质与用途不对应,故D错误;
故答案选:C。
10.B
【详解】A. 由图像可知,生成黄铁矾钠所需要的合适温度为85℃~95℃,pH=1.5左右,故A正确,
B.根据图像,pH=6温度从80℃升高至150℃,FeOOH分解成Fe2O3,沉淀没有被氧化,故B错误;
C. ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应,反应的离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,故C正确;
D.25℃ pH=4时,c(OH-)=1×10-10mol/L,Fe(OH)3的Ksp=2.64×10-39,则c(Fe3+)=2.64×10-39÷(1×10-10)3=2.64×10-9(mol/L),故D正确;
答案为B。
11.(1)增大接触面积,使反应充分,提高反应速率和Ti的浸出率
(2)FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
(3)Fe、SiO2和CaSO4
(4) pH增大,溶液中的c(OH-)增大,则容易生成Fe(OH)2沉淀,而Fe(OH)2极易被空气中的O2氧化为Fe(OH)3,导致体系中Fe(Ⅲ)含量随着pH增大而增大 55℃
(5)H2SO4
(6) TiO2+4e-=Ti+2O2- CO
【分析】本题为工艺流程题,向钛铁矿中加入足量的硫酸溶液,发生反应有:Fe2O3+ 3H2SO4=Fe2(SO4)3+3H2O、FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O、CaO+H2SO4=CaSO4+H2O,加入铁粉将Fe3+还原为Fe2+,过滤得滤渣①,主要成分为:Fe、SiO2和CaSO4,滤液①主要成分为FeSO4、TiOSO4,冷却结晶析出FeSO4·7H2O晶体,过滤出滤渣②主要成分是FeSO4·7H2O晶体,和滤液②主要成分是TiOSO4,加热促进TiOSO4水解生成H2TiO3沉淀,反应原理为:TiOSO4+2H2O=H2SO4+H2TiO3↓,过滤得滤液③主要成分为H2SO4和H2TiO3,将H2TiO3灼烧得到TiO2,据此分析解题。
【详解】(1)“酸浸”时,常将钛铁矿粉碎,并进行搅拌,以增大接触面积,使反应充分,提高反应速率和Ti的浸出率,故答案为:增大接触面积,使反应充分,提高反应速率和Ti的浸出率;
(2)由分析可知,“酸浸”时,FeTiO3发生反应的化学方程式为FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O,故答案为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;
(3)由分析可知,滤渣①的主要成分是Fe、SiO2和CaSO4,故答案为:Fe、SiO2和CaSO4;
(4)①保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH变化如图甲所示。试分析M点以后体系中Fe(Ⅲ)含量随着pH增大而增大的原因是pH增大,溶液中的c(OH-)增大,则容易生成Fe(OH)2沉淀,而Fe(OH)2极易被空气中的O2氧化为Fe(OH)3,导致体系中Fe(Ⅲ)含量随着pH增大而增大,故答案为:pH增大,溶液中的c(OH-)增大,则容易生成Fe(OH)2沉淀,而Fe(OH)2极易被空气中的O2氧化为Fe(OH)3,导致体系中Fe(Ⅲ)含量随着pH增大而增大;
②保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度变化如图乙所示,由图可知,55℃是体系中Fe(Ⅲ)含量最低,故还原体系中Fe(Ⅲ)的最佳反应温度为55℃,故答案为:55℃;
(5)由分析可知,经处理后,流程中可循环利用的物质除Fe外,还有滤液③主要成分为H2SO4,故答案为:H2SO4;
(6)如图丙为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛,由题干图示可知,阴极发生还原反应,则阴极的电极反应式为TiO2+4e-=Ti+2O2-,阳极电极反应为:2O2--4e-=O2↑,C+O2CO2,CO2+C2CO,则产生的气体中X的化学式为CO,故答案为:TiO2+4e-=Ti+2O2-;CO。
12. Fe(OH)3 KSCN(写“NH4SCN”“苯酚”“亚铁氰化钾”也可以) 坩埚 泥三角 分液漏斗 盐酸会被Co2O3氧化为氯气污染空气,无法除尽Pb2+ 作氧化剂将Fe2+氧化为Fe3+,作还原剂将Co3+还原为Co2+ Ni2++2HCO=NiCO3↓+CO2↑+H2O 温度太低反应速率太慢,温度太高分解
【分析】由题给流程可知,向工业废料中加入硫酸和双氧水,酸性条件下,氧化钴与双氧水发生氧化还原反应生成亚钴离子,氧化亚铁与双氧水发生氧化还原反应生成铁离子,氧化亚镍溶于硫酸生成亚镍离子,PbO转化为硫酸铅沉淀,二氧化硅不溶解,过滤得到含有氢离子、亚钴离子、铁离子、亚镍离子的酸浸液;调节酸浸液的pH,铁离子转化为氢氧化铁沉淀,过滤得到含有亚钴离子、亚镍离子的滤液;向滤液中加入萃取剂,萃取分液得到含有亚钴离子的水相和含有亚镍离子的有机相;向水相中加入氨水,亚钴离子离子转化为Co2(OH)2CO3沉淀,高温煅烧,Co2(OH)2CO3与空气中的氧气发生氧化还原反应生成氧化钴、二氧化碳和水。含有亚镍离子的有机相进行反萃取得到含亚镍离子的水溶液,加入碳酸氢铵沉镍生成NiCO3,硫酸溶解得到NiSO4,最后加入氢氧化钠得到Ni(OH)2,据此解答。
【详解】(1)根据以上分析可知调节pH沉淀铁离子,则滤渣2的主要成分是Fe(OH)3;铁离子可以用KSCN溶液检验,则检验其中阳离子可选用的化学试剂为KSCN溶液。
(2)操作X是煅烧,实验室中进行操作X用到的硅酸盐仪器除酒精灯外还有坩埚、泥三角;萃取分离用到的仪器是分液漏斗。
(3)由于盐酸会被Co2O3氧化为氯气污染空气,无法除尽Pb2+,所以“酸浸”时不使用盐酸酸化。
(4)根据以上分析可知“酸浸”时H2O2的作用是作氧化剂将Fe2+氧化为Fe3+,作还原剂将Co3+还原为Co2+。
(5)“沉镍”时根据原子守恒可知还有二氧化碳和水生成,则发生反应的离子方程式为Ni2++2HCO=NiCO3↓+CO2↑+H2O;由于温度太低反应速率太慢,温度太高分解,所以此步骤加热时温度不能太高也不能太低。
13. Fe2++2HCO3−=FeCO3↓+CO2↑+ H2O 防止二价铁被氧化 B 将装置内空气排尽(或隔绝空气或防止Fe2+被氧化) 白色粉末变蓝 否 取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3 没有尾气处理装置
【分析】Ⅰ(1)FeCl2溶液中,加入NH4HCO3,可以认为Fe2+结合HCO3-电离出来的CO32-,H+与HCO3-结合生成CO2和水;
(2)柠檬酸除了酸性还有还原性,可以起到防氧化的作用;
(3)产物易溶于水,难溶于乙醇,洗涤时,为了防止溶解损失,应该用乙醇洗涤;
Ⅱ绿矾分解,其产物中有SO2、SO3和水,
用无水硫酸铜验证水,用BaCl2溶液验证SO3,品红溶液验证SO2。
【详解】Ⅰ(1) FeCl2溶液中,加入NH4HCO3,可以认为Fe2+结合HCO3-电离出来的CO32-,H+与HCO3-结合生成CO2和水,离子方程式为Fe2++2HCO3−=FeCO3↓+CO2↑+ H2O;
(2)根据表中信息,柠檬酸除了酸性还有还原性,可以起到防氧化的作用,因此另一个作用是防止二价铁被氧化;
(3)甘氨酸亚铁易溶于水,难溶于乙醇,为了防止溶解损失,可以用乙醇洗涤,答案选B;
II(1)加热前通氮气,排除装置中的空气,防止样品,加热是被氧化;
(2)产物中有水,无水硫酸铜,遇到水蒸气,变蓝色;
(3)SO3会溶于水,生成H2SO4,如果C、D装置调换位置,SO3会溶于品红溶液,不能进入C中,被检验到;
(4)检验Fe2O3,可以检验Fe3+,用KSCN溶液,方法为取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3;
(5)品红溶液只能用于检验SO2,不能吸收SO2,SO2为有毒气体,需要进行尾气出来,该装置的缺陷是没有气体处理装置;
III根据化学方程式,可知关系式5Fe2+~MnO4−,消耗KMnO4溶液的体积为10.80mL-0.80mL=10.00mL,则n(KMnO4)=10.00mL×10-3×cmol·L-1=0.01cmol;n(Fe2+)=5n(KMnO4)=0.01cmol×5=0.05cmol;则铁元素的质量为0.05cmol×56g·mol-1=2.8cg,则晶体中铁元素的质量分数为。
14. 作萃取剂,萃取有机色素,排除对Fe2+检验的干扰 分液漏斗 FeC2O4在水中的溶解度小 在加热水煮过程中二价铁被氧化为三价铁:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O 酸性条件下,H2C2O4 和Cl-都可能将还原 2.24
【分析】(1)有机物易溶于CCl4;
(2)操作i是分离互不相容的液体;
(3)铁元素主要以难溶的FeC2O4形式存在;
(4)H2O2把Fe2+氧化为Fe3+;
(5)酸性条件下,H2C2O4 和Cl-都可能将还原;
(6)根据5Fe2++MnO+8H+ = 5Fe3+ +Mn2++4H2O进行计算。
【详解】(1)有机物易溶于CCl4,CCl4的作用为萃取剂,萃取有机色素,排除对Fe2+检验的干扰,故答案为:作萃取剂,萃取有机色素,排除对Fe2+检验的干扰;
(2)操作i是分离互不相容的液体,操作名称是分液,使用的仪器是分液漏斗,故答案为:分液漏斗;
(3)铁元素主要以难溶的FeC2O4形式存在,Fe2+的浓度小,所以溶液A中未能检测出Fe2+,故答案为:FeC2O4在水中的溶解度小;
(4)H2O2把Fe2+氧化为Fe3+,反应的离子方程式是2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O,故答案为:在加热水煮过程中二价铁被氧化为三价铁:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;
(5)用盐酸溶解菠菜灰得到的溶液B含有H2C2O4 和Cl-,酸性条件下,H2C2O4 和Cl-都可能将还原,所以滴加酸性KMnO4溶液,振荡后,溶液紫色消失,不能证明溶液B含有Fe2+,故答案为:酸性条件下,H2C2O4 和Cl-都可能将还原;
(6)由分析可知关系式为5Fe2+~MnO,滴定所用KMnO4的物质的量为,则500.0g菠菜样品所含铁元素的物质的量为,则100g新鲜菠菜中含有铁元素的质量m(Fe)= ,故答案为:2.24。
【点睛】本题重点(6),滴定计算,要注意取的量和配制的量,同时要能知道滴定反应的方程式,并且结合其关系式进行计算。
15. O3 Fe(OH)3 6Fe2O34Fe3O4+O2↑ 2I-+2Fe3+=2Fe2++I2
【分析】无色气体Y为O2,同素异形体的分子式是O3,且X中含有铁元素,结合“红褐色”沉淀灼烧后能得到X,可以推断得到X为氧化铁,再根据X分解得到Y与Z的量的关系可知,Z为Fe3O4,W为FeCl3,红褐色沉淀为Fe(OH)3。由于FeCl3具有较强的氧化性,所以将FeCl3溶液滴加在淀粉KI试纸上时会有I2生成,而使试纸变蓝色,据此分析解答。
【详解】无色气体Y为O2,同素异形体的分子式是O3,且X中含有铁元素,结合“红褐色”沉淀灼烧后能得到X,可以推断得到X为氧化铁,再根据X分解得到Y与Z的量的关系可知,Z为Fe3O4,W为FeCl3,红褐色沉淀为Fe(OH)3;由于FeCl3具有较强的氧化性,所以将FeCl3溶液滴加在淀粉KI试纸上时会有I2生成,而使试纸变蓝色,
(1)无色气体Y为O2,其同素异形体的分子式是O3;红褐色沉淀为Fe(OH)3;
故答案为:O3;Fe(OH)3;
(2)X为Fe2O3,Y为O2,Z为Fe3O4,Fe2O3在隔绝空气条件下受热高温分解为Fe3O4和O2,化学反应方程式为6Fe2O34Fe3O4+O2↑;
故答案为:6Fe2O34Fe3O4+O2↑;
(3)W为FeCl3,FeCl3具有较强的氧化性,能将KI氧化为I2,试纸变蓝色,反应的离子方程式为2I-+2Fe3+=2Fe2++I2;
故答案为:2I-+2Fe3+=2Fe2++I2。
【点睛】本题中学生们由于不按要求作答造成失分,有两点:
①第(1)问经常会出现学生将化学式写成名称;②第(3)问错将离子方程式写成化学方程式;学生们做题时一定要认真审题,按要求作答,可以用笔进行重点圈画,作答前一定要看清是让填化学式还是名称,让写化学方程式还是离子方程式。学生们一定要养成良好的审题习惯,不要造成不必要的失分。
新疆高考化学三年(2021-2023)模拟题汇编-09铁及其化合物: 这是一份新疆高考化学三年(2021-2023)模拟题汇编-09铁及其化合物,共20页。试卷主要包含了单选题,工业流程题,实验题等内容,欢迎下载使用。
河南高考化学三年(2021-2023)模拟题汇编-13铁及其化合物: 这是一份河南高考化学三年(2021-2023)模拟题汇编-13铁及其化合物,共26页。试卷主要包含了单选题,实验题,工业流程题等内容,欢迎下载使用。
山西高考化学三年(2021-2023)模拟题汇编-08铁及其化合物: 这是一份山西高考化学三年(2021-2023)模拟题汇编-08铁及其化合物,共12页。试卷主要包含了单选题,实验题,工业流程题,元素或物质推断题等内容,欢迎下载使用。












