吉林高考化学三年(2021-2023)模拟题汇编-12水溶液中的离子反应和平衡
展开吉林高考化学三年(2021-2023)模拟题汇编-12水溶液中的离子反应和平衡
一、单选题
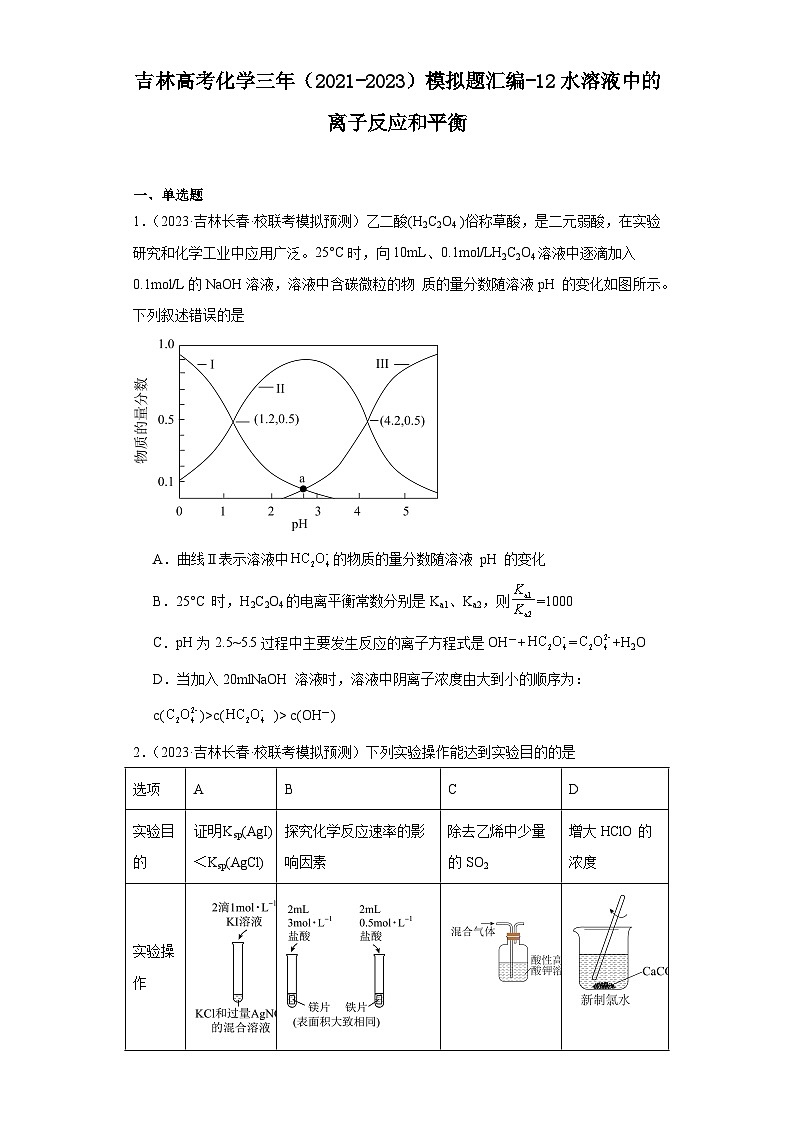
1.(2023·吉林长春·校联考模拟预测)乙二酸(H2C2O4 )俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。25°C时,向10mL、0.1mol/LH2C2O4溶液中逐滴加入0.1mol/L的NaOH溶液,溶液中含碳微粒的物 质的量分数随溶液pH 的变化如图所示。下列叙述错误的是
A.曲线Ⅱ表示溶液中的物质的量分数随溶液 pH 的变化
B.25°C 时,H2C2O4的电离平衡常数分别是Ka1、Ka2,则=1000
C.pH为2.5~5.5过程中主要发生反应的离子方程式是OH-+=+H2O
D.当加入20mlNaOH 溶液时,溶液中阴离子浓度由大到小的顺序为:c()>c( )> c(OH-)
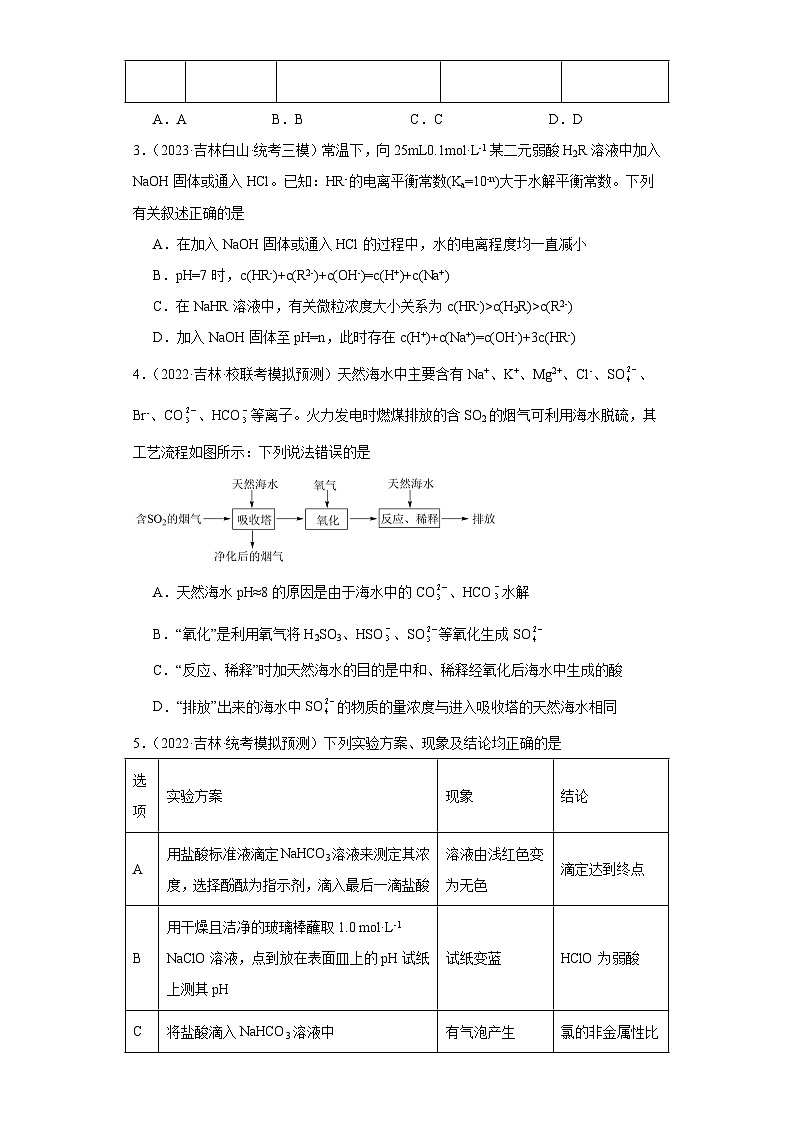
2.(2023·吉林长春·校联考模拟预测)下列实验操作能达到实验目的的是
选项
A
B
C
D
实验目的
证明Ksp(AgI)<Ksp(AgCl)
探究化学反应速率的影响因素
除去乙烯中少量的SO2
增大HClO的浓度
实验操作
A.A B.B C.C D.D
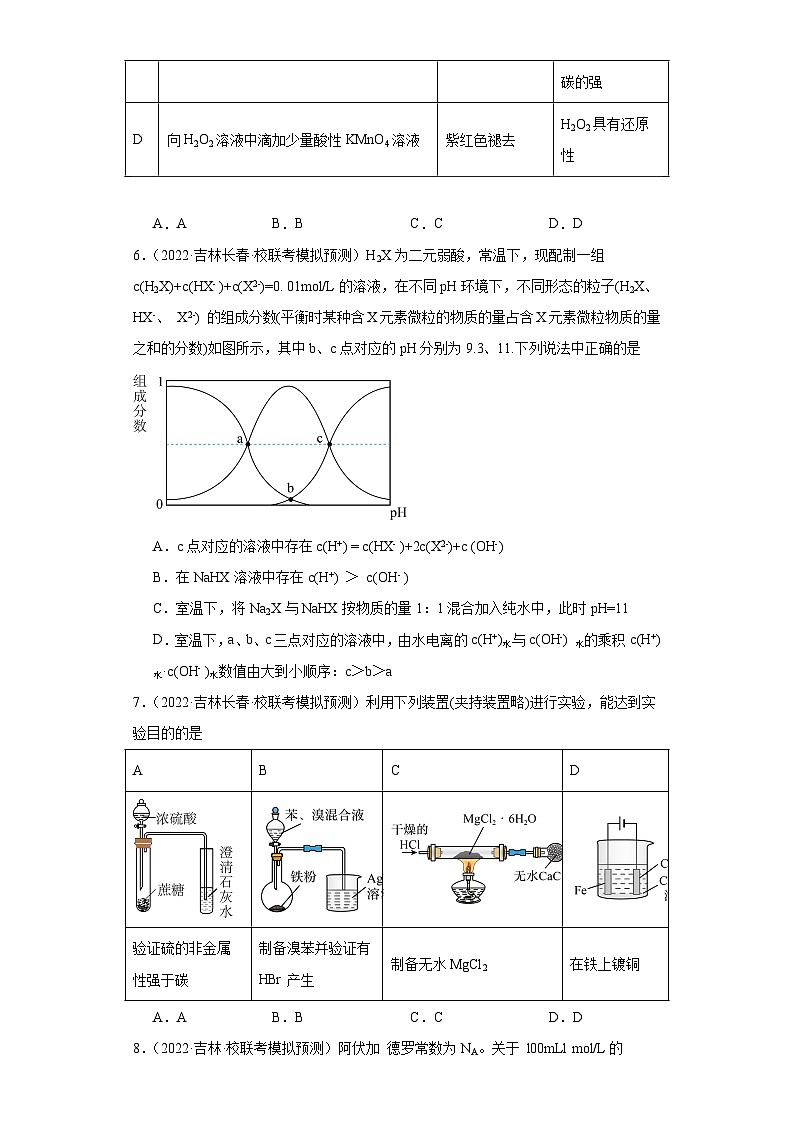
3.(2023·吉林白山·统考三模)常温下,向25mL0.1mol·L-1某二元弱酸H2R溶液中加入NaOH固体或通入HCl。已知:HR-的电离平衡常数(Ka=10-n)大于水解平衡常数。下列有关叙述正确的是
A.在加入NaOH固体或通入HCl的过程中,水的电离程度均一直减小
B.pH=7时,c(HR-)+c(R2-)+c(OH-)=c(H+)+c(Na+)
C.在NaHR溶液中,有关微粒浓度大小关系为c(HR-)>c(H2R)>c(R2-)
D.加入NaOH固体至pH=n,此时存在c(H+)+c(Na+)=c(OH-)+3c(HR-)
4.(2022·吉林·校联考模拟预测)天然海水中主要含有Na+、K+、Mg2+、Cl-、SO、Br-、CO、HCO等离子。火力发电时燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:下列说法错误的是
A.天然海水pH≈8的原因是由于海水中的CO、HCO水解
B.“氧化”是利用氧气将H2SO3、HSO、SO等氧化生成SO
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧化后海水中生成的酸
D.“排放”出来的海水中SO的物质的量浓度与进入吸收塔的天然海水相同
5.(2022·吉林·统考模拟预测)下列实验方案、现象及结论均正确的是
选项
实验方案
现象
结论
A
用盐酸标准液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂,滴入最后一滴盐酸
溶液由浅红色变为无色
滴定达到终点
B
用干燥且洁净的玻璃棒蘸取1.0 mol·L-1 NaClO溶液,点到放在表面皿上的pH试纸上测其pH
试纸变蓝
HClO为弱酸
C
将盐酸滴入NaHCO3溶液中
有气泡产生
氯的非金属性比碳的强
D
向H2O2溶液中滴加少量酸性KMnO4溶液
紫红色褪去
H2O2具有还原性
A.A B.B C.C D.D
6.(2022·吉林长春·校联考模拟预测)H2X为二元弱酸,常温下,现配制一组c(H2X)+c(HX- )+c(X2-)=0. 01mol/L的溶液,在不同pH环境下,不同形态的粒子(H2X、HX-、 X2-) 的组成分数(平衡时某种含X元素微粒的物质的量占含X元素微粒物质的量之和的分数)如图所示,其中b、c点对应的pH分别为9.3、11.下列说法中正确的是
A.c点对应的溶液中存在c(H+) = c(HX- )+2c(X2-)+c (OH-)
B.在NaHX溶液中存在c(H+) > c(OH- )
C.室温下,将Na2X与NaHX按物质的量1:1混合加入纯水中,此时pH=11
D.室温下,a、b、c三点对应的溶液中,由水电离的c(H+)水与c(OH-) 水的乘积c(H+)水·c(OH- )水数值由大到小顺序:c>b>a
7.(2022·吉林长春·校联考模拟预测)利用下列装置(夹持装置略)进行实验,能达到实验目的的是
A
B
C
D
验证硫的非金属性强于碳
制备溴苯并验证有HBr产生
制备无水MgCl2
在铁上镀铜
A.A B.B C.C D.D
8.(2022·吉林·校联考模拟预测)阿伏加 德罗常数为NA。关于 l00mLl mol/L的Fe2(SO4)3溶液,下列说法正确的是
A.加NaOH可制得Fe(OH)3 胶粒0.2NA
B.溶液中阳离子数目为0.2NA
C.加Na2CO3 溶液发生的反应为 3CO32-+ 2Fe3+ = Fe2(CO3 )3↓
D.Fe2(SO4)3溶液可用于净化水
9.(2022·吉林·校联考模拟预测)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)= 0时,c(W)=1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)=2 c(C2O)+ c(HC2O)
C.V(NaOH)= 10 mL时,c(W)= 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O)>c(HC2O)
10.(2021·吉林长春·统考三模)为达到下列实验目的,对应的实验装置以及相关说明均正确的是
选项
实验目的
实验装置
相关说明
A
用氯化铝溶液制备氯化铝晶体
将溶液蒸干,获得氯化铝晶体
B
提取碘水中的碘
用乙醇做萃取剂,将碘从水溶液中转移到乙醇中分离
C
实验室制乙酸乙酯
乙醇和乙酸在加热的条件下反应,饱和碳酸钠溶液上层出现油状液体
D
除去硫酸铜溶液中的Fe3+
混合溶液中加入氢氧化铜固体调节pH,使Fe3+转化为沉淀除去
A.A B.B C.C D.D
二、多选题
11.(2021·吉林长春·统考一模)常温下,向1L浓度为0.1mol/LHA溶液中逐渐加入NaOH固体的过程中,主要成分的分布分数(HA或A-占含A微粒总量的百分数)随pH的变化如图所示。忽略过程中溶液体积的变化,下列说法错误的是
A.HA的电离常数的数量级为10-5
B.pH=5.6时,溶液中
C.加入NaOH固体的质量为2.0g时,溶液的pH>7
D.pH=7时,溶液中c(Na+)=c(A-)
三、工业流程题
12.(2023·吉林白山·统考模拟预测)稳定的[Co(NH3)6]Cl3常用于制备钴的高效催化剂,制备条件(催化剂、温度等)不同,其组成不同,例如[Co(NH3)6]Cl3 (橙黄色)、[Co(NH3 )5H2O]Cl3 (紫红色)等。某小组拟制备三氯六氨合钴{[Co(NH3)6]Cl3 }并测定其纯度。
实验一:制备[Co(NH3)6]Cl3产品。
(1)配合物[Co(NH3)6]Cl3中 (填名称,下同)提供空轨道, 提供孤对电子 。
(2)步骤③中发生反应的离子方程式为 。步骤⑥中,2 mL浓盐酸的作用是 。
(3)步骤⑤⑧两次调节温度为275 K的目的为 ;完成步骤⑦所用的仪器如图,步骤⑦不使用普通漏斗的原因是 。
实验二:测定[Co(NH3)6]Cl3产品纯度。
氧化还原滴定法测得产品中Co3+的含量。实验原理如下:
[Co(NH3)6]Cl3 +3NaOH=Co(OH)3 ↓+6NH3↑+3NaCl
2Co(OH)3+ 6HCl+2KI=2CoCl2 + I2 + 2KCl+6H2O
I2 +2Na2S2O3=2NaI+Na2S4O6
实验步骤:
①准确称取w B样品于锥形瓶中,加入20 mL去离子水完全溶解,然后加10 mL 10%NaOH溶液(过量),在电炉上加热至无NH3逸出(用pH试纸检验) ,冷却溶液。
②将溶液转移至碘量瓶中,加入20 mL去离子水及足量的KI溶液和6 mol· L-1盐酸,立即盖上盖子并摇匀,放暗处静置10 min左右。
③滴3滴指示剂X,用c mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液的体积为V mL。
(4)指示剂X是 。
(5)滴定终点的现象是 。
(6)该样品的纯度为 。若滴定时间过长,将导致测得的结果 (填“偏高”、“偏低”或“无影响”)。
13.(2023·吉林白山·统考三模)锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:
回答下列问题:
(1))在该流程中可循环使用的物质是Zn和H2SO4,基态S原子占据最高能级的原子轨道的形状为 ,的空间结构为 。
(2)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式: ;“ 含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的= 。[已知:Ka1 (H2SO3)=l.4×10-2;Ka2(H2SO3)=6. 0×10-8]
(3)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为 (填化学式),分离“滤液”'“滤渣”的操作名称为 。
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是 (填标号)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS) :ZnS(s) +Cu2+ (aq) CuS(s)+Zn2+(aq) ,该反应的平衡常数K= 。 [已知:Ksp(ZnS)=1. 6×10-24,Ksp(CuS)=6.4×10-36]
(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2 +Zn+(1+ )H2O+ZnSO4MnOOH+ [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为 。
14.(2021·吉林四平·校联考模拟预测)锌及其化合物在生产生活中应用比较广泛。
(1)ZnFe2O4是一种性能优良的软磁材料,也是一种催化剂,能催化烯类有机物氧化脱氢等反应。
①ZnFe2O4中Fe的化合价是 。
②工业上利用反应ZnFe2(C2O4)3·6H2OZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4,该反应中还原产物是 (填化学式),每生成1 molZnFe2O4转移的电子总数是 。
(2)业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等杂质)制取金属锌的工艺流程如下:
①酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是 (任答一条)。写出ZnFe2O4溶于酸的离子方程式 。
②净化I中H2O2参与反应的离子方程式为 。
③净化II中Y的主要成分是 (填化学式)。
(3)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示:
①pH=3时溶液中铜元素的主要存在形式是
②若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH 。
A.<1 B.4左右 C.>6
15.(2021·吉林·统考三模)某油脂厂废弃的油脂加氢所用催化剂主要含金属Ni、Al、Fe及他们的氧化物,还有少量其他不溶性物质。采用如图工艺流程回收其中的镍来制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如表所示,回答下列问题:
金属离子
Ni2+
Al3+
Fe3+
Fe2+
开始沉淀时的pH
6.2
3.7
2.2
7.5
沉淀完全时的pH
8.7
4.7
3.2
9.0
(1)废弃催化剂上的油脂在 过程中被处理
(2)滤液①中含有的无机阴离子除OH-离子外还有 。
(3)“转化”过程的离子方程式 ;“转化”过程宜控制较低温度的原因是 。
(4)加NaOH溶液“调pH”应控制的pH范围是 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式 。
(6)操作I为 、 、过滤、洗涤、干燥,得到产品。
四、填空题
16.(2023·吉林·统考二模)铜及其化合物在生产、生活中有着广泛的应用。回答下列问题:
(1)纳米铜是性能优异的超导材料,工业上以辉铜矿(主要成分为)为原料制备纳米铜粉,中铜元素的化合价为 价。
(2)无水常用于检验物质中是否含有水,吸水后会形成 色晶体,俗称 。
(3)的名称为碱式碳酸铜,是铜绿、孔雀石的主要成分,受热分解可生成黑色的CuO,化学方程式为 。
(4)常用作媒染剂、杀虫剂等。Cu与稀盐酸在持续通入空气的条件下反应生成,对该反应有催化作用,其催化原理如图所示。的化学式为 。
(5)CuCl广泛应用于化工和印染等行业。在高于300℃,HCl气流中热分解可以制备CuCl,其中HCl的作用是 。
五、实验题
17.(2022·吉林长春·统考模拟预测)三草酸合铁酸钾{K3[Fe(C2O4)3]}是制备负载型活性铁催化剂的主要原料,也是一些有机反应的催化剂。具有工业生产价值。无机实验室制备三草酸合铁酸钾的原理如下:
①(NH4)2Fe(SO4)2+2H2O+H2C2O4=FeC2O4·2H2O↓+(NH4)2SO4+H2SO4
②6FeC2O4·2H2O+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3↓+12H4O
③2Fe(OH)3十3H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
(1)草酸亚铁的制备:在如图所示装置中完成反应①。称取5g硫酸亚铁铵放入锥形瓶中,加入15mL蒸馏水,2~4滴3mol/LH2SO4,然后加入25mL饱和H2C2O4溶液,加热至沸腾,静置,有黄色沉淀生成。过滤,用蒸馏水洗涤沉淀。
①实验中加入2~4滴3mol/LH2SO4的目的是 ;
②用蒸馏水洗涤沉淀的具体操作为 。
(2)三草酸合铁(III)酸钾的制备:向草酸亚铁沉淀中加入15mL饱和K2C2O4溶液,保持温度为40℃,恒温搅拌下逐滴滴加10mL6%H2O2溶液,最后逐滴加入饱和H2C2O4溶液至溶液变成亮绿色,将溶液浓缩至15mL后,冷却析出翠绿色晶体。
①仪器a的名称是 ,反应保持为40°C的原因是 ;
②逐滴加入H2O2和H2C2O4的目的是 ,为了达到该目的,还可以进行的实验操作为 。
(3)三草酸合铁(III)酸钾(M=437g/mol)含量的测定:取制得的样品mg配成溶液,加入5ml3mol/LH2SO4加热至80℃,用cmol/LKMnO4溶液滴定,消耗KMnO4溶液VmL。
①加入高锰酸钾溶液时发生反应的离子方程式为 。
②该样品的质量分数为 (写出表达式即可),测量值比实际值偏小,原因可能是 (任写一种即可)。
18.(2021·吉林长春·统考三模)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。某化学兴趣小组在实验室制取氯水和氯酸钾,并进行相关实验。
Ⅰ.用图所示实验装置制取氯水和氯酸钾
(1)图中标注装有浓盐酸的仪器名称为 ,A装置圆底烧瓶中发生反应的化学方程式为 。
(2)在确保KOH溶液完全反应的的条件下,若对调B和C装置的位置,C中氯酸钾的产率会 (填“增大”、“减小”或“不变”),原因是 。
II.测定从装置C试管中分离得到的粗产品中KClO3的质量分数(粗产品中混有的杂质是KClO和KCl);碱性条件下,ClO氧化性较弱,不能氧化H2O2。测定粗产品中KClO3的纯度的实验过程如下:
步骤 1:取3.00g 样品溶于水配成250mL溶液。
步骤 2:取 25.00mL 溶液于锥形瓶中,加KOH溶液调节pH,然后滴加过量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2 分钟,冷却。
步骤3:将溶液转移到碘量瓶中(如图),加H2SO4将溶液调至弱酸性,加过量的20%的KI溶液,加盖水封,于暗处放置5min。
步骤 4:以淀粉为指示剂,用0.1500mol·L-1Na2S2O3标准溶液滴定碘量瓶中的溶液至终点,平行操作三次,平均消耗Na2S2O3溶液20.00mL。相关反应为:
(3)步骤2中,煮沸溶液1~2分钟的目的是 。
(4)步骤3发生反应的离子方程式为: 。
(5)使用碘量瓶时,加盖水封的目的是 ,Na2S2O3标准溶液应装入 式滴定管中(填“酸”或“碱”)。
(6)粗产品中KClO3的质量分数为 (保留三位有效数字)。
参考答案:
1.D
【分析】草酸属于二元素弱酸,应分步电离H2C2O4HC2O+H+、HC2OC2O+H+,草酸溶液中加入NaOH溶液,H2C2O4物质的量浓度逐渐减小,HC2O逐渐增大,后逐渐减小,C2O逐渐增大,因此Ⅰ代表H2C2O4,Ⅱ代表HC2O,Ⅲ代表C2O,据此分析;
【详解】A.根据上述分析,Ⅱ代表HC2O物质的量分数随pH变化,故A说法正确;
B.Ka1=,电离平衡常数只受温度的影响,取(1.2,0.5)点,c(HC2O)= c(H2C2O4),因此Ka1=c(H+)=10-1.2,同理Ka2=c(H+)=10-4.2,因此=103=1000,故B说法正确;
C.pH在2.5~5.5之间,HC2O物质的量分数逐渐减少,C2O物质的量分数逐渐增大,因此该阶段发生离子方程式为HC2O+OH-=C2O+H2O,故C说法正确;
D.当加入20mL等浓度NaOH溶液,充分反应后,溶质为Na2C2O4,C2O发生水解,其水解方程式为C2O+H2O HC2O+OH-,水也要电离出OH-,因此c(OH-)>c(HC2O),水解程度微弱,c(C2O)最大,即c(C2O)>c(OH-)>c(HC2O),故D说法错误;
答案为D。
2.D
【详解】A.KCl和过量AgNO3溶液混合生成AgCl沉淀,AgNO3有剩余,再滴加2滴溶液,AgNO3和KI直接反应生成AgI沉淀,不能证明,A错误;
B.左侧试管内盐酸的浓度大、金属片的活动性强,不能判断反应速率快是由金属活动性引起的,还是由H+浓度引起的,B错误;
C.SO2、乙烯都能被酸性高锰酸钾溶液氧化,所以不能用酸性KMnO4溶液除去乙烯中混有的SO2,C错误;
D.氯水中含有盐酸、次氯酸,盐酸可与碳酸钙反应,次氯酸与碳酸钙不反应,即该操作可增大次氯酸的浓度,D正确;
故选D。
3.D
【详解】A.H2R溶液中水的电离受到抑制,往溶液中加入NaOH固体,消耗氢离子,水的电离程度增大,当NaOH过量时,水的电离受到抑制,电离程度减小,往溶液中通入HCl,溶液中氢离子浓度增大,水的电离程度一直减小,A错误;
B.pH=7时,H2R溶液中加入NaOH固体,根据电荷守恒c(HR-)+2c(R2-)+c(OH-)=c(H+)+c(Na+),B错误;
C.HR-的电离平衡常数(Ka=10-n)大于水解平衡常数,则在NaHR溶液中,HR-的电离程度大于其水解程度,则c(HR-)>c(R2-)>c(H2R),C错误;
D.加入NaOH固体至pH=n,,,由此可得c(HR-)=c(R2-),根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(HR-)+2c(R2-)= c(OH-)+3c(HR-),D正确;
故选D。
4.D
【分析】火力发电时燃煤排放的含SO2的烟气通入吸收塔,加入天然海水,得到溶液通入氧气氧化亚硫酸生成硫酸,加入天然海水进行中和、稀释,最后排放。
【详解】A.海水中主要含有Na+、K+、Mg2+、Cl-、、Br-、、等离子,在这些离子中能发生水解的是、离子,+H2O+OH-,+H2OH2CO3+OH-它们水解呈碱性,所以天然海水的pH≈8,呈弱碱性,A正确;
B.天然海水吸收了含硫烟气后,要用O2进行氧化处理,因为氧气具有氧化性,被氧化的硫元素的化合价为+4价,具有还原性,所以氧气将H2SO3、、等氧化为硫酸根离子,如亚硫酸被氧化的反应为2H2SO3+O2=2H2SO4,B正确;
C.氧化后的“海水”需要用大量的天然海水与之混合后才能排放,是因中和稀释经氧气氧化后海水中生成的酸(H+),C正确;
D.从框图可知:排放出来的海水,是经过加天然海水中和、稀释经氧化后海水中生成的酸后排放的,溶液的体积显然比进入吸收塔的天然海水大,所以的物质的量浓度排放出来的海水中浓度小,D错误;
故答案选D。
5.D
【详解】A.酚酞作指示剂,用HCl溶液滴定NaHCO3溶液时生成NaCl和碳酸,溶液呈酸性,不能使用酚酞做指示剂,故A错误;
B.次氯酸钠溶液有水解产生的次氯酸,具有漂白性,无法使用pH试纸测定pH,故B错误;
C.盐酸与NaHCO3溶液反应生成NaCl和水和二氧化碳,可说明盐酸的酸性比碳酸强,但盐酸不是氯元素的最高价含氧酸,不能比较氯和碳的非金属性强弱,故C错误;
D.酸性KMnO4溶液紫红色褪去是由于H2O2与KMnO4发生氧化还原反应生成Mn2+和O2,H2O2做还原剂,具有还原性,故D正确;
故选:D。
6.D
【分析】假设加入NaOH来调节溶液的pH值,则随着NaOH的加入,c(H2A)逐渐减小,c(HA-)逐渐增大,则从左往右曲线分别代表H2A、 HA-和A2-,据此分析解题。
【详解】A.根据电荷守恒可知,c点对应的溶液中存在c(H+) +c(Na+)= c(HX- )+2c(X2-)+c(OH-),A错误;
B.由图示信息可知,b点对应的溶液中HX-最大,pH=9.3,所以NaHX溶液显碱性,即在NaHX溶液中存在c(H+)<c(OH- ),B错误;
C.由图示信息可知,当c(X2-)=c(HX-)时即c点,溶液pH=11,说明Ka(HX-)小于Kh(X2-),故室温下,将Na2X与NaHX按物质的量1:1混合加入纯水中,c(HX-)≠c(X2-),即此时溶液的pH≠11,C错误;
D.a→b→c过程中,溶液的酸性逐渐减弱,对水电离的抑制程度也逐渐减弱,同时HX-、X2-浓度促进增大,HX-、X2-的水解程度即对水的电离的促进作用逐渐加强,故室温下,a、b、c三点对应的溶液中,由水电离的c(H+)水与c(OH-) 水的乘积c(H+)水·c(OH- )水数值由大到小顺序:c>b>a,D正确;
故答案为:D。
7.C
【详解】A.实验中蔗糖变黑,接着变得疏松多孔,同时澄清石灰水变浑浊,说明浓硫酸具有脱水性和强氧化性,同时产生SO2,但不能说明产生CO2,也不能验证硫的非金属性强于碳,A不合题意;
B.由于液溴易挥发,挥发出的液溴能与水反应生成HBr,同样可以观察到AgNO3溶液中生成淡黄色沉淀,即不能验证有HBr产生,B不合题意;
C.由于MgCl2易发生水解,水解产物HCl易挥发,从而促进其水解,故需要在HCl的气流中加热蒸发MgCl2·6H2O来制备无水MgCl2,C符合题意;
D.在铁上镀铜,铁接电源的负极作阴极,铜接电源的正极作阳极,D不合题意;
故答案为:C。
8.D
【详解】A. Fe2(SO4)3加NaOH反应生成Fe(OH)3沉淀,而不是胶粒,故A错误;
B. l00mL l mol/L的Fe2(SO4)3溶液中n[Fe2(SO4)3] =1 mol∙L−1 ×0.1L =0.1mol,n(Fe3+)=0.2mol,铁离子水解 Fe3+ + 3H2O Fe(OH)3 + 3H+,根据水解方程式得到溶液中阳离子数目大于0.2NA,故B错误;
C. 加Na2CO3溶液发生双水解生成氢氧化铁沉淀和二氧化碳气体,其反应为 3CO32−+ 2Fe3+ + 3H2O =2 Fe(OH)3↓ + 3CO2↑,故C错误;
D. Fe2(SO4)3溶液水解生成胶体,胶体具有吸附杂质功能,起净水功能,因此可用于净化水,故D正确。
综上所述,答案为D。
【点睛】铁离子与碳酸根、碳酸氢根、偏铝酸根、硅酸根等离子要发生双水解反应。
9.D
【详解】草酸氢钠溶液显酸性,说明草酸氢钠的电离程度大于其水解程度。因为草酸是弱电解质,所以0.01 mol•L-1 NaHC2O4溶液中,氢离子的浓度小于0.01mol/L,A不正确;
加入氢氧化钠发生的反应为NaOH+NaHC2O4=Na2C2O4+H2O,二者恰好反应时,消耗氢氧化钠10ml。生成物草酸钠水解,溶液显碱性,C不正确;
如果氢氧化钠的体积小于10ml,则二者反应后,溶液就有可能显中性。根据电荷守恒c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-)可知,如果溶液显中性,则c(Na+)=2c(C2O42-)+c(HC2O4-),因此B也是不正确的。
当氢氧化钠大于10ml时,溶液中含有氢氧化钠和草酸钠两种溶质,由于草酸钠的水解以第一步水解为主,且氢氧化钠的存在会抑制其水解,因此选项D是正确的。
答案选D。
10.D
【详解】A.氯化铝溶液中存在水解AlCl3+3H2OAl(OH)3+3HCl,加热促进水解,同时也会促进HCl的挥发,氯化铝彻底水解,所以最终得不到氯化铝,A错误;
B.乙醇和水互溶,不能作萃取剂,B错误;
C.从试管中出来的气体有极易溶液碳酸钠溶液的醋酸、乙醇,为防止倒吸,导管不能伸入液面以下,C错误;
D.Fe3+和Cu2+产生沉淀时溶液的pH值不同,加入Cu(OH)2可以使pH增大,同时不引入新的杂质,使Fe3+转化为沉淀除去,D正确;
综上所述答案为D。
11.C
【分析】根据溶液中主要成分的分布分数(HA或A-占含A微粒总量的百分数)随pH的变化情况可知,HA为弱酸,根据HAH++A-可知,其电离平衡常数Ka=,当HA与A-的分布分数均为0.5时,对应的pH=4.7,所以可求出其Ka值为110-4.7。据此结合溶液的离子平衡分析解答。
【详解】根据上述分析可知,
A.HA的电离常数为110-4.7,其数量级为10-5,A正确;
B.从图象中可看出,pH=5.6时,,但溶液呈现酸性,所以,B正确;
C.加入NaOH固体的质量为2.0g时,其物质的量为0.05mol,与HA发生反应生成0.05molNaA,还有0.05molHA剩余,因为HA的电离平衡常数为110-4.7,可求出其水解常数为,所以因为电离程度大于相应离子的水解程度,同浓度的NaA与HA的溶液呈酸性,即pH<7,C错误;
D.溶液中存在电荷守恒,即c(Na+)+ c(H+)=c(OH-)+c(A-),所以当pH=7时,溶液中存在c(Na+)=c(A-),D正确;
故选C。
12.(1) 钴离子 氮原子
(2) 2[Co(NH3)6]2++H2O2+22[Co(NH3)6]3+ +2NH3·H2O{或2[Co(NH3)6]2++ H2O22[Co(NH3)6]3+ +2OH- 中和滤饼表面的碱性物质
(3) 使[Co(NH3)6 ]Cl3充分析出,提高产率 避免溶质析出
(4)淀粉溶液
(5)当滴入最后半滴Na2S2O3标准溶液时,碘量瓶内溶液刚好由蓝色变为无色且半分钟内不变色
(6) 偏高
【分析】与NH4Cl固体混合溶于10mL水中,反应生成,溶液中加0.2g活性炭,冷却后加14mL浓氨水反应生成,充分反应后在283K条件下加14mL6%双氧水将氧化为,继续升温至333K,持续加热20min后,降温至275K,析出晶体,抽滤,得滤饼,滤饼重新溶于50mL热水中,并加1mL浓盐酸,趁热过滤,分离出活性炭,滤液控温至275K,加7mL浓盐酸,过滤得[Co(NH3)6]Cl3。
【详解】(1)配合物[Co(NH3)6]Cl3中钴离子提供空轨道,氨分子中N原子提供孤电子对;
(2)双氧水将氧化为,反应离子方程式:2[Co(NH3)6]2++H2O2+22[Co(NH3)6]3+ +2NH3·H2O{或2[Co(NH3)6]2++ H2O22[Co(NH3)6]3+ +2OH-;步骤⑥中,2 mL浓盐酸的作用是中和滤饼表面的碱性物质。
(3)步骤⑤⑧两次调节温度为275 K的目的为使[Co(NH3)6 ]Cl3充分析出,提高产率;步骤⑦中使用保温漏斗可避免溶质析出;
(4)待测液中含有碘单质,因此可选用淀粉溶液作指示剂;
(5)滴定终点时碘单质恰好被消耗完,则滴定终点标志为:当滴入最后半滴Na2S2O3标准溶液时,碘量瓶内溶液刚好由蓝色变为无色且半分钟内不变色;
(6)由已知反应得关系式:,=cV×10-3mol,该样品的纯度为;若滴定时间过长,待测液中过量的碘离子被氧气氧化成碘单质,从而增加标准液的用量,将导致测得的结果偏高。
13.(1) 纺锤形 正四面体形
(2) 3FeS+5O2 Fe3O4 +3SO2 6× 10-3
(3) Zn、Fe 过滤
(4) A 2.5×1011
(5)MnO2 +e- + H2O=MnOOH+OH-
【分析】硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用。
【详解】(1)基态S原子的核外电子排布式为:,最高能级的原子轨道为3p轨道,形状为纺锤形,的中心S原子价层电子对数位,无孤电子对,为正四面体形结构,故答案为:纺锤形;正四面体形;
(2)已知“焙砂”中铁元素主要以Fe3O4形式存在,说明 “焙烧”过程FeS中Fe被氧化,S被还原,所以主要发生反应的化学方程式为3FeS+5O2Fe3O4 +3SO2;SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,c(H+)=1×10-5mol/L,已知Ka2(H2SO3)=6.0×10-8,所以=6×10−8,所以=6× 10-3;故答案:为3FeS+5O2Fe3O4 +3SO2;6× 10-3;
(3)浸出液“净化”过程中加入的主要物质为锌粉,过量锌充分反应,可置换出铁,所得“滤渣”的成分为Zn、Fe;过滤可分离“滤液”'“滤渣”;故答案为:Zn、Fe;过滤。
(4)①A.将稀硫酸更换为98%的浓硫酸,将发生氧化还原反应,产生二氧化硫,故A不合理;
B.将硫化锌精矿粉碎,增大接触面积,有利于快浸取反应速率,故B合理;
C.适当升高温度,有利于加快浸取反应速率,故C合理;
故答案选:A。
②反应ZnS(s)+Cu2+(aq)CuS(s)+Zn2+(aq)的平衡常数K=,已知:Ksp(ZnS)=c(Zn2+)·c(S2-)=1.6×10−24,Ksp(CuS)=c(Cu2+)·c(S2-)=6.4×10−36;所以K====2.5×1011,故答案为:2.5×1011。
(5)电池总反应为MnO2+12Zn+(1+x6)H2O+16ZnSO4MnOOH+16[ZnSO4·3Zn(OH)2·xH2O],放电时正极发生还原反应,所以电极方程式为MnO2 +e- + H2O=MnOOH+OH-;故答案为:MnO2 +e- + H2O=MnOOH+OH-。
14.(1) +3 CO 4NA(或2.408×1024)
(2) 适当增大c(H+)(或升高温度、搅拌等其他合理答案) ZnFe2O4+8H+=2Fe3++Zn2++4H2O H2O2+2Fe2++2H+=2Fe3++2H2O CuS、ZnS
(3) Cu2+ B
【分析】将锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)酸浸,发生反应ZnFe2O4+8H+=2Fe3++Zn2++4H2O、ZnO+2H+=Zn2++H2O、FeO+2H+=Fe2++H2O、CuO+2H+=Cu2++H2O,向溶液中加入双氧水,发生反应 2Fe2++2H++H2O2=2Fe3++2H2O,调节溶液的pH将Fe3+转化为Fe(OH)3沉淀,调节溶液pH时不能引进新的杂质,可以用ZnO,所以X为ZnO,然后向溶液中加入ZnS,发生反应Cu2++ZnS=Zn2++CuS,然后过滤,所以Y中含有CuS,最后电解得到Zn,据此分析解题。
【详解】(1)(1)①ZnFe2O4中Zn是+2价,O是-2价,根据化合物中正负价代数和为0可知Fe的化合价是+3价;
②反应中Fe元素化合价从+2价升高到+3价,碳元素化合价从+3价部分降低到+2价,部分升高到+4价,所以还原产物是CO;根据方程式可知每生成1 mol ZnFe2O4转移的电子的物质的量是4 mol,总数是4NA(或2.408×1024);
(2)(2)①酸浸时要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可采用的措施是增大硫酸的浓度或升高温度、搅拌等。ZnFe2O4溶于酸的离子方程式为ZnFe2O4+8H+=2Fe3++Zn2++4H2O;
②净化I中H2O2参与反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;
③由于ZnS过量,则净化Ⅱ中Y的主要成分是CuS、ZnS;
(3)(3)①由图可知,在pH=3时,不会发现Cu(OH)2沉淀,铜元素以铜离子形式存在。
②要除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右。
15. 碱浸 2Fe2++H2O2+2H+=2Fe3+ +2H2O 温度过高会导致过氧化氢分解 3.2≤pH<6.2(或3.2~6.2) 2Ni2++ClO-+4OH-=2NiOOH↓+ Cl-+H2O 蒸发浓缩 冷却结晶
【分析】由流程可知,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al2O3+4NaOH=4NaAlO2+2H2O,将Al及其氧化物溶解,得到的滤液①含有NaAlO2,滤饼①为Ni、Fe及其氧化物和少量其他不溶性杂质,加稀H2SO4酸浸后得到含有Ni2+、Fe2+、Fe3+的滤液②,Fe2+经H2O2氧化为Fe3+后,加入NaOH调节pH使Fe3+转化为Fe(OH)3沉淀除去,再控制pH浓缩结晶得到硫酸镍的晶体,以此解答该题。
【详解】(1)油脂可以在碱性环境中水解生成可溶于水的甘油和高级脂肪酸盐,所以油脂在“碱浸”过程中被处理;
(2)根据分析可知滤液①中含有的无机阴离子除OH-离子外还有铝以及氧化铝和NaOH溶液反应生成的;
(3)转化过程中发生的主要反应为双氧水氧化亚铁离子生成铁离子,根据电子守恒和元素守恒可得离子方程式为2Fe2++H2O2+2H+=2Fe3+ +2H2O;温度过高会导致过氧化氢分解,所以“转化”过程宜控制较低温度;
(4)调节pH的目的是使Fe3+完全沉淀,但不使Ni2+沉淀,根据题目所给数据可知范围为3.2≤pH<6.2(或3.2~6.2);
(5)根据题意可知碱性溶液中Ni2+被ClO-氧化为NiOOH,化合价升高1价,ClO-被还原为Cl-,根据电子守恒可知Ni2+和ClO-的系数比应为2:1,再结合元素守恒可得离子方程式为2Ni2++ClO-+4OH-=2NiOOH↓+ Cl-+H2O;
(6)操作I可以从滤液中得到硫酸镍晶体,所以为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
16.(1)+1
(2) 蓝 胆矾或蓝矾
(3)
(4)
(5)用HCl气流带走产生的水蒸气,提供酸性环境抑制水解的发生,防止CuCl被氧化
【详解】(1)中硫元素为-2价,则铜元素的化合价为+1;
(2)无水常用于检验物质中是否含有水,吸水后会形成蓝色硫酸铜晶体,俗称胆矾或蓝矾;
(3)碱式碳酸铜受热分解生成氧化铜、水、二氧化碳,;
(4)Cu与稀盐酸在持续通入空气的条件下反应生成,对该反应有催化作用,铜生成铜离子化合价升高,根据电子守恒可知,M生成中铁元素化合价降低,故为亚铁离子;
(5)氯化铜加热水解生成氢氧化铜和挥发性酸,HCl可抑制其水解,CuCl中铜具有还原性易被空气中氧气氧化,在HCl气流中热分解可以制备CuCl,其中HCl的作用是用HCl气流带走产生的水蒸气,提供酸性环境抑制水解的发生,防止CuCl被氧化。
17.(1) 抑制亚铁离子的水解 向过滤器中加蒸馏水至浸没沉淀,待水自然流下,重复2~3次
(2) 三颈烧瓶 温度过低反应速率慢,温度过高H2O2易分解 使反应充分,提高原料利用率 搅拌
(3) 滴定结束时俯视读数
【分析】硫酸亚铁利用稀硫酸溶解后加入草酸反应制备草酸亚铁,向草酸亚铁沉淀中加入草酸钾及双氧水制备三草酸合铁(III)酸钾,再通过滴定测定三草酸合铁(III)酸钾的成分。
【详解】(1)①加入2~4滴3mol/LH2SO4可抑制亚铁离子的水解;
②洗涤沉淀的具体操作为向过滤器中加蒸馏水至浸没沉淀,待水自然流下,重复2~3次;
(2)①仪器a为三颈烧瓶,保持温度为40°C的原因是温度过低反应速率慢,温度过高H2O2易分解;
②逐渐加入试剂可以使反应充分,提高原料利用率,搅拌溶液也可以加快反应速率,使反应充分;
(3)①高锰酸钾溶液与草酸根离子反应的离子方程式为;
②根据可知,消耗高锰酸钾溶液的物质的量为,故草酸根离子的物质的量为mol,三草酸合铁(III)酸钾的物质的量为mol,质量为g,故该样品的质量分数为;
滴定结束时俯视读数,导致高锰酸钾溶液体积读数偏小,导致样品质量分数偏小。
18. 分液漏斗 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 减小 A装置中挥发出来的HCl,消耗了C装置中的KOH,使氯酸钾的产率减小 除去溶液中过量的H2O2,(防止干扰后续实验) ClO+6I-+6H+=Cl-+3I2+3H2O 防止碘挥发损失 碱 20.4%(或0.204)
【分析】装置A中浓盐酸与二氧化锰共热制取氯气,生成的氯气中混有挥发出的HCl,可以用装置B中的水吸收,之后在C处水浴加热条件下,控制温度使氯气和KOH溶液反应得到氯酸钾,装置D吸收未反应的氯气;测定氯酸钾含量时,先利用双氧水除去混有的次氯酸根,然后煮沸除去过量的双氧水,酸化后加入KI溶液,碘离子被氯酸根氧化成碘单质,之后利用Na2S2O3标准液滴定生成的碘单质,从而间接确定氯酸钾的含量。
【详解】(1)根据仪器的结构特点,可知其为分液漏斗;装置A中浓盐酸与二氧化锰共热制取氯气,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,反应过程中A装置中挥发出来的HCl,会消耗C装置中的KOH,使氯酸钾的产率减小;
(3)滴加的双氧水过量,所以煮沸的主要目的是除去溶液中过量的H2O2,防止干扰后续实验;
(4)步骤3中,酸性环境中ClO将I-氧化为I2,自身被还原为Cl-,根据电子守恒可知ClO和I-的系数比为1:6,再结合元素守恒可得离子方程式为ClO+6I-+6H+=Cl-+3I2+3H2O;
(5)碘易挥发,加盖水封的目的是防止碘挥发损失;Na2S2O3溶液中存在S2O的水解,使溶液显碱性,所以应装入碱式滴定管;
(6)消耗的Na2S2O3的物质的量为0.02L×0.1500mol/L=0.003mol,根据可知,被ClO氧化的I-的物质的量为0.003mol,则ClO的物质的量为0.0005mol,所以样品中KClO3的物质的量为=0.005mol,所以质量分数为=20.4%(或0.204)。
新疆高考化学三年(2021-2023)模拟题汇编-12水溶液中的离子反应和平衡: 这是一份新疆高考化学三年(2021-2023)模拟题汇编-12水溶液中的离子反应和平衡,共28页。试卷主要包含了单选题,实验题,原理综合题,工业流程题等内容,欢迎下载使用。
青海高考化学三年(2021-2023)模拟题汇编-05水溶液中的离子反应和平衡: 这是一份青海高考化学三年(2021-2023)模拟题汇编-05水溶液中的离子反应和平衡,共29页。试卷主要包含了单选题,工业流程题,原理综合题,实验题等内容,欢迎下载使用。
甘肃高考化学三年(2021-2023)模拟题汇编-05水溶液中的离子反应和平衡: 这是一份甘肃高考化学三年(2021-2023)模拟题汇编-05水溶液中的离子反应和平衡,共28页。试卷主要包含了单选题,工业流程题,实验题,原理综合题等内容,欢迎下载使用。












