
- 新教材2023高中化学章末质量评估第三章水溶液中的离子反应与平衡新人教版选择性必修1 试卷 试卷 0 次下载
- 新教材2023高中化学第三章水溶液中的离子反应与平衡章末整合提升新人教版选择性必修1 试卷 试卷 0 次下载
- 新教材2023高中化学第三章水溶液中的离子反应与平衡第一节电离平衡课时2电离平衡常数同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第三章水溶液中的离子反应与平衡第三节盐类的水解课时1盐类的水解同步测试新人教版选择性必修1 试卷 0 次下载
- 新教材2023高中化学第三章水溶液中的离子反应与平衡第三节盐类的水解课时2溶液中粒子浓度的大小关系同步测试新人教版选择性必修1 试卷 0 次下载
人教版 (2019)选择性必修1第一节 电离平衡习题
展开第一节 电离平衡
课时1 强、弱电解质 弱电解质的电离平衡
【基础巩固】
1.(2022·广东阳春)下列关于强弱电解质及非电解质的组合完全正确的是 ( )
选项 | 强电解质 | 弱电解质 | 非电解质 |
A | NaCl | HF | Cl2 |
B | H2SO4 | BaSO4 | CS2 |
C | CaCO3 | HClO | 蔗糖 |
D | HNO3 | CH3COOH | H2CO3 |
解析:A项,Cl2是单质,既不是电解质又不是非电解质,故不符合题意;B项,溶于水中的BaSO4能完全电离,所以BaSO4是强电解质,故不符合题意;C项,溶于水中的CaCO3能完全电离,CaCO3是强电解质,HClO在水中部分电离,是弱电解质,蔗糖在水溶液中和熔融状态下都不导电,蔗糖是非电解质,故符合题意;D项,H2CO3的水溶液能导电,H2CO3是电解质,故不符合题意。
答案:C
2.下列溶液中导电性最强的是 ( )
A.1 L 0.1 mol/L次氯酸
B.0.1 L 0.1 mol/L H2SO4溶液
C.0.5 L 0.1 mol/L硝酸
D.2 L 0.1 mol/L H2C2O4溶液
解析:溶液中离子浓度越大,溶液的导电性越强。当离子浓度相同时,还要比较离子所带的电荷数是否相同。离子浓度越大,离子所带的电荷数越多,溶液的导电性越强。
答案:B
3.在0.1 mol/L的CH3COOH溶液中,要促进CH3COOH电离,且使c(H+)增大,应采取的措施是 ( )
A.升高温度 B.加适量水
C.加入0.1 mol/L NaOH溶液 D.加入0.1 mol/L HCl溶液
解析:CH3COOH![]() CH3COO-+H+为吸热过程,升高温度,平衡正向移动,c(H+)增大。
CH3COO-+H+为吸热过程,升高温度,平衡正向移动,c(H+)增大。
答案:A
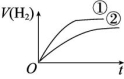
4.相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图中正确的是 ( )
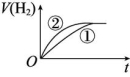
A B
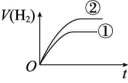
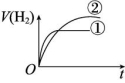
C D
解析:强酸完全电离,中强酸部分电离,随着反应的进行,中强酸要继续电离出H+,所以溶液②产生氢气的体积大,在相同时间内,②的反应速率比①的反应速率大。
答案:C
5.H2S溶于水的电离方程式为 。
(1)向H2S溶液中加入CuSO4固体时,电离平衡 (填“向右”“向左”或“不”)移动,c(H+) (填“增大”“减小”或“不变”,下空同),c(S2-) 。
(2)向H2S溶液中加入NaOH固体时,电离平衡 (填“向左”“向右”或“不”)移动,c(H+) (填“增大”“减小”或“不变”,下空同),c(S2-) 。
解析:H2S是二元弱酸,在水溶液中是分两步电离的,其电离方程式为H2S![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-。
H++S2-。
(1)当加入CuSO4固体时,因S2-与Cu2+发生反应,平衡右移,导致c(H+)增大,但c(S2-)减小。(2)当加入NaOH固体时,因H+与OH-发生反应,使平衡右移,导致c(H+)减小,但c(S2-)增大。
答案:H2S![]() H++HS-,HS-
H++HS-,HS-![]() H++S2- (1)向右 增大 减小 (2)向右 减小 增大
H++S2- (1)向右 增大 减小 (2)向右 减小 增大
【拓展提高】
6.c(H+)均为0.1 mol/L的两种一元酸HX和HY溶液,分别取100 mL加入足量的镁粉,充分反应后,收集到H2体积分别为VHX和VHY。若相同条件下VHX>VHY,下列说法中正确的是 ( )
A.HX可能是强酸
B.HY一定是强酸
C.HX的酸性强于HY的酸性
D.反应开始时两者生成H2的速率相等
解析:溶液中c(H+)相同,反应开始时两者生成H2的速率相等。加入足量的镁粉,充分反应后收集到H2的体积关系为VHX>VHY,说明溶液中H+的总物质的量:HX>HY,HX的酸性弱于HY的酸性,HX不可能是强酸,HY可能是强酸也可能是弱酸。
答案:D
7.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和c(H+)都相等,向两个烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。下列说法中不正确的是 ( )
A.甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大
B.甲烧杯中的酸一定过量
C.两个烧杯中参加反应的锌等量
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的 c(H+)大
解析:由于强酸在溶液中完全电离,而弱酸只有部分电离,因此,当pH相等即c(H+)相等时,c(CH3COOH)>c(HCl),若加入的锌粒质量相等且过量时,放出的氢气必然是醋酸多,要使放出的氢气相等,CH3COOH必须有剩余。此时有两种情况:加入Zn量相等时,HCl完全反应或有剩余,CH3COOH有剩余;加入Zn量不等时,一定是HCl中Zn有剩余,CH3COOH中Zn不足。其原因分别是盐酸本身能够提供的最大氢离子的量少,如果HCl再不完全反应,放出的氢气更不可能与CH3COOH放出的氢气相等了;反应开始后,由于CH3COOH存在电离平衡,氢离子的减小幅度比盐酸中的小,故应始终比盐酸中的氢离子浓度大。
答案:B
8.在相同温度时,100 mL 0.01 mol/L的CH3COOH溶液与10 mL
0.1 mol/L的CH3COOH溶液相比,下列数值前者大于后者的是 ( )
A.中和时所需NaOH的量
B.CH3COOH的电离程度
C.H+的物质的量浓度
D.CH3COOH的物质的量
解析:相同温度时,100 mL 0.01 mol/L的CH3COOH溶液与10 mL
0.1 mol/L的CH3COOH溶液所含CH3COOH的物质的量相等,中和时所需NaOH的量也相等。溶液越稀,电离程度越大。
答案:B
【挑战创新】
9.现有①盐酸、②醋酸、③硫酸三种稀溶液,用序号回答下列问题。
(1)若三种酸的物质的量浓度相等。
a.三种溶液中的c(H+)大小关系为 。
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积的大小关系为 。
c.若取等质量Zn分别与这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为 。
(2)若三种溶液的c(H+)相等。
a.三种酸的物质的量浓度大小关系为 。
b.取等体积上述三种溶液,分别用同浓度的NaOH溶液完全中和,所需NaOH溶液体积的大小关系为 。
c.若取等质量Zn分别与这三种溶液反应,使Zn恰好完全反应时,消耗三种酸的体积大小关系为 。
解析:(1)a.H2SO4为二元强酸,CH3COOH为弱酸,部分电离,故③>①>②。b.三种酸的物质的量相等,但H2SO4为二元酸,所以消耗NaOH是盐酸和醋酸的两倍,盐酸和醋酸消耗的NaOH相等,所以③>①=②。c.与等质量的Zn完全反应,消耗的盐酸和醋酸相等,消耗的硫酸最少,所以①=②>③。(2)a.CH3COOH是弱酸,c(CH3COOH)>c(H+),c(H2SO4)=![]() c(H+),
c(H+),
c(HCl)=c(H+),所以②>①>③。b.等体积的三种溶液中,n(CH3COOH)>
n(HCl),而HCl和H2SO4都是强电解质,两溶液中的n(H+)相等,消耗NaOH一样多,所以②>①=③。c.等质量的Zn完全反应,消耗的n(H+)相等,所以溶液中c(H+)大的消耗体积最小,硫酸与盐酸的c(H+)相等,而CH3COOH在反应中会电离产生H+,所以消耗体积最小,所以①=③>②。
答案:(1)a.③>①>② b.③>①=② c.①=②>③
(2)a.②>①>③ b.②>①=③ c.①=③>②
化学选择性必修1第一节 电离平衡优秀第1课时课后作业题: 这是一份化学选择性必修1第一节 电离平衡优秀第1课时课后作业题,文件包含31水溶液中的离子反应与平衡第1课时弱电解质的电离平衡原卷版-高二化学同步素养目标精品讲义人教版选择性必修1docx、31水溶液中的离子反应与平衡第1课时弱电解质的电离平衡解析版-高二化学同步素养目标精品讲义人教版选择性必修1docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 电离平衡精练: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡精练,共6页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡课时训练: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡课时训练,共4页。













