

北京市高考化学三年(2020-2022)模拟题分类汇编12离子反应(5)
展开北京市高考化学三年(2020-2022)模拟题分类汇编12离子反应(5)
一、单选题
1.(2020·北京·统考模拟预测)下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3COO-可以大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每生成1molCl2,转移电子约为6.02×1023个
2.(2020·北京·统考模拟预测)能正确表示下列反应的离子方程式为( )
A.向FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.向碳酸钠溶液中通入少量CO2:CO32-+2CO2+H2O=2HCO3-
C.向碘化钾溶液中加入少量双氧水:3H2O2+I-=IO3-+3H2O
D.向硫化钠溶液中通入过量SO2:2S2-+5SO2+2H2O=3S↓+4HSO3-
3.(2020·北京·统考模拟预测)下列化学用语对事实的表述正确的是( )
A.碳酸比苯酚酸性强:2C6H5ONa+CO2+H2O=2C6H5OH+Na2CO3
B.实验室用氯化铝溶液和氨水制备氢氧化铝:Al3++3OH-=Al(OH)3↓
C.工业上用电解法制镁:MgCl2(熔融)Mg+Cl2↑
D.向NaOH溶液中通入过量的二氧化硫:SO2+2NaOH=Na2SO3+H2O
4.(2020·北京·统考模拟预测)关于钠及其化合物的化学用语正确的是
A.钠原子的结构示意图:
B.过氧化钠的电子式:
C.碳酸氢钠的电离方程式:NaHCO3 = Na+ + H+ + CO32-
D.次氯酸钠水溶液呈碱性的原因:ClO+ H2OHClO + OH
5.(2020·北京·统考模拟预测)下列指定反应的离子方程式不正确的是
A.向铁制器具上电镀铜,阴极的电极反应为:Cu2++2e-=Cu
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2OH2↑+Cl2↑+2OH-
C.饱和Na2CO3溶液与CaSO4固体反应:CO32-(aq)+CaSO4(s)CaCO3(s)+SO42-(aq)
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42- =BaSO4↓+H2O
6.(2020·北京·统考模拟预测)下列指定反应的离子方程式正确的是
A.用KIO3溶液氧化酸性溶液中的KI:5I-+ IO3- + 3H2O = 3I2 + 6OH-
B.醋酸溶液与水垢中的CaCO3反应:CaCO3 + 2H+ = Ca2+ + H2O + CO2
C.Cu溶于稀HNO3:Cu + 2H+ + NO3- = Cu2+ + NO2↑+ H2O
D.Ca(HCO3)2溶液与足量NaOH溶液反应:2HCO3- + Ca2+ + 2OH-= CaCO3↓ + CO32-+ 2H2O
7.(2020·北京·统考模拟预测)下列离子方程式能用来解释相应实验现象的是
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
C
二氧化硫使酸性高锰酸钾溶液褪色
D
氧化亚铁溶于稀硝酸
A.A B.B C.C D.D
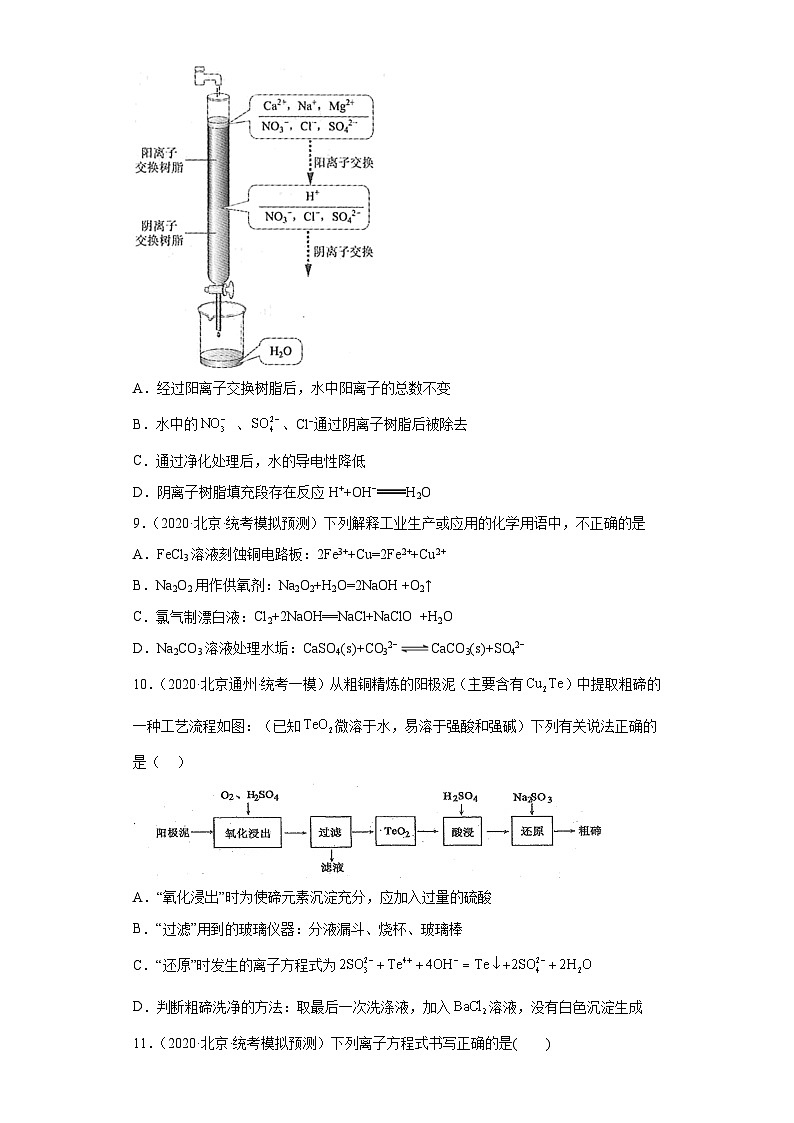
8.(2020·北京·统考模拟预测)离子交换法净化水过程如图所示。下列说法中错误的是
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的 、、Cl−通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH−H2O
9.(2020·北京·统考模拟预测)下列解释工业生产或应用的化学用语中,不正确的是
A.FeCl3溶液刻蚀铜电路板:2Fe3++Cu=2Fe2++Cu2+
B.Na2O2用作供氧剂:Na2O2+H2O=2NaOH +O2↑
C.氯气制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O
D.Na2CO3溶液处理水垢:CaSO4(s)+CO32−CaCO3(s)+SO42−
10.(2020·北京通州·统考一模)从粗铜精炼的阳极泥(主要含有)中提取粗碲的一种工艺流程如图:(已知微溶于水,易溶于强酸和强碱)下列有关说法正确的是( )
A.“氧化浸出”时为使碲元素沉淀充分,应加入过量的硫酸
B.“过滤”用到的玻璃仪器:分液漏斗、烧杯、玻璃棒
C.“还原”时发生的离子方程式为
D.判断粗碲洗净的方法:取最后一次洗涤液,加入溶液,没有白色沉淀生成
11.(2020·北京·统考模拟预测)下列离子方程式书写正确的是( )
A.用漂白液将污水中的NH3氧化成N2:ClO-+2NH3=N2+Cl-+3H2O
B.向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液:NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O
C.酸性条件下,用H2O2将I-转化为I2:H2O2+2I-=I2+2OH-
D.用少量的氨水吸收硫酸工业尾气中的SO2:SO2+NH3·H2O=NH4++HSO3-
12.(2020·北京·统考模拟预测)将下列气体通入溶有足量 SO2 的 BaCl2 溶液中, 没有沉淀产生的是
A.HCl B.NH3 C.Cl2 D.NO2
二、工业流程题
13.(2020·北京·统考模拟预测)亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂,同时也是对烟气进行脱硫、脱硝的吸收剂。
Ⅰ.以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:
已知:
i.纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
ii.NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
iii.NaClO2饱和溶液在温度低于38℃时析出NaClO2∙3H2O,等于或高于38℃时析出NaClO2晶体,高于60℃时分解成NaClO3和NaCl。
(1)试剂A应选择_________。(填字母)
a.SO2 b.浓硝酸 c.KMnO4
(2)反应②的离子方程式为_________。
(3)已知压强越大,物质的沸点越高。反应②结束后采用“减压蒸发”操作的原因是________。
(4)下列关于上述流程的说法中,合理的是_________。(填字母)
a.反应①进行过程中应持续鼓入空气
b.反应①后得到的母液中,溶质的主要成分是NaCl
c.反应②中NaOH溶液应过量
d.冷却结晶时温度选择38℃,过滤后进行温水洗涤,然后在低于60℃下进行干燥,得到粗产品NaClO2
Ⅱ.采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。
(5)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10−3mol/L。反应一段时间后溶液中离子浓度的分析结果如下表:
离子
SO42−
SO32−
NO3−
NO2−
Cl−
c /(mol/L)
8.35×10−4
6.87×10−6
1.5×10−4
1.2×10−5
3.4×10−3
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________。
②由实验结果可知,脱硫反应速率大于脱硝反应速率。除SO2和NO在烟气中的初始浓度不同外,还可能存在的原因是_________。(答出两条即可)
14.(2020·北京·统考模拟预测)以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42−2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)NaHPbO2(aq),其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_____(选填序号)。
A.减少PbO的损失,提高产品的产率 B.重复利用NaOH,提高原料的利用率
C.增加Na₂SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯。结合上述溶解度曲线,简述过程Ⅲ的操作:____。
三、原理综合题
15.(2020·北京·统考模拟预测)Fe3O4呈黑色、有磁性,应用广泛。以Fe3O4为吸附剂去除水中含磷物质是一种新的除磷措施。
(1)检验Fe3O4中铁元素的价态:用盐酸溶解Fe3O4,取少量滴加______,溶液变红;另取少量滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。
(2)氧化—沉淀法制备Fe3O4
Ⅰ.向稀硫酸中加入过量铁粉,得到FeSO4溶液。空气中存在O2,由于_______(用离子方程式表示),可产生Fe3+。过量铁粉的作用是除去Fe3+。
Ⅱ.在N2保护下,向热NaOH溶液中加入FeSO4溶液,搅拌,得到Fe(OH)2浊液。将NaNO3溶液滴入浊液中,充分反应得到Fe3O4。
①用湿润红色石蕊试纸检验产物,_______(填现象),证明生成了NH3。
②____Fe(OH)2+_____NO3-=________(将反应补充完整)。
(3)含磷各微粒在溶液中的物质的量分数与pH的关系如下图所示。
下列分析正确的是________。
a.KH2PO4的水溶液中:c(H+)>c(OH-)
b.K2HPO4 溶液显碱性,原因是HPO42-的水解程度大于其电离程度
c.H3PO4是强电解质,在溶液中完全电离
(4)将Fe3O4加到KH2PO4溶液中,调节溶液pH。pH对吸附剂Fe3O4表面所带电荷的影响:pH<6.8,Fe3O4表面带正电荷;pH>6.8,Fe3O4表面带负电荷;pH=6.8,Fe3O4表面不带电荷。Fe3O4对含磷微粒的去除率随pH的变化如下。
①pH=3时,吸附的主要微粒是_______。
②与pH=5时相比,pH=9时的去除率明显下降,原因是:_________。
参考答案:
1.D
【详解】A.NaClO和NaCl的混合溶液中含有ClO-,其在酸性条件下具有强氧化性,与H+和Br-不能大量共存,A项错误;
B.混合溶液中的Cl-与Ag+反应生成氯化银沉淀,不能大量共存,B项错误;
C.溶液为碱性,滴入少量硫酸亚铁时,亚铁离子被ClO-氧化,但离子方程式中不能写H+而应写水,且生成Fe(OH)3,C项错误;
D.向溶液中加入浓盐酸时发生反应:ClO-+Cl-+2H+===Cl2↑+H2O,每生成1molCl2转移1mol电子,约为6.02×1023个,D项正确。
故答案选:D。
2.D
【详解】A.FeBr2电离产生的Fe2+、Br-都具有还原性,向该溶液中通入过量Cl2,阳离子、阴离子都会被氧化,离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,A项错误;
B.向碳酸钠溶液中通入少量CO2,Na2CO3、CO2、H2O发生反应产生NaHCO3,反应的离子方程式为:CO32-+CO2+H2O=2HCO3-,B项错误;
C.H2O2具有氧化性,在酸性条件下,会将I-氧化为I2,反应的离子方程式为:H2O2+2H++2I-=I2+2H2O,C项错误;
D.向硫化钠溶液中通入过量SO2,由于酸性:H2SO3>H2S,会发生S2-+SO2+H2O=H2S+SO32-,SO2+2H2S=3S↓+2H2O,SO32-+SO2+H2O=2HSO3-,总反应方程式为2S2-+5SO2+2H2O=3S↓+4HSO3-,D项正确。
故选D。
3.C
【详解】A.酸性:碳酸>苯酚>HCO3-,所以C6H5O-+CO2+H2O→C6H5OH+HCO3-,A错误;
B.氨水中的一水合氨为弱碱,不能改写成OH-,B错误;
C.工业上电解熔融的MgCl2制金属镁,C正确;
D.向NaOH溶液中通入过量的二氧化硫,应生成NaHSO3,D错误;
故选C。
4.D
【详解】A.钠原子原子核外有11个电子,A错误;
B.过氧化钠是离子化合物,B错误;
C.碳酸氢钠只能完全电离产生钠离子和碳酸氢根离子,C错误;
D.次氯酸钠溶液显碱性是由于次氯酸根的水解造成的,D正确;
答案选D。
5.D
【详解】A.电镀时,镀层金属作阳极,镀件作阴极, 在阴极上,镀层金属阳离子获得电子,向铁制器具上电镀铜,阴极上Cu2+得电子变为单质Cu,反应原理符合事实,A正确;
B.电解饱和食盐水,溶液中的阴离子Cl-在阳极上失去电子变为Cl2,水电离产生的H+在阴极上获得电子变为H2,总反应方程式为:2Cl-+2H2OH2↑+Cl2↑+2OH-,B正确;
C.CaSO4在溶液中存在沉淀溶解平衡,当向溶液中加入饱和Na2CO3溶液时,由于c(Ca2+)·c(CO32-)>Ksp(CaCO3),会形成CaCO3沉淀,使CaSO4不断溶解,最终实现了沉淀的转化,C正确;
D.向氢氧化钡溶液中加入稀硫酸,二者反应产生BaSO4沉淀和H2O,产生的二者的物质的量的比是1:2,离子方程式为:Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O,D错误;
故答案选D。
6.D
【详解】A. KIO3氧化酸性溶液中的KI产物中不能生成氢氧根离子,反应的离子方程式为:5I-+ IO3- +6H+═3I2+3H2O,故A错误;
B. 醋酸溶液除水垢中的CaCO3反应的离子反应为CaCO3+2CH3COOH=Ca2++2CH3COO−+H2O+CO2↑,故B错误;
C. Cu溶于稀HNO3生成硝酸铜、NO气体和水,正确的离子方程式为:3Cu +8H+ + 2NO3- = ═3Cu2++2NO↑+4H2O,故C错误;
D. Ca(HCO3)2 溶液与足量 NaOH 溶液反应,离子方程式:2HCO3- + Ca2+ + 2OH-= CaCO3↓ + CO32-+ 2H2O故D正确;
答案选D。
【点睛】酸性溶液中不能出现氢氧根离子,离子反应要遵循客观事实,注意量的关系。
7.A
【解析】A、氢氧化镁碱性强于氨水;
B、制氢氧化铁胶体条件是加热,在化学式后注明胶体,得不到沉淀;
C、电荷不守恒;
D、硝酸具有强氧化性,将亚铁氧化成铁离子;
【详解】A、氢氧化镁碱性强于氨水,故A能用来解释相应实验现象;
B、制氢氧化铁胶体条件是加热,在化学式后注明胶体,得不到沉淀,离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+,故B不能用来解释相应实验现象;
C、电荷不守恒,正确的离子方程式为:5SO2+2MnO4-+2H2O=2Mn2++4H++5SO42-,故C不能用来解释相应实验现象;
D、硝酸具有强氧化性,其可将亚铁氧化成铁离子,正确的离子方程式为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故D不能用来解释相应实验现象;
故选A。
【点睛】本题考查离子反应方程式书写,解题关键:结合原理正确书写离子方程式,难点C:氧化还原反应的离子方程式的书写,配平前不能将H+写在反应物中,应先配电子转移守恒,再通过电荷守恒将H+补在生成物中。
8.A
【详解】离子交换树脂净化水的原理是:当含有Na+、Ca2+、Mg2+等阳离子及SO42-、Cl-、NO3-等阴离子的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交换的阳离子H+则被交换到水中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水再通过阴离子交换树脂时,水中的阴离子也为树脂所吸附,树脂上可交换的阴离子OH-也被交换到水中,同时与水中的H+离子结合成水,则
A、根据电荷守恒可知经过阳离子交换树脂后,水中阳离子总数增加,A错误;
B、根据以上分析可知水中的SO42-、Cl-、NO3-等阴离子通过阴离子交换树脂被除去,B正确;
C、通过净化处理后,溶液中离子的浓度降低,导电性降低,C正确;
D、根据以上分析可知阴离子交换树脂填充段存在反应H++OH-=H2O,D正确;
答案选A。
9.B
【详解】A. FeCl3溶液与铜反应生成氯化亚铁和氯化铜:2Fe3++Cu==2Fe2++Cu2+,故A正确;
B. Na2O2用作供氧剂与水反应生成氢氧化钠和氧气:2Na2O2+2H2O==4NaOH +O2↑,故B错误;
C. 氯气与氢氧化钠溶液反应制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O,故C正确;
D. Na2CO3与硫酸钙发生沉淀转化:CaSO4(s)+CO32−CaCO3(s)+SO42−,故D正确;选B。
10.D
【详解】A.由题中信息可知,TeO2微溶于水,易溶于强酸和强碱,是两性氧化物。Cu2Te与硫酸、氧气反应,生成硫酸铜和TeO2,硫酸若过量,会导致TeO2的溶解,造成原料的利用率降低,故A错误;
B.“过滤”用到的玻璃仪器:漏斗、烧杯、玻璃棒,故B错误;
C.Na2SO3加入到Te(SO4)2溶液中进行还原得到固态碲,同时生成Na2SO4,该反应的离子方程式是2SO32-+Te4 ++2H2O=Te↓+2SO42-+4H+,故C错误;
D.通过过滤从反应后的混合物中获得粗碲,粗碲表面附着液中含有SO42-,取少量最后一次洗涤液,加入BaCl2溶液,若没有白色沉淀生成,则说明洗涤干净,故D正确。
故选D。
11.D
【详解】A.加入漂白液将污水中的NH3氧化成N2,根据得失电子守恒和原子守恒,离子方程式为3ClO-+2NH3=N2+3Cl-+3H2O,故A错误;
B. 向NH4HCO3稀溶液中滴加过量Ca(OH)2溶液,离子方程式:Ca2++NH4++HCO3-+2OH-=NH3·H2O+CaCO3↓+H2O,故B错误;
C. 酸性条件下,用H2O2将I-转化为I2,离子方程式:H2O2+2I-+2H+=I2+2H2O,故C错误;
D. 用少量的氨水吸收硫酸工业尾气中的SO2,离子方程式:SO2+NH3·H2O=NH4++HSO3-,故D正确。
答案选D。
12.A
【分析】二氧化硫和水反应生成亚硫酸,亚硫酸酸性小于HCl,所以亚硫酸和氯化钡不反应,则向BaCl2溶液中通入SO2溶液仍澄清,若再通入足量的某气体,溶液中仍然没有沉淀,则该气体不能将亚硫酸氧化为硫酸或该气体不能和亚硫酸反应生成沉淀。
【详解】A.HCl和亚硫酸不反应且和氯化钡不反应,所以没有生成沉淀,符合题意,选项A正确;B.氨气和亚硫酸反应生成亚硫酸氨,亚硫酸氨和氯化钡发生复分解反应生成亚硫酸钡沉淀,所以不符合题意,选项B错误;C.氯气和二氧化硫及水反应生成硫酸和盐酸,与氯化钡反应生成硫酸钡沉淀,所以不符合题意,选项C错误;D.二氧化氮和水反应生成硝酸,硝酸具有强氧化性,能氧化亚硫酸生成硫酸,硫酸和氯化钡反应生成硫酸钡白色沉淀,所以不符合题意,选项D错误;答案选A。
13. a 2OH− + 2ClO2 + H2O2 = 2ClO2− + O2 + 2H2O 减压可以使物质沸点降低,实验较低温度下进行蒸发,可避免NaClO2因温度高而发生分解 acd 4OH− +3ClO2− + 4NO = 4NO3− + 3Cl− + 2H2O SO2比NO溶解度更大;在此条件下SO2还原性更强;脱硝反应活化能更大
【分析】I.由制备流程可知,NaClO3和试剂A在H2SO4在作用下发生还原反应生成ClO2和Na2SO4,由元素守恒可知试剂A为二氧化硫,ClO2在与双氧水、氢氧化钠反应生成亚氯酸钠,再控制温度为38℃~60℃蒸发结晶得到NaClO2晶体;
【详解】(1)根据上面的分析可以知道试剂A为SO2,故选a;
(2)反②中ClO2被双氧水还原成ClO2−,反应的离子方程式为2OH− + 2ClO2 + H2O2 = 2ClO2− + O2 + 2H2O;
(3)含水的NaClO2受热易分解,所以亚氯酸钠溶液中获得晶体,温度不能太高,所以反应②结束后采用“减压蒸发”操作,在较低温度蒸发浓缩,可防止温度过高NaClO2分解;
(4)a.反应①进行过程中应持续鼓入空气,可将生成气体完全反应,故a正确;
b.反应①后得到的母液中,由元素守恒及反应后离子可知溶质的主要成分是Na2SO4,故b错误;
c.反应②中NaOH溶液应过量,因NaClO2在碱性溶液中稳定存在,故c正确;
d.由信息iii可知,冷却结晶时温度选择38℃,过滤后进行温水洗涤,然后在低于60℃下进行干燥,得到粗产品NaClO2,故d正确;
故答案为:acd;
(5) ①亚氯酸钠具有氧化性,且NaClO2溶液呈碱性,则NaClO2溶液脱硝过程中主要反应的离子方程式3ClO2⁻+4NO+4OH⁻=4NO3⁻+3Cl⁻ +2H2O;
②由实验结果可以知道,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高。
14. Pb + PbO2+ 2H2SO4== 2PbSO4+ 2H2O 2Fe3++Pb+SO42—==PbSO4+2Fe2+ 取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去 A、B 将粗PbO溶解在一定量35%NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤得到PbO固体
【详解】(1)根据题给化学工艺流程知,过程Ⅰ中,在Fe2+催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为Pb + PbO2+ 2H2SO4== 2PbSO4+ 2H2O。
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变。根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为2Fe3++Pb+SO42—==PbSO4+2Fe2+;②a实验证明发生反应i,则b实验需证明发生反应ii,实验方案为取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去。
(3)①过程Ⅱ脱硫过程中发生的反应为PbSO4+2NaOH==PbO+Na2SO4+H2O,而滤液Ⅰ中含有硫酸,可降低溶液的pH,使平衡:PbO(s)+NaOH(aq)NaHPbO2(aq)逆向移动,减少PbO的损失,提高产品的产率,选A;重复利用NaOH,提高原料的利用率,选B;②根据PbO的溶解度曲线,提纯粗Pb的方法为将粗PbO溶解在35%NaOH溶液中配成高温下的饱和溶液,降温结晶、过滤,得PbO。
15. KSCN溶液 4Fe2++4H++O2=4Fe3++2H2O 试纸变蓝 12 1 4Fe3O4+NH3↑+OH-+10H2O ab H2PO4- pH=5时,Fe3O4带正电荷,含磷的主要微粒是H2PO4-;pH=9时,Fe3O4带负电荷,含磷的主要微粒是HPO42-。因此在pH=9时,吸附剂和含磷的主要微粒之间的静电排斥作用强于pH =5时
【详解】(1) Fe3O4与HCl反应产生FeCl2、FeCl3,向溶液中加入KSCN溶液,溶液变为血红色,证明含有Fe3+;向溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,证明含有Fe2+;
(2)I.空气中的氧气与溶液中的Fe2+会发生氧化还原反应,4Fe2++4H++O2=4Fe3++2H2O,产生Fe3+;若加入Fe粉,就会发生2Fe3++Fe=3Fe2+,从而可除去Fe3+,防止溶液变质;
II.①氨气的水溶液显碱性,能够使湿润的红色石蕊试纸变为蓝色;
②Fe(OH)2被NO3-氧化为Fe3O4,NO3-被还原为NH3,根据电子守恒,可知Fe(OH)2的系数是12,Fe3O4的系数是4,NO3-、NH3的系数是1,根据电荷守恒可知生成物中还有OH-,根据元素守恒,可知生成物还有H2O,系数是10,所以配平的方程式为12Fe(OH)2+NO3-= 4Fe3O4+NH3+OH-+10H2O;
(3) a.根据图示可知H2PO4-存在的pH<5,溶液显酸性,所以KH2PO4的水溶液中:c(H+)>c(OH-),a正确;
b.K2HPO4是三元弱酸的酸式盐,在溶液中HPO42-既存在电离作用,也存在水解作用。电离产生H+使溶液显酸性;水解消耗水电离产生的H+,当最终达到平衡时溶液中c(OH-)>c(H+),使溶液又显碱性。现在K2HPO4溶液显碱性,说明HPO42-的水解程度大于其电离程度,溶液中c(OH-)>c(H+),b正确;
c.由于溶液的pH不同,溶液中磷元素的主要存在的微粒种类不同,说明H3PO4是弱电解质,在溶液中存在电离平衡,不能完全电离,c错误;
故合理选项是ab;
(4)①根据pH对吸附剂Fe3O4表面所带电荷的影响:pH<6.8,溶液中主要存在微粒是H2PO4-;Fe3O4表面带正电荷,现在溶液的pH=3,所以Fe3O4吸附的就是正电荷,主要微粒是H2PO4-;
②pH=9时,Fe3O4带负电荷,含磷的主要微粒是HPO42-。因此在pH=9时,吸附剂和含磷的主要微粒之间的静电排斥作用强于pH =5时。
北京市高考化学三年(2020-2022)模拟题分类汇编11离子反应(4): 这是一份北京市高考化学三年(2020-2022)模拟题分类汇编11离子反应(4),共28页。试卷主要包含了单选题,工业流程题,填空题,实验题,原理综合题等内容,欢迎下载使用。
北京市高考化学三年(2020-2022)模拟题分类汇编10离子反应(3): 这是一份北京市高考化学三年(2020-2022)模拟题分类汇编10离子反应(3),共24页。试卷主要包含了单选题,填空题,工业流程题等内容,欢迎下载使用。
北京市高考化学三年(2020-2022)模拟题分类汇编09离子反应(2): 这是一份北京市高考化学三年(2020-2022)模拟题分类汇编09离子反应(2),共26页。试卷主要包含了单选题,多选题,填空题,工业流程题等内容,欢迎下载使用。












