
2023年高考押题预测卷02(江苏卷)-化学(考试版)A4
展开绝密★启用前
2023年高考押题预测卷02【江苏卷】
化 学
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Cu 64
第Ⅰ卷
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.我国部分地区已迈入了生活垃圾强制分类的时代。可回收垃圾包括废纸、塑料、玻璃、金属和布料五大类。下列说法不正确的是
A.废报纸的主要成分是蛋白质 B.聚乙烯塑料的单体是H2C=CH2
C.生产玻璃的原料之一是石英 D.用灼烧法可鉴别腈纶和真丝
2.已知HOOC-COOH+NaClO=NaCl+2CO2↑+H2O,下列化学用语正确的是
A.HOOC-COOH属于羧酸,不能使酸性高锰酸钾溶液褪色 B.CO2是极性分子
C.NaClO的电子式为 D.H2O分子中键角为107°
3.和S均属于VIA族元素。下列关于Se及其化合物性质的比较不正确的是
A.第一电离能: B.原子半径:Se<As
C.还原性: D.沸点:
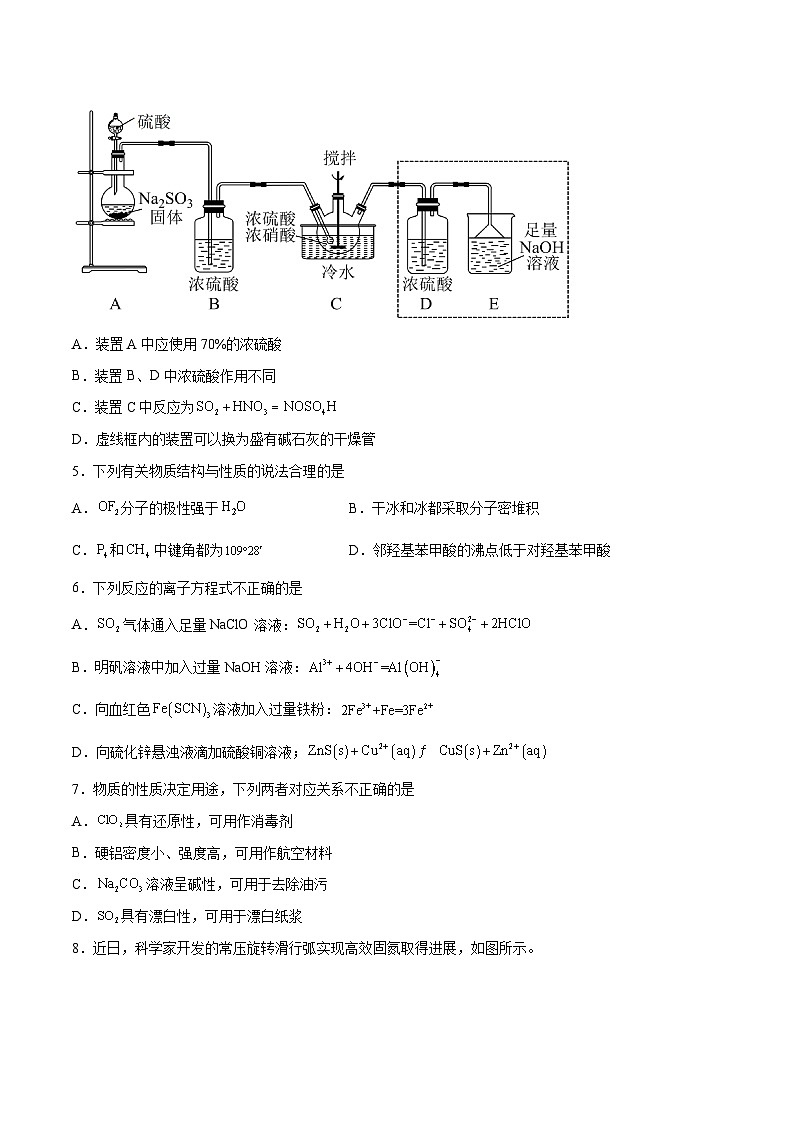
4.实验室模拟制备亚硝酰硫酸()的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是
A.装置A中应使用70%的浓硫酸
B.装置B、D中浓硫酸作用不同
C.装置C中反应为
D.虚线框内的装置可以换为盛有碱石灰的干燥管
5.下列有关物质结构与性质的说法合理的是
A.分子的极性强于 B.干冰和冰都采取分子密堆积
C.和中键角都为 D.邻羟基苯甲酸的沸点低于对羟基苯甲酸
6.下列反应的离子方程式不正确的是
A.气体通入足量NaClO溶液:
B.明矾溶液中加入过量NaOH溶液:
C.向血红色溶液加入过量铁粉:
D.向硫化锌悬浊液滴加硫酸铜溶液;
7.物质的性质决定用途,下列两者对应关系不正确的是
A.具有还原性,可用作消毒剂
B.硬铝密度小、强度高,可用作航空材料
C.溶液呈碱性,可用于去除油污
D.具有漂白性,可用于漂白纸浆
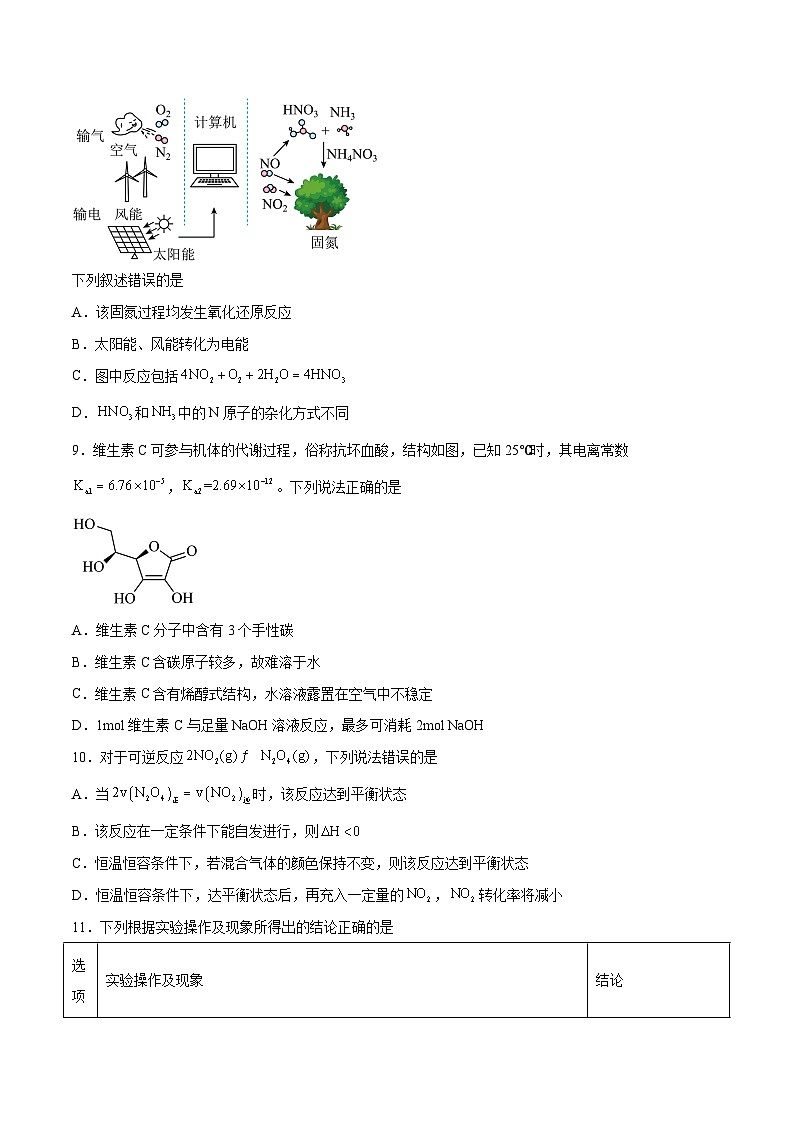
8.近日,科学家开发的常压旋转滑行弧实现高效固氮取得进展,如图所示。
下列叙述错误的是
A.该固氮过程均发生氧化还原反应
B.太阳能、风能转化为电能
C.图中反应包括
D.和中的N原子的杂化方式不同
9.维生素C可参与机体的代谢过程,俗称抗坏血酸,结构如图,已知25℃时,其电离常数,。下列说法正确的是
A.维生素C分子中含有3个手性碳
B.维生素C含碳原子较多,故难溶于水
C.维生素C含有烯醇式结构,水溶液露置在空气中不稳定
D.1mol维生素C与足量NaOH溶液反应,最多可消耗2mol NaOH
10.对于可逆反应,下列说法错误的是
A.当时,该反应达到平衡状态
B.该反应在一定条件下能自发进行,则
C.恒温恒容条件下,若混合气体的颜色保持不变,则该反应达到平衡状态
D.恒温恒容条件下,达平衡状态后,再充入一定量的,转化率将减小
11.下列根据实验操作及现象所得出的结论正确的是
选项 | 实验操作及现象 | 结论 |
A | 淀粉溶液和稀硫酸混合加热后,再加新制的Cu(OH)2悬浊液加热,无砖红色沉淀产生 | 淀粉未水解 |
B | 室温下,向盛有1mL0.2mol·L-1NaOH溶液的试管中滴加2滴0.1mol·L-1MgCl2溶液,产生白色沉淀,再滴加2滴0.1mol·L-1FeCl3溶液,又产生红褐色沉淀 | 室温下,Fe(OH)3的溶解度小于Mg(OH)2 |
C | 向两支试管中分别加入2mL和1mL0.1mol·L-1Na2S2O3溶液,再向盛有1mLNa2S2O3溶液的试管中加入1mL蒸馏水,最后同时向两支试管中加2mL0.1mol·L-1H2SO4溶液,振荡,加入2mLNa2S2O3溶液的试管先出现浑浊 | 其他条件一定时,反应物浓度越大,反应速率越快 |
D | 将SO2通入酸性KMnO4溶液中,取反应后的溶液于试管中,再向试管中加入BaCl2溶液,振荡,产生白色沉淀 | 该环境中SO2的氧化产物为 |
12.某研究小组为探究沉淀能否由一个溶解度较小的物质转化为溶解度较大的物质,设计了如图所示实验流程。
100mL0.1mol/LNa2SO4
已知:该温度下,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=5×10-9,Na2CO3的溶解度为33g。忽略体积变化,下列说法错误的是
A.经过步骤①,溶液中c(Na+)=c(Cl-)
B.经过步骤②,溶液中10c(Cl-)=c(CO)+c(HCO)+c(H2CO3)+c(SO)
C.经过步骤②,约有40%的BaSO4转化为BaCO3
D.只要步骤②中Na2CO3过量,步骤③后沉淀无剩余
13.1889 年,Arrhenius提出了反应速率常数k随温度的变化关系lnk=(R,C均为常数)。已知2NO(g) +O2(g) 2NO2(g) ,经历反应1和反应2两步:
反应1:2NO(g) N2O2(g) ΔH1= -46.3 kJ· mol-1
反应2:N2O2(g) +O2(g)2NO2(g) ΔH2= -65. 7 kJ·mol-1
两步反应的活化能Ea1 < Ea2。某课题组通过实验绘制出两步反应lnK、lnk随 的变化曲线如图所示(K表示平衡常数) ,下列说法中不正确的是
A.2molNO与1molO2充分反应,放出热量小于112kJ
B.曲线③表示的是k2随的变化关系
C.温度越高,单位时间内NO的转化率可能越低
D.相同条件下,O2浓度的变化比NO浓度的变化对反应速率影响更显著
第Ⅱ卷
二、非选择题:共4题,共61分。
14.(15分)和氮氧化物都是空气污染物,科学处理及综合利用是环境科学研究的热点。
(1)某科研小组研究不同条件下溶液常压下吸收烟气的吸收率。
①溶液pH:随着含烟气的不断通入,和硫的吸收率如图1所示:
i:当,硫的总吸收率不断减小,因为浓度较高与反应,生成S,同时产生大量的___________,导致硫的总吸收率减小。
ii:当,硫的总吸收率增大,生成的主要产物为和。和一定条件下反应,生成硫磺和最终回收,反应的化学方程式为___________。
iii:当时,___________导致和硫的总吸收率降低。
②温度:如图2所示,该项目选择常温,一是为了节能,另一个原因是___________。
③其他条件:___________。(任举一例)
(2)联合脱硫脱硝技术,是一种工业工艺技术,采用“35%的氯酸同时脱硫脱氮技术”,处理烟气(含、NO)可获得、HCl、副产品,通过实验发现,当氯酸的浓度小于35%时,和NO的脱除率几乎不变,但生成的量远小于理论值,可能的原因是___________。
15.(15分)茉莉酸甲酯的一种合成路线如下:
(1)C中含氧官能团名称为__________ _。 (2)D→E的反应类型为___________ 。
(3)C中碳原子的杂化方式为___________,K2CO3中CO的空间构型为___________。
(4)已知A、B的分子式依次为C6H10O4、C12H18O4,A中不含甲基,写出B的结构简式___________。
(5)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________。
①分子中含有苯环,能与FeCl3溶液发生显色反应;
②碱性条件水解生成两种产物,酸化后两种分子中均只有3种不同化学环境的氢。
(6)写出以和CH2(COOCH3)2为原料制备的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。___________
16.(15分)氯化镍(NiCl2·6H2O)常用于电镀、陶瓷等工业,某实验室以单质Ni为原料制取氯化镍的实验步骤如下:
已知:①Fe(OH)3完全沉淀pH为3.2;Ni(OH)2开始沉淀pH为7.2,完全沉淀pH为9.2。
②NiCl2易水解,从溶液中获取NiCl2·6H2O须控制pH<2。
(1)在三颈烧瓶中(装置见图)加入一定量Ni粉和水,通入空气,滴入稀硝酸和稀硫酸的混酸,至反应结束,过滤,制得NiSO4溶液。
①反应过程中,为提高稀硝酸的利用率,在不改变投料比的情况下,可采取的合理措施有___________。
②向A装置中通入空气的作用是搅拌、___________。
③若镍粉过量,判断反应完成的现象是___________。
(2)将所得NiSO4溶液与NaHCO3溶液混合反应得到NiCO3·Ni(OH)2沉淀,过滤,洗涤。
①沉淀反应的离子方程式为___________。
②检验NiCO3·Ni(OH)2沉淀是否洗涤完全的方法是___________。
(3)在NiCO3·Ni(OH)2固体中混有少量Fe(OH)3,请补充完整由NiCO3·Ni(OH)2固体制备NiCl2·6H2O的实验方案:向NiCO3·Ni(OH)2固体中加入盐酸,边加边搅拌,___________。
[NiCl2的溶解度曲线如图所示。实验中须选用的仪器和试剂:pH计、盐酸、乙醇等]
17.(16分)某磁性材料(Fe/Fe3O4)广泛应用于磁记录、催化等领域。一种制备该材料的流程如下:
已知反应原理为:
①Fe2++2OH-=Fe(OH)2 ②3Fe(OH)2=Fe+2Fe(OH)3 ③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
(1)用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为_______。
(2)当pH<2时,Fe/Fe3O4产率极低的原因是_______。
(3)图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。回流1h所得产品Fe/Fe3O4中产生杂质可能的原因_______。
(4)采用Pd-Fe3O4双催化剂,可实现用H2消除酸性废水中的NO和NO,反应历程如图3所示。
其中Fe3O4中Fe2+和Fe3+分别用Fe(II)、Fe(III)表示。
①用该法处理废水后,溶液的pH_______。(填“降低”“升高”或“不变”)
②写出过程④反应的离子方程式_______。
③反应历程中虚线方框内NO生成N2的过程可描述为_______。
2023年高考押题预测卷03(江苏卷)-化学(考试版)A4: 这是一份2023年高考押题预测卷03(江苏卷)-化学(考试版)A4,共9页。
2023年高考押题预测卷02(山东卷)-化学(考试版)A4版: 这是一份2023年高考押题预测卷02(山东卷)-化学(考试版)A4版,共11页。
2023年高考押题预测卷02(天津卷)-化学(考试版)A4: 这是一份2023年高考押题预测卷02(天津卷)-化学(考试版)A4,共8页。












