




必刷卷02——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷卷(山东专用)(原卷版+解析版)
展开山东高考化学科目时间:6月9日15:30-17:00,考试时间90分钟,满分100分。试卷结构依然采取10道单选题、5道不定项选择题和5道主观大题的模式。考查内容上预测不会有大的变化,试题情境将更加与实际生产生活相贴切。
本套模拟卷中第2题考查化学药品的配制和保存,第4题将传统文化和化学实验、元素化合物知识相结合,第8题将反应机理和氧化还原反应相结合,第10题考查微型实验探究活动,第14题的电化学涉及双极膜,这些题都值得大家去关注。
本卷满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23 P 31 S 32 Ni 59 As 75
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学和生活、社会发展息息相关。下列说法正确的是
A.将铬、锰加入普通钢中制成不锈钢,使钢铁制品永不生锈
B.核酸检测时用到的“拭子”由尼龙纤维制成,属于有吸附性的天然有机高分子材料
C.化石燃料脱硫与碳达峰、碳中和无关
D.广汉三星堆出土的青铜器深埋于地下而生锈,是因为发生了析氢腐蚀
2.下列有关化学药品的配制和保存的说法中正确的是
A.将盛有与乙醇的试剂瓶保存于同一个药品橱中
B.配制溶液时加入少量防止水解
C.纯碱溶液保存在玻璃塞的试剂瓶中
D.白磷浸泡在冷水中,用广口试剂瓶贮存
3.下列装置能达到实验目的的是
4.《本草图经》记载,中药矾红(又称煅绿矾)具有燥湿化痰、止血补血、解毒敛疮之功效。其炮制过程如下:将绿矾(主要成分为FeSO4∙7H2O)剔除杂质,和米醋同放在砂锅内混合均匀,置于炭炉上小火加热至绿矾完全溶解,用竹片搅拌,炒至固体干燥呈绦色(略浅于红棕色)为度,取出放冷即成。下列有关说法错误的是
A.米醋的作用是防止溶解时产生沉淀阻碍绿矾的溶解
B.用绿矾炮制矾红时,O2与H2O均参与了过程中发生的化学反应
C.将矾红加入水中充分搅拌,静置后向上层清液中加入数滴KSCN溶液,无明显现象
D.胃酸分泌过少、消化能力较弱的人应慎用矾红
5.柠檬酸是一种重要的有机酸,常用作天然防腐剂和食品添加剂,也用于除水垢,其结构如图所示。下列有关柠檬酸的说法错误的是
A.酸性强于碳酸B.元素电负性:
C.可与反应D.分子中碳原子均为杂化
6.为阿伏加德罗常数,下列说法正确的是
A.中含有个极性键
B.二氧化硅晶体中含有键数为
C.将与氧气完全反应,反应中转移的电子数介于到之间
D.硅酸钠溶液中滴入盐酸制硅酸胶体,所得胶粒数目为
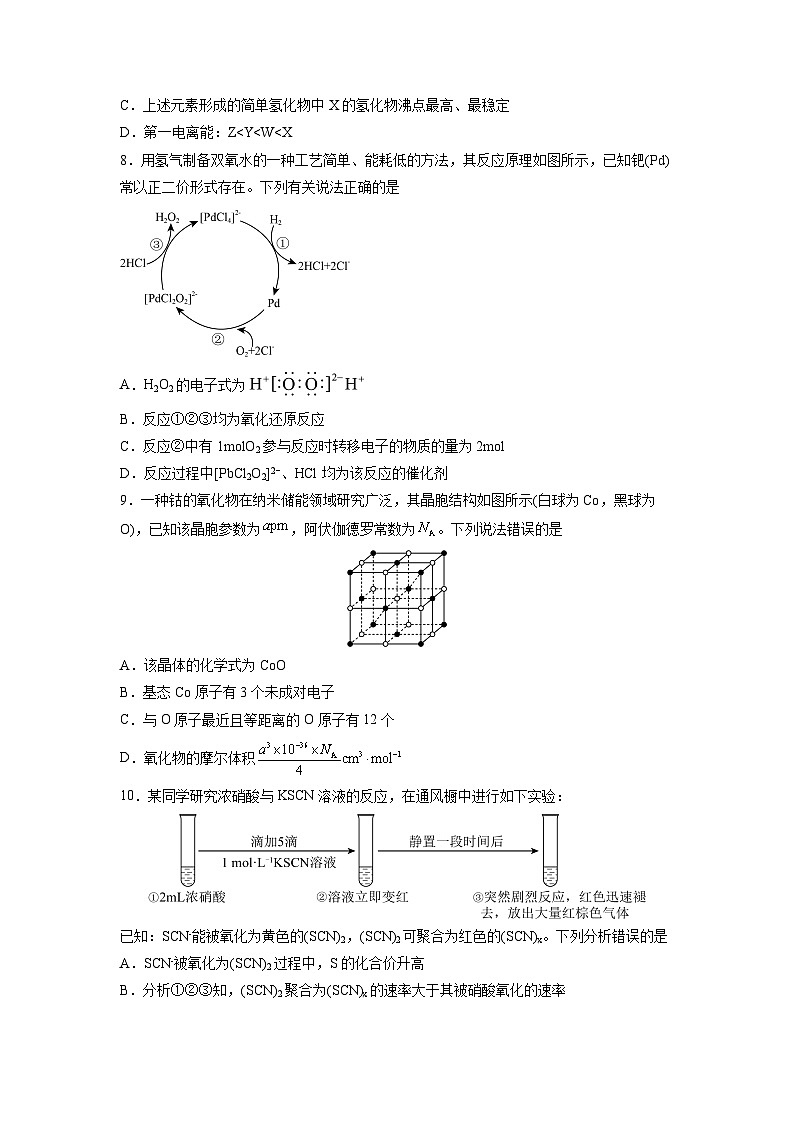
7.X、Y、Z、W均属于短周期元素,其中X、Y位于同一主族,Y、Z、W处于同一周期。X原子的最外层电子数是其电子层数的3倍,基态Z原子的电子总数是其最高能级电子数的5倍,同周期中W电负性最大。下列说法正确的是
A.简单离子半径由小到大的顺序:X
C.上述元素形成的简单氢化物中X的氢化物沸点最高、最稳定
D.第一电离能:Z
A.H2O2的电子式为
B.反应①②③均为氧化还原反应
C.反应②中有1mlO2参与反应时转移电子的物质的量为2ml
D.反应过程中[PbCl2O2]2−、HCl均为该反应的催化剂
9.一种钴的氧化物在纳米储能领域研究广泛,其晶胞结构如图所示(白球为C,黑球为O),已知该晶胞参数为,阿伏伽德罗常数为。下列说法错误的是
A.该晶体的化学式为CO
B.基态C原子有3个未成对电子
C.与O原子最近且等距离的O原子有12个
D.氧化物的摩尔体积
10.某同学研究浓硝酸与KSCN溶液的反应,在通风橱中进行如下实验:
已知:SCN-能被氧化为黄色的(SCN)2,(SCN)2可聚合为红色的(SCN)x。下列分析错误的是
A.SCN-被氧化为(SCN)2过程中,S的化合价升高
B.分析①②③知,(SCN)2聚合为(SCN)x的速率大于其被硝酸氧化的速率
C.取少量③中的溶液加入BaCl2溶液,产生白色沉淀,证明最终有生成
D.①中改用溶有NO2的浓硝酸重复上述实验,溶液先变红后迅速褪色并产生大量红棕色气体,证明NO2氧化性强于浓硝酸
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.利用硫钨矿(主要成分是,还包括FeS、等)制取和单品硅的工艺生产流程如下。已知:常温下,,。
下列说法错误的是
A.中W元素化合价为+6价
B.焙烧时发生反应的方程式为
C.“溶浸”时,不能用烧碱溶液代替纯碱溶液
D.滤渣的主要成分是Si和
12.实验室利用制取高锰酸钠的相关反应的离子方程式如下:
Ⅰ:;
Ⅱ:;
Ⅲ:。
下列说法错误的是
A.反应Ⅰ中氧化产物和还原产物的物质的量比为5∶1
B.酸性条件下的氧化性:
C.可与盐酸发生反应:
D.制得28.4g高锰酸钠时,理论上消耗氯酸钠的物质的量为ml
13.黄鸣龙是唯一一个名字写进有机化学课本的中国人,Wlff-Kishner-黄鸣龙还原反应机理如下(R、R’均代表烃基),下列有关说法不正确的是
A.肼的沸点高于氨气,原因是分子间氢键数目更多,且相对分子质量更大
B.过程①发生加成反应,过程②、③均发生消去反应
C.过程④的反应历程可表示为:+OH—+N2↑+H2O
D.应用该机理,可以在碱性条件下转变为
14.八钼酸铵可用于染料、催化剂、防火剂等。该化合物可通过电渗析法获得,工作原理如图。下列说法错误的是
A.a连接电源正极
B.生成的反应为
C.电解一段时间后,b极附近氨水的浓度减小
D.双极膜附近的移向右侧
15.用溶液滴定溶液,加入的碳酸氢钠溶液体积与溶液pH变化曲线如图所示,其中时溶液中无沉淀,之后出现白色浑浊且逐渐增多,当滴加的溶液体积为25.00mL时,溶液的pH稳定在7.20左右,整个滴定过程中未见气泡产生。下列叙述错误的是
已知:,。
A.a点的混合溶液,
B.a→b的过程中,水的电离程度不断增大
C.总反应的化学方程式:
D.b点的混合溶液,
三、非选择题:本题共5小题,共60分。
16.(12分)我国科研团队研究发现AgCrS2在室温下具有超离子行为,该研究成果为未来新结构二维材料的合成和探索提供了新思路。
(1)基态铬原子价电子排布式为___________,基态硫原子核外最多有___________ 个电子顺时针旋转。
(2)常见含硫的微粒有SO2、SO3、等,的空间构型为___________;SO2、SO3杂化轨道类型相同,但键角SO3大于SO2,原因是___________。氧、硒、碲是与硫同族的元素,上述四种元素对应氢化物分别为H2O、H2S、H2Se、H2Te,熔沸点由高到低顺序是___________。
(3)Cr(O2)2[NH(C2H4NH2)2]是铬的一种配合物。存在Cr的过氧化物的结构特点,1 ml该配合物含有___________个配位键(Cr与O、N均形成了配位键),其中C、N、O三种元素的第一电离能由小到大的顺序是___________。
(4)感光材料硫镓银晶体的晶胞如图所示,与Ga距离最近的S数目为___________个, 若晶体的密度为ρg· cm-3,设阿伏加德罗常数的值为NA,该晶胞体积的计算表达式为___________ ( 用含ρ和NA的代数式表示)nm3。
17.(12分)镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为CuFeS2、FeS2、3NiO●4SiO2●H2O、3MgO●4SiO2●H2O等)中回收Cu、Ni的工艺流程如图所示:
回答下列问题:
(1)中,元素的化合价为_______。
(2)为提高“氧压浸出”的速率,可行的操作有_______(任填一个)。
(3)“氧压浸出”的滤渣有S和_______,该环节中发生的化学反应方程式为_______。
(4)“萃铜”时的反应为:(有机相)(水相)(有机相)(水相),下列说法正确的有_______。
A.向萃取液中加入稀硫酸进行“反萃取”,可得到单质
B.萃余液中的阳离子为:
C.一定条件下,萃取平衡时,,则的萃取率为80%
D.为提高的萃取率,可适当提高溶液
(5)已知,“滤液”中,“沉镍”时,控制为8.50,此时的沉淀率为_______,“沉镍”后的母液,含有的主要溶质为_______(填化学式)。
18.(12分)碘酸钾是常用的食盐加碘剂。某研究小组在实验室采用如下两种方法进行碘酸钾的制备。
方法一:采用如图所示装置,先用高锰酸钾制备氯气,再用氯气氧化碘化钾得到碘酸钾溶液,再经一系列步骤得到碘酸钾产品。
方法二:采用如下实验流程,直接用高锰酸钾氧化碘化钾得到碘酸钾溶液,再经一系列步骤得到碘酸钾产品。
已知:(Ⅰ)是一种白色晶体,在水中溶解度随温度升高而增大;不溶于乙醇。
(Ⅱ)溶液在中性条件下的还原产物为一种不溶于水的沉淀。
(1)方法一中装置a的作用是净化,其中的试剂为_______,装置b的名称为_______。
(2)方法一中多孔球泡装置的作用是_______。
(3)方法二中水浴加热时发生反应的化学方程式为_______。
(4)方法二中滴入适量乙醇的作用是_______。
(5)在获取碘酸钾产品的操作中,下列说法正确的是_______(填字母序号)。
A.加热浓缩过程中需要使用三脚架、泥三角和坩埚等仪器
B.在冷却结晶时,温度过低可能会有杂质析出导致产品不纯净
C.采用抽滤可使过滤速率加快
D.为提高洗涤效果,可用热水进行洗涤
(6)方法二所得产品碘酸钾的纯度测定方案如下:准确称取产品配制成溶液作为待测液,取该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化,盖紧塞子,置于避光处,用的硫代硫酸钠标准溶液滴定,当溶液呈淡黄色时,加入少许指示剂,滴定到溶液为无色。平行滴定三次,平均消耗标准液,计算产品的纯度。已知:。
①指示剂宜选用_______溶液;
②产品碘酸钾的质量分数为_______。
19.(12分)卡龙酸是一种医药中间体,主要作为蛋白酶抑制剂的合成。以下是卡龙酸的一种合成路线(部分试剂和条件省略,不考虑立体异构)。
(1)反应①的反应类型为______。
(2)写出反应②所需的试剂和条件______。
(3)C中含有的官能团名称______。
(4)写出反应③的化学方程式______。
(5)写出B在工业上的主要用途______。
(6)写出一种满足下列条件,A同分异构体的结构简式_____。
①能发生银镜反应;②有2种不同化学环境的氢原子
(7)结合相关信息,设计以乙炔和乙醇为原料,合成的合成路线。(无机试剂任选)______。
(合成路线可表示为:A……B目标产物)
20.(12分)苯乙烯是生产塑料与合成橡胶的重要原料。氧化乙苯脱氢制苯乙烯的反应为:
反应I:
已知:
反应II:
反应III:
回答下列问题:
(1)反应I的__________。
(2)下列关于反应I~III的说法正确的是______(填标号)。
A.及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量
B.保持恒定时,说明反应I达到化学平衡状态
C.其他条件相同,反应II分别在恒容和恒压条件下进行,前者乙苯的平衡转化率更高
D.反应III正反应的活化能小于逆反应的活化能
(3)在催化剂作用下,氧化乙苯脱氢制苯乙烯可能存在如下图所示反应机理:
该机理可表示为以下两个基元反应,请补充反应ⅱ:
ⅰ:;
ⅱ:__________.
(4)常压下,乙苯和经催化剂吸附后才能发生上述反应I。控制投料比[∶n(乙苯)]分别为1∶1、5∶1和10∶1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:
①乙苯平衡转化率相同时,投料比越高,对应的反应温度越______(填“高”或“低”)。
②相同温度下,投料比远大于10∶1时,乙苯的消耗速率明显下降,可能的原因是:
ⅰ.乙苯的浓度过低;
ⅱ.__________。
③850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n ml,则v(苯乙烯)=______。
(5)700K时,向恒容密闭容器中加入过量和一定量乙苯,初始和平衡时容器内压强分别为和,则平衡时苯乙烯的分压为______kPa(以含有、、p的代数式表示)。[已知:①混合气体中某组分的分压等于总压与该气体物质的量分数之积;以平衡分压代替平衡浓度进行计算,可得反应的分压平衡常数。② ]A.从食盐水中提取NaCl
B.除中的
C.制取并收集氨气
D.检查装置的气密性
必刷卷02——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷卷(重庆专用)(原卷版+解析版): 这是一份必刷卷02——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷卷(重庆专用)(原卷版+解析版),文件包含必刷卷02高考三轮冲刺2023年高考化学考前20天冲刺必刷卷重庆专用解析版docx、必刷卷02高考三轮冲刺2023年高考化学考前20天冲刺必刷卷重庆专用原卷版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
必刷卷02——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷卷(辽宁专用)(原卷版+解析版): 这是一份必刷卷02——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷卷(辽宁专用)(原卷版+解析版),文件包含必刷卷02辽宁专用解析版docx、必刷卷02辽宁专用原卷版docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。
必刷卷02——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷卷(浙江专用)(原卷版+解析版): 这是一份必刷卷02——【高考三轮冲刺】2023年高考化学考前20天冲刺必刷卷(浙江专用)(原卷版+解析版),文件包含必刷卷02高考三轮冲刺2023年高考化学考前20天冲刺必刷卷浙江专用解析版docx、必刷卷02高考三轮冲刺2023年高考化学考前20天冲刺必刷卷浙江专用原卷版docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。












