






化学选择性必修2第一单元 原子核外电子的运动课文配套ppt课件
展开1了解核外电子运动、电子云轮廓图和核外电子运动的状态。2.会书写和说明1~36号元素基态原子的核外电子排布式和轨道表示式。3.了解泡利原理、洪特规则和能量最低原理
1.构造原理在多电子原子中,电子在能级上的排布顺序是:电子先排在能量较低的能级上,然后依次排在能量较高的能级上,如图所示:
2.核外电子的填充顺序根据构造原理,绝大多数元素原子核外电子的排布都遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d……3.能级交错现象从构造原理示意图(见P1要点三)可以看出,从第三能层开始,不同能层的能级出现“能级交错”现象。能级交错是指能层序数较大的某些能级的能量反而低于能层序数较小的能级的能量的现象。如E(3d)>E(4s)、E(4d)>E(5s)、E(4f)>E(6s)等。能级交错可表示为ns<(n-2)f<(n-1)d
2.复杂原子的电子排布式对于较复杂的电子排布式,应先按能量从低到高排列,然后将同一能层的电子移到一起。如26Fe:先按能量从低到高排列为1s22s22p63s23p64s23d6,然后将同一能层的能级移到一起,即该原子的电子排布式为1s22s22p63s23p63d64s2,简化为[Ar]3d64s2。3.离子的电子排布式元素原子得或失电子转化为相应的阴离子或者阳离子时,一般是元素原子核外最外电子层上的电子数发生变化。
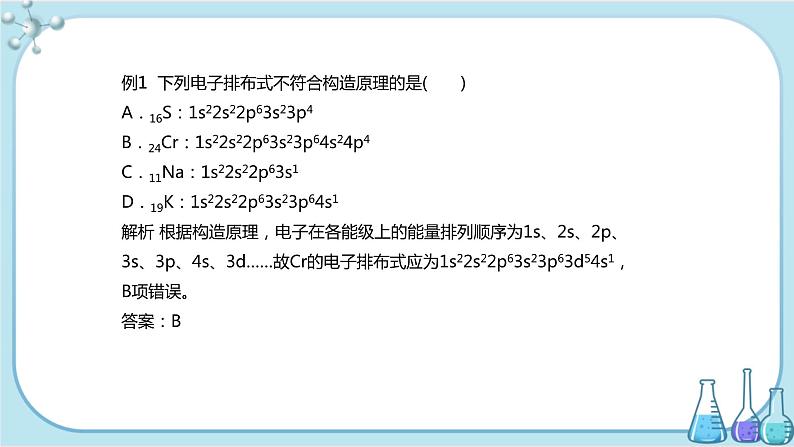
例1 下列电子排布式不符合构造原理的是( )A.16S:1s22s22p63s23p4B.24Cr:1s22s22p63s23p64s24p4C.11Na:1s22s22p63s1D.19K:1s22s22p63s23p64s1解析 根据构造原理,电子在各能级上的能量排列顺序为1s、2s、2p、3s、3p、4s、3d……故Cr的电子排布式应为1s22s22p63s23p63d54s1,B项错误。答案:B
二 核外电子排布的原则
三 原子核外电子排布表示方法
小结:1.原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。处于最低能量的原子叫做基态原子。2.泡利原理:在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反。3.洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。4.电子在原子核外的一个空间运动状态称为一个原子轨道,s能级只有一个原子轨道,p能级有三个原子轨道:px、py、pz。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率公开课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率公开课课件ppt,共16页。PPT课件主要包含了学习目标,内因主要因素,注意以下两种情况,产生气泡速率较慢,产生气泡速率较快,产生气泡速率很慢,△HE-E等内容,欢迎下载使用。
苏教版 (2019)第一单元 分子的空间结构课文配套课件ppt: 这是一份苏教版 (2019)第一单元 分子的空间结构课文配套课件ppt,共14页。PPT课件主要包含了判断方法,①双原子分子,共价键的极性,分子空间构型,决定分子极性,δ-δ-,CO2,极性键,非极性键,二手性分子等内容,欢迎下载使用。
化学选择性必修2第一单元 分子的空间结构课文配套ppt课件: 这是一份化学选择性必修2第一单元 分子的空间结构课文配套ppt课件,共27页。PPT课件主要包含了问题探究一,Sp2杂化,C-C,sp3,sp2,C=C,C≡C,直线形,平面三角形,四面体等内容,欢迎下载使用。














