




鲁科版 (2019)选择性必修1第1节 化学反应的方向备课课件ppt
展开1.结合图像,理解化学反应的历程,正确计算反应的活化能、反应热,确定反应的决速步,培养证据推理与模型认知的化学核心素养。2.在学习化学平衡常数(K)的基础上理解压强平衡常数,能利用Kp进行相关计算,培养证据推理与模型认知的化学核心素养。
重难探究•能力素养全提升
探究一 活化能与反应历程
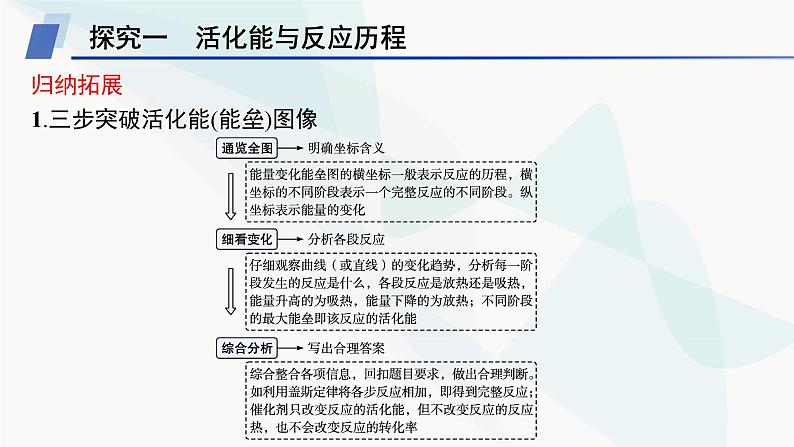
归纳拓展1.三步突破活化能(能垒)图像
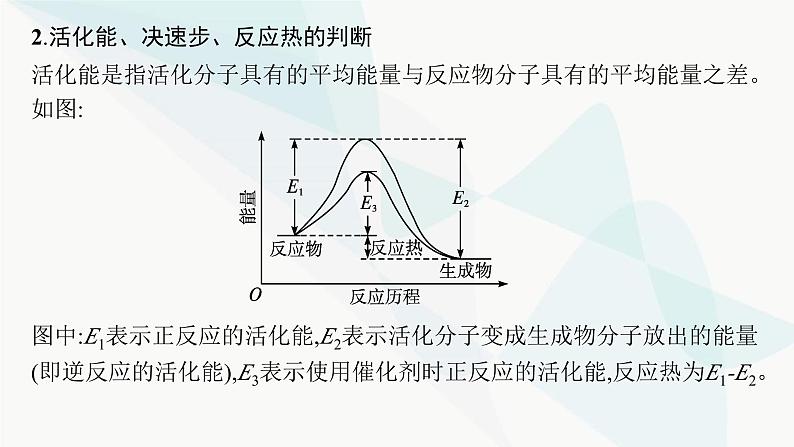
2.活化能、决速步、反应热的判断活化能是指活化分子具有的平均能量与反应物分子具有的平均能量之差。如图:
图中:E1表示正反应的活化能,E2表示活化分子变成生成物分子放出的能量(即逆反应的活化能),E3表示使用催化剂时正反应的活化能,反应热为E1-E2。
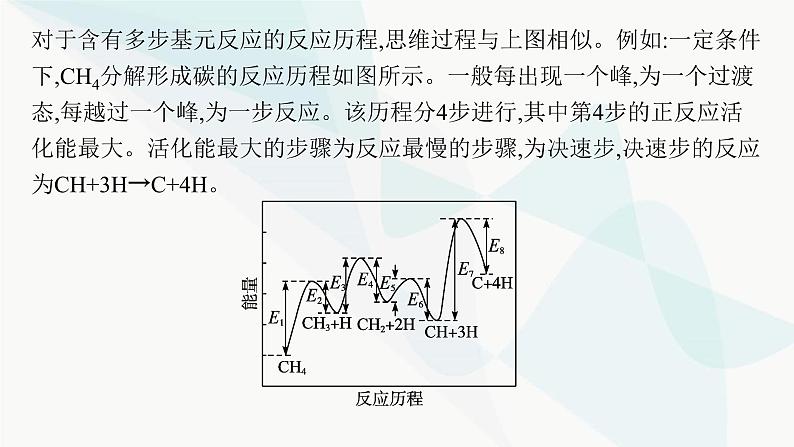
对于含有多步基元反应的反应历程,思维过程与上图相似。例如:一定条件下,CH4分解形成碳的反应历程如图所示。一般每出现一个峰,为一个过渡态,每越过一个峰,为一步反应。该历程分4步进行,其中第4步的正反应活化能最大。活化能最大的步骤为反应最慢的步骤,为决速步,决速步的反应为CH+3H→C+4H。
反应热的计算有两种方法:①根据正、逆反应的活化能,本题中总反应的ΔH=E1+E3+E5+E7-E2-E4-E6-E8;②根据反应物和生成物的相对能量,ΔH=E(生成物)-E(反应物)。计算ΔH时,还应注意图像中能量的单位,我们通常使用的ΔH单位为kJ·ml-1,如图像中能量的单位为电子伏(eV),则图中微粒的量指的是微粒个数,如E eV单位换算后ΔH=E×1.6×10-19×6.02×1023×10-3 kJ·ml-1=96.32E kJ·ml-1。
应用体验视角1 直线式历程1.(常规性反应历程)工业上利用NH3对烟道气进行脱硝(除氮氧化物)的SCR技术具有效率高、性能可靠的优势。SCR技术的原理为NH3和NO在催化剂(MnO2)表面转化为N2和H2O,反应历程中的相对能量变化如图所示。下列说法正确的是( )
A.总反应方程式为6NO+4NH3 5N2+6H2O(ΔH<0)B.NH2NO是脱硝反应的催化剂C.升高温度,脱硝反应的正反应速率的增大程度大于其逆反应速率的增大程度D.决定反应速率的步骤是“NH2NO的转化”
解析 由已知SCR技术的原理为NH3和NO在催化剂(MnO2)表面转化为N2和H2O可知,总反应的方程式为6NO+4NH3 5N2+6H2O,根据反应物和生成物的相对能量高低,可以确定该反应为放热反应,A正确;观察相对能量-反应历程曲线知,NH3吸附在催化剂表面后,经过一定的反应形成了NH2NO,NH2NO又经过反应得到N2和H2O,所以NH2NO是脱硝反应的活性中间体,B错误;该反应为放热反应,升高温度平衡逆向移动,所以升高温度后,脱硝反应的正反应速率的增大程度小于其逆反应速率的增大程度,C错误;根据曲线表明,全过程中H的移除过程活化能最大,其速率是全过程几步反应中最慢的,决定了反应的速率,是总反应的决速步骤,D错误。
2.(通过模型表示微粒的组成)硫酸盐(含 )气溶胶是PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如图:
下列说法不正确的是( )A.该过程有H2O参与B.NO2是生成硫酸盐的氧化剂C.硫酸盐气溶胶呈酸性D.该过程没有生成硫氧键
3.(竞争反应历程)我国科研人员在银催化简单烷烃的区域选择性方面取得了重要突破,有效克服烷烃C—H键的惰性并实现其区域选择性活化。一种对烷烃C—H键的选择性插入反应历程如图所示。下列说法正确的是( )
A.Ⅰ、Ⅱ、Ⅲ三种物质中,最稳定的是ⅡB.总反应速率取决于由中间体1生成中间体2的一步C.升高温度,三个反应的速率均加快,有利于提高烷烃的转化率D.催化剂对化学反应具有选择性,生成不同产物的同时改变了反应的焓变
解析 物质能量越低越稳定,Ⅰ、Ⅱ、Ⅲ三种物质中最稳定的是Ⅰ,A错误;化学反应的速率取决于历程中反应慢的过程,中间体1生成中间体2的反应活化能最高,决定了总反应的速率,B正确;三个反应均为放热反应,升高温度,平衡向逆反应方向移动,烷烃的转化率降低,C错误;催化剂具有选择性,只影响化学反应速率,不改变反应的焓变,D错误。
4.(列表型反应历程)水煤气变换反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0(简称WGS),在金属催化剂Au(Ⅲ)表面上发生的所有基元反应步骤的活化能数值(单位:kJ·ml-1)如下表,其中*表示催化剂表面活性位,X*表示金属表面活性位吸附物种。
其他条件一定时,决定WGS反应速率的基元反应为 (填编号),基元反应CO*+O* CO2*+*的焓变ΔH= kJ·ml-1。由表中数据计算WGS反应的焓变ΔH= kJ·ml-1。
解析 分析表中数据,反应所需要的活化能越高,反应越难发生,所以该机理中WGS反应速率决速步骤是②,基元反应CO*+O* CO2*+*对应的是⑥ΔH=37 kJ·ml-1-203 kJ·ml-1=-166 kJ·ml-1,WGS反应的焓变ΔH=(150+71+74+37+17) kJ·ml-1-(67+67+25+42+203) kJ·ml-1=-55 kJ·ml-1。
5.(框图式反应历程)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
说明:①C(ads)为吸附性活性炭,E表示方框中物质的总能量(单位:kJ·ml-1), TS表示过渡态。②相关化学键键能为C—H(413 kJ·ml-1),C=O(745 kJ·ml-1),C≡O(1 075 kJ·ml-1)下列说法不正确的是( )A.制备合成气总反应的ΔH可表示为(E5-E1) kJ·ml-1B.若E3+E2
解析 根据图示可知,在催化剂的作用下,C2H4与NO、O2反应最终生成N2、CO2、H2O,反应中n(NO)∶n(O2)=2∶1,反应总方程式为6NO+3O2+2C2H4 3N2+4CO2+4H2O。
(2)用Ni2+可直接催化NO分解生成N2、O2,将其反应机理补充完整(V代表氧空穴):2Ni2++2V+2NO→2Ni3++2O-+N2
______________________________。
7.(双循环型历程)据文献报道,某反应的反应历程如图所示,下列有关该历程的说法错误的是( )
A.Ti4+是催化剂B.Ti4+…NH2—N=O是中间产物C.总反应化学方程式为4NH3+3O2 2N2+6H2OD.Ti4+…NH2—N=O→Ti4++N2+H2O属于分解反应
解析 图中Ti4+在整个反应中参与了反应,最后又生成,所以是催化剂,A正确;反应中加入NO后生成Ti4+…NH2—N=O,后又生成Ti4+,得出Ti4+…NH2—N=O是中间产物,B正确;根据反应历程,参加反应的有O2、NH3和NO,生成物有N2和H2O,可以写出反应方程式为2NO+4NH3+2O2 3N2+6H2O,C错误;反应中Ti4+…NH2—N=O→Ti4++N2+H2O由一种物质生成多种物质,属于分解反应,D正确。
探究二 压强平衡常数Kp的计算方法
归纳拓展气体的压强平衡常数(Kp)(1)气体的分压p(B)。相同温度下,当某组分气体B单独存在且具有与混合气体总体积相同的体积时,该气体B所具有的压强,称为气体B的分压强,简称气体B的分压。符号为p(B),单位为Pa或 kPa或MPa。
(2)分压定律。①分压定律:混合气体的总压等于相同温度下各组分气体的分压之和。p(A)+p(B)+p(C)+p(D)+…=p
应用体验视角1 压强平衡常数的理解和简单计算
归纳总结 压强平衡常数(Kp)的计算流程
视角2 恒容条件下压强平衡常数的计算3.(2022湖南卷节选)2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:在一定温度下,向容积固定的密闭容器中加入足量的C(s)和1 ml H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:Ⅰ.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4 kJ·ml-1Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1 kJ·ml-1反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 ml。此时,整个体系 (填“吸收”或“放出”)热量 kJ,反应Ⅰ的平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
解析 反应平衡时,H2O(g)的转化率为50%,则水的变化量为0.5 ml,平衡时n(H2O)=0.5 ml,由于n(CO)=0.1 ml,则根据O原子守恒可知n(CO2)=0.2 ml;由H原子守恒可知,n(H2)=0.5 ml。根据相关反应的热化学方程式可知,反应过程可看作反应Ⅰ中生成了0.3 ml CO,后在反应Ⅱ中又有0.2 ml CO转化为CO2,反应Ⅰ吸收热量131.4 kJ·ml-1×0.3 ml=39.42 kJ,反应Ⅱ生成0.2 ml CO2要放出热量41.1 kJ·ml-1×0.2 ml=8.22 kJ,因此整个体系吸收热量39.42 kJ-8.22 kJ=31.2 kJ。平衡时,n(H2O)=0.5 ml,n(CO)=0.1 ml,n(CO2)=0.2 ml,n(H2)=0.5 ml,则平衡时气体的总物质的量为0.5 ml+0.1 ml+0.2 ml+0.5 ml=1.3 ml。在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,则平衡体系的总压为0.2MPa×1.3=0.26MPa,反应Ⅰ的平衡常数
归纳总结 运用Kc、Kp解题的注意事项三段式是解平衡计算题的万能钥匙,解题时必须注意以下三点:(1)Kc或Kp利用的是平衡浓度和平衡时的物质的量分数。(2)一定看清题目是恒温恒容还是恒温恒压,在恒温恒容条件下计算Kp,反应过程中压强可能改变,导致平衡时压强与起始压强不同;在恒温恒压条件下计算Kc,反应过程中容积可能改变,导致平衡时浓度与起始浓度不能直接运算,这两种情况下列三段式时一般用物质的量。(3)恒容条件下,若压强发生变化时计算Kp,一般需要先求出平衡时的总压p总,也可直接运用各气体的分压进行计算(注意:恒压条件下一般不能直接代入气体的分压进行计算),切忌直接代入起始压强进行计算。
4.用测压法在刚性密闭容器中探究T ℃时4NO(g) N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
(1)20 min时,NO的转化率α= %。 (2)T ℃时,该反应的压强平衡常数Kp= (Kp为用分压表示的平衡常数)。
鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率本章综合与测试评课ppt课件: 这是一份鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率本章综合与测试评课ppt课件,共28页。PPT课件主要包含了双基夯实·课前排查,核心突破·要点讲解,夯实基础·一遍落实,答案A,答案AD等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡课文ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡课文ppt课件,共32页。PPT课件主要包含了答案B,02Mpa等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四节 化学反应的调控作业课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第四节 化学反应的调控作业课件ppt,共17页。PPT课件主要包含了答案A等内容,欢迎下载使用。













