




化学第二单元 物质的化学计量完美版ppt课件
展开1. 了解物质的聚集状态
2. 认识决定物质体积的因素
3. 掌握气体摩尔体积的概念
物质的三态液态(liquid)气态(gas)固态(slid) 晶体(crystal)、非晶态物质(amrphus material)
晶体——具有规则的几何外形和固定的溶点。如 氯化钠 NaCl 方解石CaCO3 萤石CaF2熔点: 801℃ 强热分解 1402℃
非晶态物质——没有固定熔点和规则的几何外形。石蜡:12~18个碳的碳氢化合物,易燃,没有固定熔点 玻璃 :二氧化硅、硅酸钙,硅酸钠的混合物,无固定熔沸点
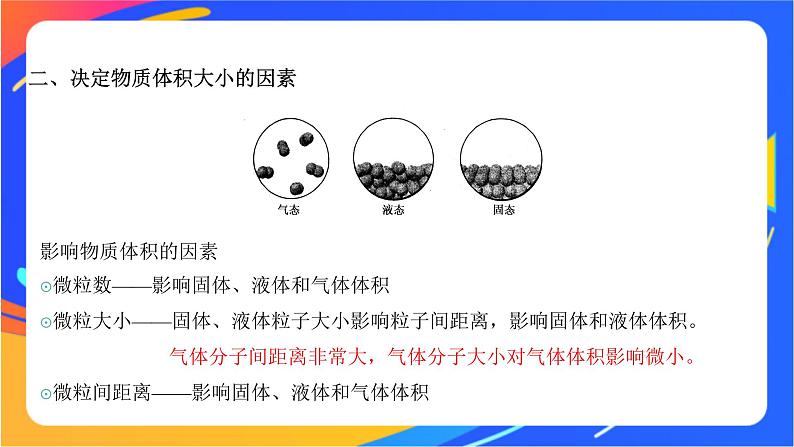
二、决定物质体积大小的因素
影响物质体积的因素微粒数——影响固体、液体和气体体积微粒大小——固体、液体粒子大小影响粒子间距离,影响固体和液体体积。 气体分子间距离非常大,气体分子大小对气体体积影响微小。微粒间距离——影响固体、液体和气体体积
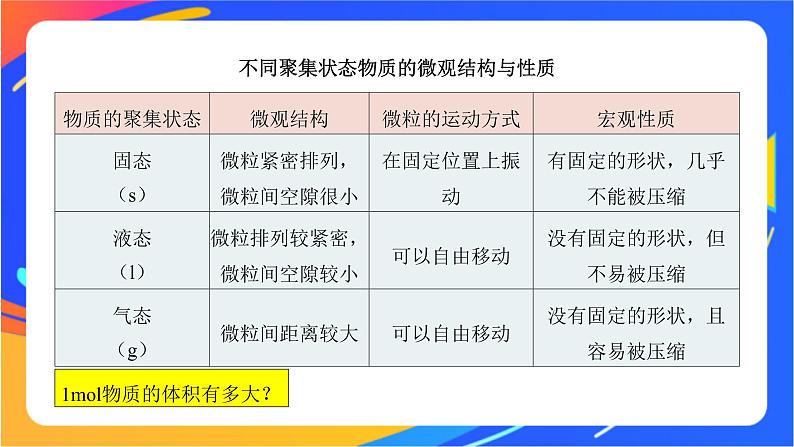
不同聚集状态物质的微观结构与性质
1ml物质的体积有多大?
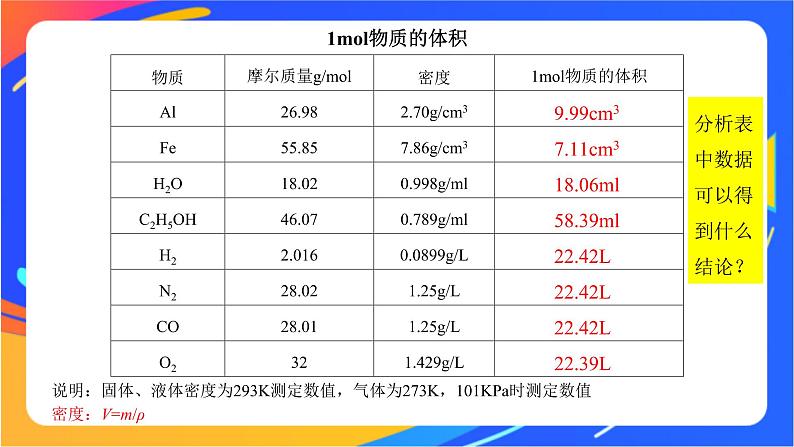
说明:固体、液体密度为293K测定数值,气体为273K,101KPa时测定数值
分析表中数据可以得到什么结论?
1.1ml不同固态或液态物质,体积不同。2.在相同条件下,1ml不同气体物质体积基本相同。
不同状态的物质,体积大小跟哪些因素有关呢?
首先我们来分析1ml固态和液态物质体积为什么不同。
固态结构微粒间的距离很小
液态结构微粒间的距离也小
影响1ml固体和液体物质体积的因素有哪些?
1ml固体或液体的体积只与构成这种物质的粒子大小有关,由于不同物质微粒大小不相等,所以不同固体或液体的体积不同
1mlH2Om=1ml×18g/ml=18gV=18g/1g/ml=18ml
1mlH2SO4m=1ml×98g/ml=98gV=98g/18.4g/ml=54.1ml
下面我们来分析1ml不同气态物质在相同条件下体积为什么基本相同。 首先我们来研究水的汽化
原因:由液态到气态,粒子间距显著增大。
结论:温度升高,体积增大,温度降低,体积减小
原因:温度升高,粒子间距增大,温度降低,粒子间距减小。
现在我们来分析一下温度和压强对气体体积的影响
结论:压强增大,体积减小,压强减小,体积增大
原因:压强增大,粒子间距减小,压强减小,粒子间距增大。
1. 气体分子间距离——温度和压强2. 气体分子平均距离是分子直径的10倍左右,气体分子大小可做忽略处理3. 气体分子数
影响1ml不同气体体积的因素是什么
粒子数目 粒子间距 粒子大小
影响1ml物质体积大小的因素
如果温度和压强一定,微粒间平均距离一定,体积也就一定。
条件:标准状况(STP) 0℃、 1.01×105 Pa 对象:1ml任何气体,可以是单一纯净的气体,也可以是混合气体。
标况下,1ml任何气体的体积都约为22.4L,与气体的种类无关,与是否为混合气体无关
2. 在同温同压下,相同体积的任何气体,其粒子数 ;
3. 在同温同压下,相同粒子数的任何气体,其体积 ;
4. 在同温同压下,任何气体体积的大小与分子数目成 比。
(相同,但不一定是22.4L)
1. 在一定温度和压强下,并不一定是标准状况,1ml任何气体体积是否相同?
同温同压下,相同体积的任何气体具有相同的体积——阿伏伽德罗定律
定义:单位物质的量的气体所占的体积。符号:Vm单位:L/ml或m3/ml等公式:Vm= ——标准状况下,Vm=22.4 L/ml
填写下列空白:(1)标况下,0.5mlH2占有的体积是 L(2)标况下, 2mlO2占有的体积是 L(3)标况下,4.48LCO2的物质的量是 ml(4)标况下,33.6LH2 的物质的量是 ml(5)标况下,16gO2 的体积为 L(6)标况下, 11.2LN2 中含有N2分子的个数是
气体的摩尔体积考查常见干扰点
1. 非标况下使用22.4L/ml或者不标明状态2. 描述对象是气态物质,注意标况下非气态物质干扰3. 气体体积与是否为混合气体无关4. 注意除分子数外,温度和压强共同决定气体体积,所以非标况下气体的摩尔体积也可能为22.4L/ml5. 同温同压不一定是标况
1. 标准状况下,1ml任何物质的体积都约是22.4L。
2. 1ml气体的体积约为22.4L。
3. 标准状况下,1mlO2和N2混合气体的体积约为22.4L。
(错,应标明条件-标准状况)
(对,气体体积与分子种类无关)
(错,未指明气体体积是否在相同条件下测定)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
5. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/ml。
6. 标况下,18gH2O的体积为22.4L。
(错,标况下H2O不为气态)
1. 若考查题目中出现物质体积,先考虑是否为气体,如果是气体再考虑是否为标况。2. 常见标况下是液体或固体的物质:CCl4、H2O、SO3、苯、酒精、CHCl3、己烷、辛烷等。3. 一定温度和压强下,气体体积大小只与气体分子数有关,与气体分子种类和是否为混合气体无关。4. 气体的摩尔体积不一定只有在标况下才为22.4L/ml。
1. 影响物质体积的因素:微粒大小、微粒间距离、微粒数。
2. 影响气体体积的因素:气体分子数、分子间距离。
3. 影响气体分子间距离因素:温度、压强。
4. 标况下气体摩尔体积公式 。
5. 进行气体摩尔体积计算时需要注意 条件:标准况状 0℃ 101kPa 对象:所有气体,既可以为纯净气体也可以为混合气体
1. 一定能够影响物质体积的因素有( )A.微粒数目 B.分子间距离 C.微粒大小不同 D.物质粒子的质量
2. 关于O2气体叙述正确的是( )A.O2摩尔体积为22.4L B.常温常压下1mlO2的体积为22.4LC.标况下22.4LO2的质量为32g D.NA个O2分子的体积为22.4L
【解析】气体的摩尔体积只有在标况下才是22.4L/ml,A、B错;标况下22.4L为1ml,质量为1ml×32g/ml=32g,C正确;D项D.NA个O2分子为1ml,标况下为22.4L,D错。
3. 下列叙述正确的是( )A.标况下,22.4L己烷含有的分子数为NAB.常温常压下,28gCO和N2混合气体体积为与足量盐酸反应生成22.4LH2D.标况下,22.4LH2和O2混合气体所含的分子数为NA
【解析】己烷标况下为液态,A错;B项非标况,体积不一定为22.4L,B错;C项没有注明状况,错;D项,气体体积与气体分子种类无关,与是否为混合气体无关,D正确。
4. 下列两种气体的分子数一定相等的是( )A.等温、等压的SO2和O2B.等温等体积的N2和O2C.等压等体积的H2和CO2D.等质量的N2和CO
【解析】同温同压下,相同体积的任何气体具有相同的分子数,“三同定一同”,A、B、C只有“两个同”,不能确定分子数是否相等,错;D项N2和CO的摩尔质量都是24g/ml,质量相同时物质的量相同,分子数相等,D正确。
5. 同温同压下,质量相同的下列气体体积最大的是( )A.O2 B.Cl2 C.SO2 D. CH4
苏教版 (2019)专题1 物质的分类及计量第二单元 物质的化学计量教课内容ppt课件: 这是一份苏教版 (2019)专题1 物质的分类及计量第二单元 物质的化学计量教课内容ppt课件,共31页。PPT课件主要包含了学业基础,物质的量,L·mol-1,kPa,核心素养,学考评价等内容,欢迎下载使用。
高中化学第二单元 物质的化学计量教课ppt课件: 这是一份高中化学第二单元 物质的化学计量教课ppt课件,共31页。PPT课件主要包含了1mol,05mol,16g,相等的,想一想,算一算,02×1023,思考交流,粒子大小,粒子间距等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第二节 化学计量在实验中的应用示范课ppt课件: 这是一份高中化学人教版 (新课标)必修1第二节 化学计量在实验中的应用示范课ppt课件,共16页。PPT课件主要包含了电解水实验视频,探究讨论,1mol,05mol,结论相同条件下,问题导学,不相等,知识解读,a粒子的数目,b粒子的大小等内容,欢迎下载使用。













