



人教版 (2019)选择性必修2第二章 分子结构与性质第三节 分子结构与物质的性质复习课件ppt
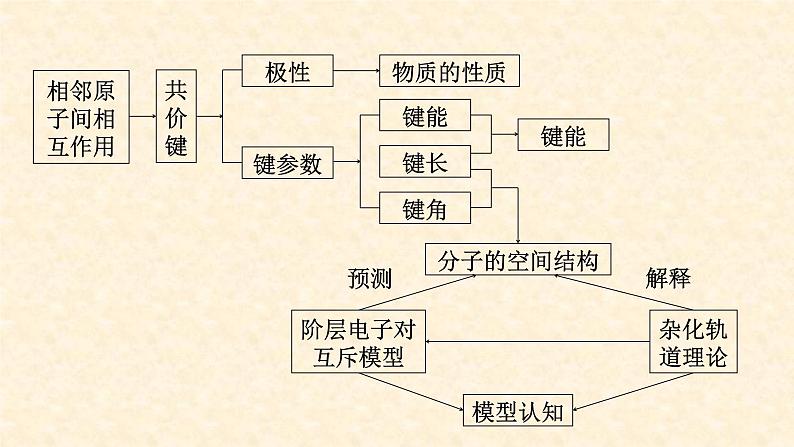
展开间通 所形成的 叫做共价键。
原子间通过 (即原子轨道重叠)产生的强烈作用
(共价键极性强弱的比较:电负性差值越大,极性越强)
头碰头;轴对称;形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
肩并肩;镜面对称;π键不如σ键牢固比较容易断裂;
共价单键是σ键共价双键中有1个σ键,1个π键共价三键中有1个σ键,2个π键
描述分子的立体构型的重要因素
一般地,形成的共价键的键能越大,键长越短,共价键越稳定,含有该键的分子越稳定,化学性质越稳定。
相同的成键原子:单键键长 > 双键键长 >叁键键长
键长和键角的数值可通过晶体的X射线衍射实验获得
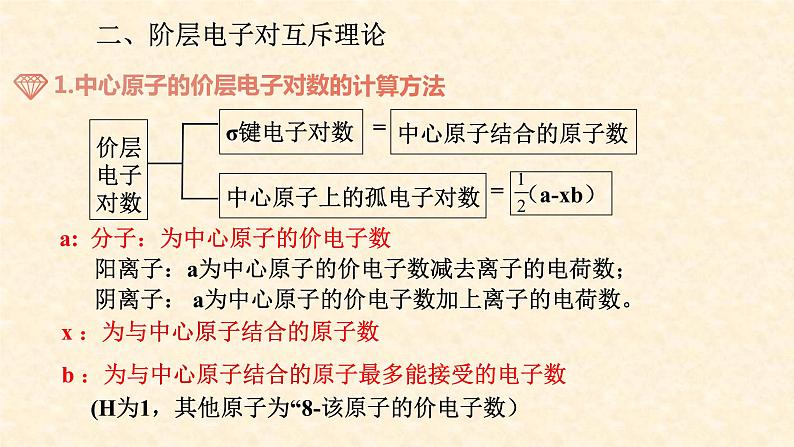
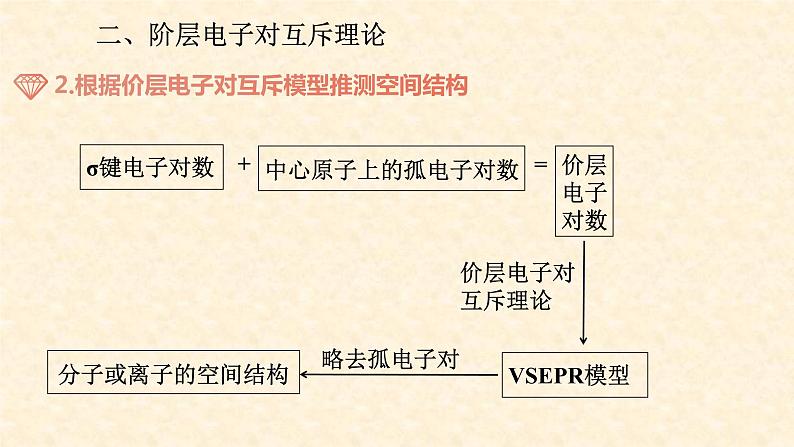
二、阶层电子对互斥理论
a: 分子:为中心原子的价电子数 阳离子:a为中心原子的价电子数减去离子的电荷数; 阴离子: a为中心原子的价电子数加上离子的电荷数。
x :为与中心原子结合的原子数
b :为与中心原子结合的原子最多能接受的电子数 (H为1,其他原子为“8-该原子的价电子数)
在外界条件影响下,中心原子能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。
原子轨道杂化后形成的一组新的原子轨道
①杂化轨道数等于参与杂化的原子轨道数
②杂化改变了原子轨道的形状和方向
③杂化使原子的成键能力增强
④杂化轨道用于构建分子的σ轨道和孤电子对轨道
中心原子孤对电子对数+中心原子结合的原子数
=中心原子的价层电子对数
四、键的极性和分子极性
(1)可依据分子中化学键的极性的向量和进行判断
(2)可依据分子中正负电中心是否重合进行判断
中心原子化合价的绝对值
(4)根据分子的空间结构判断
三氯乙酸的酸性大于二氯乙酸,是由于氯的电负性大于氢的电负性,使Cl3C-的极性 大于 Cl2HC-的极性,导致三氯乙酸的羧基中的羟基的极性更大,更容易电离出氢离子。
1.试解释三氯乙酸的酸性大于二氯乙酸、二氯乙酸的酸性大于氯乙酸的原因?
2.试解释乙酸的酸性大于丙酸的原因?
烃基是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
范德华是最早研究分子间普遍存在作用力的科学家,因而把这类分子间作用力称为范德华力
①范德华力很弱,比化学键的键能小1~2数量级
②范德华力一般没有方向性和饱和性
相对分子质量越大,范德华力越大
分子极性越大,范德华力越大
组成和结构相似的分子,相对分子质量越大,范德华力越大,熔沸点越高。
氢键是由已经与____________的原子形成共价键的________ (如水分子中的H)与另一个电负性很大的原子(如水分子中的O)之间形成的作用力。
除了范德华力之外的另一种分子间作用力
① X、Y为N、O、F②A、B可以相同,也可以不同 ③“—”表示共价键,“•••”表示形成的氢键
②存在分子内氢键使物质熔、沸点降低。
①存在分子间氢键的物质一般具有较高的熔、沸点。
邻羟基苯甲醛的沸点低于对羟基苯甲醛
(1) 对物质熔、沸点的影响
(2) 对水分子性质的影响
①水结冰时,体积膨胀,密度降低
②接近水的沸点的水蒸气的相对分子质量的测定值比按化学式H2O计算出来的相对分子质量大。
用氢键解释这种异常性:接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成所谓的缔合分子。
氢键的存在迫使在四面体中心的水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水小。
非极性溶质一般能溶于 ,极性溶质一般能溶于 。
溶质和溶剂的分子结构相似程度越大,其溶解性越 ,
溶剂和溶质之间的氢键作用力越大,溶解性越好;无氢键相互作用的溶质在有氢键的水中溶解度就比较小
具有完全相同的 和 的一对分子,如同左手和右手一样互为 ,却在三维空间里不能 ,互称手性异构体(或对映异构体)
手性分子在生命科学和药物生产方面有广泛的应用。对于手性药物,一个异构体可能是有效的,而另一个异构体可能是无效甚至是有害的。
高中化学人教版 (2019)选择性必修2第一节 共价键集体备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一节 共价键集体备课课件ppt,共36页。PPT课件主要包含了内容索引,自主预习·新知导学,合作探究·释疑解惑,课堂小结,2π键,问题引领,归纳提升,典型例题等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二章 分子结构与性质本章综合与测试教学演示课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第二章 分子结构与性质本章综合与测试教学演示课件ppt,共28页。PPT课件主要包含了σ键对数,孤电子对数,分子的立体构型,VSEPR模型,价层电子对数,杂化轨道类型,σ键个数,a-xb2,①确定价层电子对数,②判断VSEPR模型等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 共价键教课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一节 共价键教课ppt课件,共41页。PPT课件主要包含了内容索引,课前篇素养初探,课堂篇素养提升,素养目标,2σ键,3π键等内容,欢迎下载使用。













