





高中化学人教版 (2019)选择性必修2第三章 晶体结构与性质第二节 分子晶体与共价晶体备课课件ppt
展开1.结合具体实例,说出分子晶体、共价晶体的微粒间相互作用与物质性质(熔点、硬度)的关系,培养宏观辨识与微观探析的化学核心素养。2.借助分子晶体、共价晶体等模型认识晶体的结构特点,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
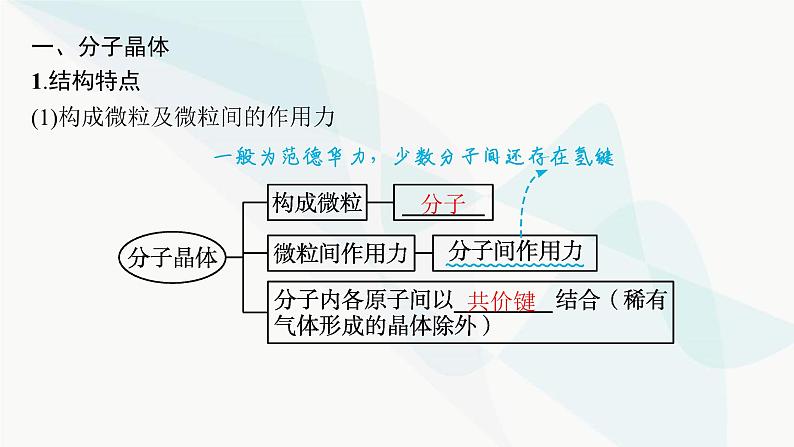
一、分子晶体1.结构特点(1)构成微粒及微粒间的作用力
(2)特征性质熔化时只破坏分子间作用力,不破坏分子内的化学键分子晶体熔点 ,硬度很 。
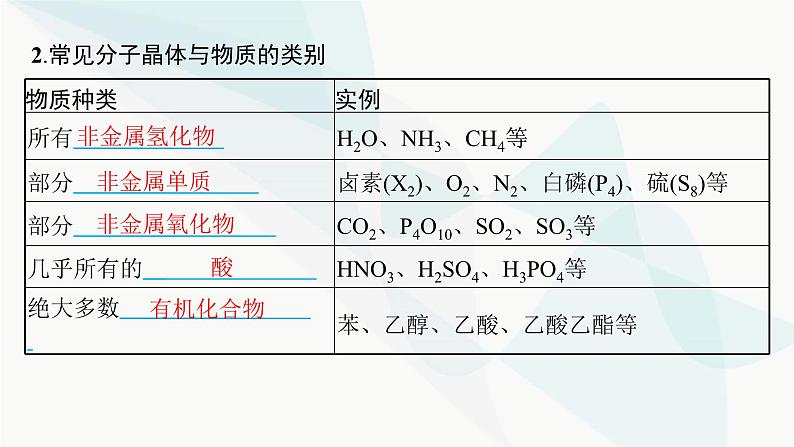
2.常见分子晶体与物质的类别
3.两种典型分子晶体的组成和结构
二、共价晶体1.结构特点
2.物理性质(1)共价晶体中,由于各原子均以强的共价键相结合,因此一般熔点 ,硬度 。金刚石是天然存在的最硬的物质 (2)结构相似的共价晶体,原子半径越小,键长 ,键能越大,晶体的熔点越 。
3.共价晶体与物质的类别
4.两种典型的共价晶体
微思考1阅读教材有关分子晶体的内容,了解分子晶体的特点,AB型物质形成的晶体多种多样,下列图示的几种结构中最有可能是分子晶体的是 (填序号)。
提示 ②③。①④⑤⑥构成的晶体为在一维、二维或三维空间中的结构,且在空间中微粒通过化学键相互连接,故它们不可能是分子晶体;而②③所示结构都是独立的,没有通过化学键与其他结构结合,故可能为分子晶体。
易错辨析1(1)分子晶体中一定含有分子间作用力,不一定含有化学键。( )(2)分子晶体熔化时,只破坏分子间作用力,不破坏共价键。( )(3)冰融化和干冰升华破坏的作用力完全相同。( )提示 干冰升华只破坏范德华力,而冰融化除破坏范德华力外,还破坏氢键。(4)干冰晶体中只存在范德华力不存在氢键,一个分子周围有12个紧邻分子。( )(5)冰晶体中,每个水分子周围只有4个紧邻的分子,1 ml冰中含有1 ml氢键。( )
微思考2含有共价键的晶体都是共价晶体吗?
提示 不是。共价晶体中都有共价键,但含有共价键的晶体不一定是共价晶体。如CO2、H2O中也含有共价键,但二者属于分子晶体。
易错辨析2(1)一般情况下,分子晶体的熔、沸点比较低,共价晶体的熔、沸点比较高。( )(2)共价晶体中,共价键越强,熔点越高。( )(3)共价晶体的化学式表示其分子式。( )提示 共价晶体中不含分子。(4)二氧化硅和干冰虽然是同一主族元素形成的氧化物,但属于不同的晶体类型。( )
探究一 分子晶体的结构特点与性质
常温下,液态水中水分子在不停地做无规则的运动。0 ℃以下,水凝结为冰,其中的水分子排列由杂乱无序变得十分有序。
(1)冰晶体中存在着哪几种微粒间的相互作用?
(2)冰融化成水时破坏的作用力是什么?
(3)电解水生成氢气和氧气时破坏的作用力是什么?
提示 共价键、氢键、范德华力。
提示 氢键和范德华力。
(4)为什么干冰的熔点比冰低而密度却比冰大?
提示 冰中水分子间除了范德华力外还有氢键作用,而干冰中CO2分子间只有范德华力,所以冰的熔点比干冰高。由于水分子间形成的氢键具有方向性,导致冰晶体不具有分子密堆积特征,晶体中有较大的空隙,所以冰的密度较小。干冰中CO2分子采取密堆积方式形成晶体,所以干冰的密度较大。
(5)硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,这是为什么?
提示 冰晶体中水分子间存在氢键,由于氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,因此,冰中1个水分子周围只有4个紧邻分子而硫化氢分子之间没有氢键,只有范德华力,范德华力无饱和性与方向性,能够形成分子密堆积,因此,一个硫化氢分子周围有12个紧邻分子。
分子晶体的结构特点与分子间作用力
视角1分子晶体的判断1.下列有关分子晶体的说法一定正确的是( )A.分子内均存在共价键B.分子间一定存在范德华力C.分子间一定存在氢键D.分子晶体一定采取分子密堆积方式
解析 分子晶体构成微粒若为单原子分子,则不含共价键,如稀有气体,故A错误;分子晶体中分子之间的作用力为范德华力,故B正确;若不是N、O、F元素对应的氢化物,则不含有氢键,故C错误;分子晶体不一定采用分子密堆积,有些分子如冰的晶体,由于氢键的作用,每个水分子周围只有四个紧邻的水分子形成非密堆积,故D错误。
2.下列物质在室温下均是分子晶体的是( )A.H2O、CH4、HFB.红磷、硫、碘C.CO2、SO2、NO2D.H2SO4、CH3CH2OH、HCHO
解析 题目的核心是“室温”,在该条件下H2O、H2SO4、CH3CH2OH均为液体,CH4、HF、CO2、NO2、SO2、HCHO均为气体,故B项正确。
视角2分子晶体的结构3.下列有关冰和干冰的叙述不正确的是( )A.干冰和冰都是由分子密堆积形成的晶体B.冰晶体中,每个水分子周围只有4个紧邻的水分子C.干冰比冰的熔点低得多,常压下易升华D.干冰中CO2分子间只存在范德华力,不存在氢键,一个分子周围有12个紧邻的分子
解析 干冰晶体中,CO2分子间作用力只是范德华力,分子采取密堆积,一个分子周围有12个紧邻的分子;冰晶体中水分子间除了范德华力之外还存在氢键,由于氢键具有方向性,每个水分子周围只有4个紧邻的水分子,采取非密堆积的方式,空间利用率小,因而密度小。干冰熔化只需克服范德华力,冰融化需要克服范德华力和氢键,由于氢键作用力比范德华力大,所以干冰比冰的熔点低得多,而且常压下易升华。
特别提醒 晶体冰中有关氢键的易错点(1)晶体冰中每个水分子可以与紧邻的4个水分子形成氢键(不是2个);1 ml水分子平均形成2 ml氢键(不是4 ml)。(2)冰、氢氟酸中均有氢键,且O—H…O比F—H…F弱,但水的沸点更高,其原因是平均每个水分子形成的氢键数比HF多。(3)晶体冰的密度比液态水的小。
视角3分子晶体熔、沸点的比较4.下列物质按熔、沸点由高到低顺序排列,正确的一组是( )A.HF、HCl、HBr、HIB.F2、Cl2、Br2、I2C.H2O、H2S、H2Se、H2TeD.CI4、CBr4、CCl4、CF4
解析 对组成和结构相似的分子晶体,其熔、沸点随着相对分子质量的增大而升高,但HF、H2O分子之间都存在氢键,熔、沸点反常。所以熔、沸点由高到低的顺序:HF>HI>HBr>HCl;I2>Br2>Cl2>F2;H2O>H2Te>H2Se>H2S,A、B、C项错误,D项正确。
思维建模 解答有关分子晶体组成和性质问题的思维流程如下:
【变式设问】(1)上题A项物质稳定性的排序如何?
(2)上题A项、D项物质在水中的溶解性如何?溶解时化学键是否断裂?
提示 HF>HCl>HBr>HI。物质稳定性与化学键的强弱有关。
提示 A项物质易溶于水,溶解时化学键断裂;D项物质难溶于水。
5.下列性质符合分子晶体性质的是( )A.熔点为1 070 ℃,易溶于水,水溶液导电B.熔点为3 500 ℃,不导电,质硬,难溶于水和有机溶剂C.能溶于CS2,熔点为113 ℃,沸点为445 ℃D.熔点为97.81 ℃,质软,导电,密度为0.97 g·cm-3
解析 分子晶体是由分子构成的,分子间的作用力很弱,一般具有熔、沸点较低,硬度小,易挥发等特性。熔点高,不是分子晶体的性质,故A、B项错误;单质硫能溶于CS2,熔点为113 ℃,沸点为445 ℃,单质硫是分子晶体,故C正确;熔点为97.81 ℃,质软、导电、密度为0.97 g·cm-3,是金属钠的物理性质,金属钠不属于分子晶体,故D错误。
归纳总结 影响分子晶体性质的因素(1)分子晶体具有熔、沸点较低,硬度较小,固态不导电等物理特性。在常温下呈气态的物质、常温下呈液态的物质(除汞外)、易升华的固体物质都属于分子晶体。(2)分子间作用力的大小决定分子晶体的物理性质。分子间作用力越大,分子晶体的熔、沸点越高,硬度越大。(3)分子晶体的化学性质由分子内共价键的强弱(键长、键能)决定。
探究二 共价晶体的结构特点与性质
材料1 金刚石的晶体结构模型如下图
材料2 纯净的天然二氧化硅晶体,是一种坚硬、脆性、不溶的无色透明的固体,常用于制造光学仪器等。二氧化硅晶体中,硅原子位于正四面体的中心,四个氧原子位于正四面体的四个顶角上,许多个这样的四面体又通过顶角的氧原子相连,每个氧原子为两个四面体共有,即每个氧原子与两个硅原子相结合。
(1)分析共价晶体的微观结构与分子晶体有哪些不同。
(2)分析金刚石的晶体结构模型,最小的环各有多少个原子?
提示 ①构成微粒不同,共价晶体中只存在原子,没有分子。②微粒间的相互作用不同,共价晶体中原子之间通过共价键结合,分子晶体中分子之间的作用是分子间作用力。
提示 金刚石最小环上有6个原子。
(3)根据材料2的描述,每个正四面体占有几个Si原子、几个O原子?有没有单个分子?
提示 1、2。没有单个分子。
(4)怎样从原子结构的角度理解金刚石、硅和锗的熔、沸点依次下降?
提示 在金刚石、硅和锗中,每个原子均以sp3杂化轨道与相邻的4个原子形成σ键,整体上形成三维骨架结构,同属于共价晶体,熔点和硬度都较高。但金刚石、硅和锗的结构差别在于C、Si、Ge原子半径依次递增,C—C、Si—Si、Ge—Ge的键长依次递增,键长越长,键能越小,所以熔、沸点依次降低。
共价晶体及金刚石结构分析
视角1共价晶体的特点1.下列有关共价晶体的叙述错误的是( )A.共价晶体中,原子不遵循紧密堆积原则B.共价晶体具有空间网状结构C.共价晶体中不存在独立的分子D.共价晶体熔化时不破坏共价键
解析 A项,共价晶体中原子之间通过共价键相连,而共价键具有方向性和饱和性,所以共价晶体中,原子不遵循紧密堆积原则;B项,共价晶体是相邻原子之间通过共价键结合而成的空间网状结构;C项,共价晶体是由原子以共价键相结合形成的,不存在独立的分子;D项,共价晶体是原子通过共价键连接的,熔化时需要破坏共价键。
2.下列各组晶体状态的物质中,化学键类型相同,晶体类型也相同的是( )A.SiO2和SO3B.晶体硼和HClC.晶体硅和C60D.硫黄和碘
解析 属于分子晶体的有SO3、HCl、C60、硫黄和碘;属于共价晶体的有SiO2、晶体硼和晶体硅。D项符合题目要求。
视角2共价晶体的结构3.下列有关共价晶体的叙述不正确的是( )A.金刚石和二氧化硅晶体的最小结构单元都是正四面体B.设NA为阿伏加德罗常数的值,含1 ml C的金刚石中C—C数目是2NA,1 ml SiO2晶体中Si—O数目是4NAC.水晶和干冰在熔化时,晶体中的共价键都会断裂D.SiO2晶体是共价晶体,所以晶体中不存在分子,SiO2不是它的分子式
解析 金刚石是1个中心碳原子连接4个碳原子,二氧化硅是1个中心硅原子连接4个氧原子,均为正四面体,A项正确;金刚石中,1个C原子与另外4个C原子形成4个C—C,这个C原子对每个单键的贡献只有 ,所以1 ml C原子形成的C—C的数目为4 ml× =2 ml,而二氧化硅晶体中1个Si原子分别与4个O原子形成4个Si—O,则1 ml SiO2晶体中Si—O的数目为4 ml,B项正确;干冰熔化时只破坏分子间作用力,共价键不会断裂,C项错误;共价晶体的构成微粒是原子不是分子,D项正确。
【变式设问】(1)金刚石和二氧化硅晶体中熔点较高的是 。
(2)SiO2和CO2的熔、沸点差别很大的原因是什么?
提示 金刚石键长:C—C
提示 晶体类型不同。
视角3共价晶体的性质4.下列晶体性质的比较中不正确的是( )A.沸点:NH3>PH3B.熔点:SiI4>SiBr4>SiCl4C.硬度:白磷>冰>二氧化硅D.硬度:金刚石>碳化硅>晶体硅
解析 NH3分子间存在氢键,故沸点NH3>PH3,A项正确;SiI4、SiBr4、SiCl4的组成和结构相似,且均为分子晶体,熔点随相对分子质量的增大而升高,B项正确;白磷和冰都是分子晶体,硬度小,而二氧化硅是共价晶体,硬度大,C项错误;三种物质都是共价晶体,原子半径C
沪科技版(2020)选择性必修2共价晶体评优课课件ppt: 这是一份沪科技版(2020)选择性必修2<a href="/hx/tb_c4036507_t3/?tag_id=26" target="_blank">共价晶体评优课课件ppt</a>,文件包含331共价晶体和分子晶体1pptx、332共价晶体和分子晶体2pptx、33共价晶体和分子晶体分层作业原卷版docx、33共价晶体和分子晶体分层作业解析版docx等4份课件配套教学资源,其中PPT共94页, 欢迎下载使用。
人教版 (2019)选择性必修2第二节 分子晶体与共价晶体多媒体教学ppt课件: 这是一份人教版 (2019)选择性必修2第二节 分子晶体与共价晶体多媒体教学ppt课件,共39页。PPT课件主要包含了第2课时共价晶体,共价键,硅Si,金刚石,正误判断,深度思考,应用体验,°28′,sp3,硅氧四面体等内容,欢迎下载使用。
选择性必修2第二节 分子晶体与共价晶体教课内容课件ppt: 这是一份选择性必修2第二节 分子晶体与共价晶体教课内容课件ppt,共38页。PPT课件主要包含了第1课时分子晶体,分子间作用力,非金属氢化物,非金属单质,非金属氧化物,有机物,反常高,正误判断,深度思考,应用体验等内容,欢迎下载使用。













