







初中化学人教版九年级下册实验活动6 酸、碱的化学性质完整版ppt课件
展开实验活动6 酸、碱的化学性质
【学习目标】
1.通过化学实验及相关分析,进一步理解酸、碱的各项化学性质。
2.通过实验探究,提高实验分析能力和设计实验的能力。
【学习重点】酸、碱各项化学性质的验证实验。
【学习难点】分析实验现象,得出实验结论。
【学习过程】
一、自主学习
1.酸的化学性质:
(1)酸与指示剂作用;(2)酸与较活泼的金属反应;(3)酸与金属氧化物反应;(4)酸与碱发生中和反应。
2.碱的化学性质:
(1)碱溶液与指示剂作用;(2)碱溶液与某些非金属氧化物反应;(3)碱与酸发生中和反应。
二、新知导学
实验目的
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
实验用品
试管、药匙、蒸发皿、玻璃棒。
稀盐酸、稀硫酸、稀氢氧化钠溶液、氢氧化钙溶液、硫酸铜溶液、氢氧化镁粉末、石蕊溶液、酚酞溶液、pH试纸、生锈的铁钉。
实验步骤
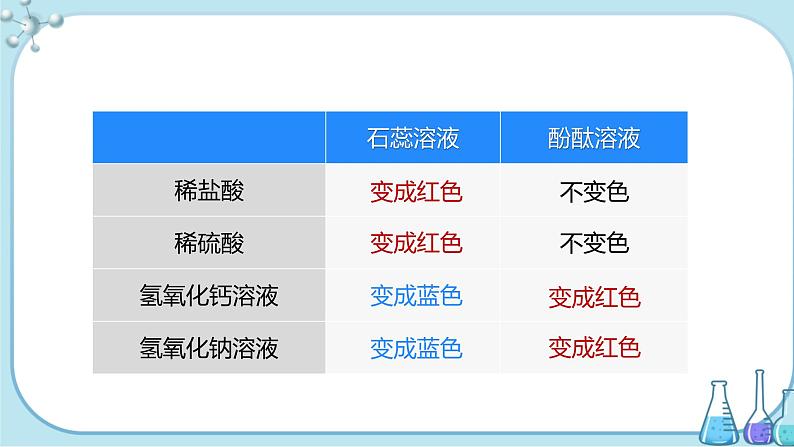
1.酸、碱与指示剂的反应(参照下图进行实验)。
操作示意图 | |||
实验现象 |
| 石蕊溶液 | 酚酞溶液 |
稀盐酸/稀硫酸 | 变红 | 不变色 | |
NaOH溶液/Ca(OH)2溶液 | 变蓝 | 变红 | |
实验结论 | 酸溶液使石蕊溶液变红色,酚酞溶液遇到酸溶液不变色; 碱溶液使石蕊溶液变蓝色,酚酞溶液遇到碱溶液变红; | ||
2.酸与金属氧化物、活泼金属的反应
实验步骤 | (1)取两个生锈的铁钉放入两支试管中,然后加入约2mL稀盐酸,观察现象。当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出,洗净。 (2)继续观察另一支试管中的现象,过一段时间将铁钉取出,洗净。比较两支铁钉 |
实验现象 | (1)红色的铁锈逐渐消失,溶液由无色变为黄色;(2)发现铁钉表面有气泡放出,溶液由微黄色变成浅绿色,发现先取出的那支铁钉粗些,后取出的那支铁钉细一些 |
实验结论 | Fe2O3+6HCl═==2FeCl3+3H2O Fe+2HCl═==FeCl2+H2↑ |
3.碱与盐、酸的反应
实验步骤 | (1)在试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察现象。 (2)然后再向试管中加入稀盐酸,观察现象 |
实验现象 | (1)有蓝色沉淀产生 ; (2)蓝色沉淀逐渐溶解 |
实验结论 | 2NaOH+CuSO4═==Na2SO4+Cu(OH)2↓ Cu(OH)2+2HCl═==CuCl2+2H2O |
4.酸与碱的反应
实验步骤 | (1)在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。 (2)然后边用滴管慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变成无色为止。 (3)取该无色溶液约1mL,置于蒸发皿中加热,使液体蒸干,观察现象 |
实验现象 | (1)氢氧化钠溶液变红;(3)发现有白色晶体析出 |
实验结论 | NaOH+HCl═==NaCl+H2O |
5.氢氧化钙的性质
实验步骤 | (1)向两支试管中各加入相同量的氢氧化钙粉末(用药匙的柄把一端挑点),然后各加入1mL水,振荡; (2)再各滴入1~2滴酚酞溶液,观察现象。 (3)继向其中一支试管中加入约1mL水,振荡; (4)向另一支试管加入约1mL稀盐酸振荡;比较两支试管中的现象 |
实验现象 | (2)溶液变红 (3)无明显现象 (4)红色逐渐消失 |
实验结论 | Ca(OH)2+2HCl===CaCl2+2H2O |
三、当堂检测
1.下列变化中,不能表明盐酸与氢氧化钠发生了反应的是( B )
A.向氢氧化钠溶液中加入盐酸后,混合溶液的温度升高
B.向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大
C.向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色褪去
D.向氢氧化钠溶液中加入盐酸后,混合溶液的pH<7
2.下列物质不能用来鉴别稀盐酸和氢氧化钠溶液的是( C )
A.硫酸铜溶液 B.pH试纸 C.氯化钠溶液 D.大理石
3.化学课上,化学老师为同学们表演了小魔术,他将一张白纸展示给大家,然后用喷壶向纸上喷了一些无色液体,“化学真奇妙”的红色大字立刻显现于纸上。他所用的试剂可能是下列哪一组( A )
A.酚酞——石灰水溶液 B.酚酞——盐酸溶液
C.石蕊——石灰水溶液 D.石蕊——盐酸溶液
4.区别下列各组物质的方法可行的是( B )
A.用盐酸区别澄清石灰水和氢氧化钠稀溶液 B.用二氧化锰区别过氧化氢溶液和纯水
C.用蒸馏水区别四氧化三铁粉末和铁粉 D.用铜片区别稀盐酸和稀硫酸
5.物质X可发生下列所示的两个反应,则X可能是( A )
①X+碱→盐+水 ②X+金属氧化物→盐+水
A.HCl B.CO C.NaOH D.CaO
6.某实验小组探究酸的化学性质,在做盐酸除铁锈的实验时发现:
(1)将带锈铁钉放入试管后加入稀盐酸,看到铁锈消失,溶液呈黄色,反应的化学方程式为Fe2O3+6HCl═==
2FeCl3+3H2O。
(2)课后清洗仪器时,一同学发现试管中的黄色溶液变成浅绿色,表明此时的溶液已变为FeCl2溶液。这是由于过量的铁继续与黄色溶液的主要成分反应造成的,该反应的化学方程式为Fe+2FeCl3═==3FeCl2。
化学九年级下册实验活动6 酸、碱的化学性质图片ppt课件: 这是一份化学九年级下册实验活动6 酸、碱的化学性质图片ppt课件,共19页。PPT课件主要包含了生活中的碱,碱性物质,认识碱,碱有哪些性质,碱与指示剂的反应,碱的共性,〖思考〗P17,溶液从碱性到中性,石灰水变浑浊,检验CO2的方法等内容,欢迎下载使用。
化学九年级下册实验活动6 酸、碱的化学性质精品ppt课件: 这是一份化学九年级下册实验活动6 酸、碱的化学性质精品ppt课件,共22页。
初中化学人教版九年级下册实验活动6 酸、碱的化学性质优质教学课件ppt: 这是一份初中化学人教版九年级下册实验活动6 酸、碱的化学性质优质教学课件ppt,文件包含实验活动6《酸碱的化学性质》课件PPTpptx、实验活动6《酸碱的化学性质》教学设计docx、实验活动6《酸碱的化学性质》同步练习docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。












