









鲁教版 (五四制)九年级全册2 溶液组成的定量表示课文配套ppt课件
展开第三单元第二节 溶液组成的定量表示第1课时 教案
【教学目标】
1.知识与技能
(1)掌握一种溶液组成的表示方法——溶质的质量分数
(2)能进行溶质质量分数的简单计算
2.过程与方法
(1)通过计算让学生学会分析问题、解决问题
3.情感态度和价值观
(1)发展勤于思考、严谨求实和实践的科学精神
【教学重点】
(1)溶质的质量分数计算
【教学难点】
(1)溶质的质量分数计算
【课前准备】
多媒体
【课时安排】
1课时
【教学过程】
一、导入新课
溶液在人类的生产、生活和科学研究中具有广泛应用。人们在使用溶液时,常常会提及“溶液的浓度”,关注溶液中溶质的含量。因为即便是两份组成成分相同的溶液,也可能会因为某种成分含量不同而导致其性质炯异。因此,溶液通常需要清楚地标示其组成成分及含量。那么,怎样定量表示溶液的组成呢?如何才能准确知道一定量溶液里含有多少溶质?
二、新课学习
一、溶液组成的表示方法
视频:三种浓稀不同的硫酸铜溶液
从视频中我们可以看出哪一个更浓?
[第三个烧杯中溶液最浓,颜色最深]
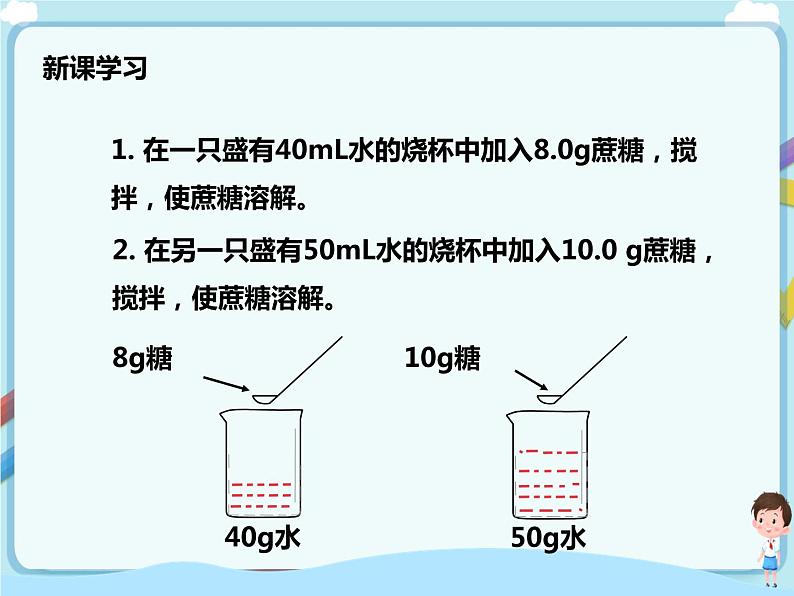
在同样多的两杯水中分别溶解一汤匙蔗糖和两汤匙蔗糖,你不难判断哪一杯糖水更甜。但是,你知道下面的实验中哪杯糖水更甜吗?
活动天地:
1.在一只盛有40 mL水的烧杯中加入8.0 g蔗糖,搅拌,使蔗糖溶解。
2.在另一只盛有50 mL水的烧杯中加入10.0 g蔗糖,搅拌,使蔗糖溶解。
上述所得两杯糖水,哪杯更甜?你的判断依据是什么?
[溶质质量与溶剂的质量比
1. 8g/(40mL×1g/mL)=1:5
2. 10g/(50mL×1g/mL)=1:5
溶质质量与溶液质量的比
1. 8g/( 8g +40mL×1g/mL)=1:6
2. 10g/(10g+50mL×1g/mL)=1:6
所以应该是一样甜;根据溶质质量与溶剂的质量比值或溶质质量与溶液质量的比值。]
定量表示溶液组成的方法很多,化学上常用溶质质量分数来表示溶液的组成,它是溶质与溶液的质量之比。通常可用下式计算:
溶质质量分数=×100%
这个式子可以变形:
溶质的质量=溶液的质量×溶质质量分数
溶液的质量=
由于在溶液中溶液的质量=溶质的质量+溶剂的质量,所以有些时候我们把溶液变为溶质的质量+溶剂的质量。
溶质的质量分数的含义是:
在100份质量的溶液里有多少份质量的溶质。
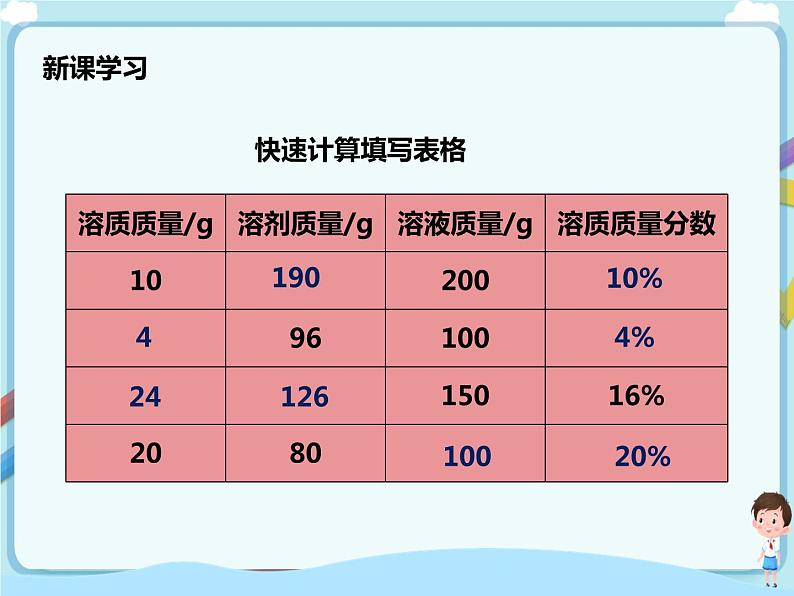
依据上面的公式,我们快速的计算来填空下面的表格:
溶质质量/g | 溶剂质量/g | 溶液质量/g | 溶质质量分数 |
10 | 190 | 200 | 10% |
4 | 96 | 100 | 4% |
24 | 126 | 150 | 16% |
20 | 80 | 100 | 20% |
应用上面的公式,我们可以进行多种运算:
溶液中溶质的质量分数计算
例:从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克氯化钾固体。试确定这瓶溶液中溶质的质量分数。
请同学们尝试自行解答:
[解:这瓶溶液中溶质的质量分数为
×100%= 14%
答:这瓶溶液中氯化钾的质量分数为14%。]
溶液混合,溶质的质量分数计算
例:30%的食盐溶液与10%的食盐溶液各100g混合,求所得溶液的溶质质量分数?
[解:溶质的质量为30%×100g+10%×100g=40g
溶质的质量分数为×100%=20%
答:所得溶液的溶质的质量分数为20%。]
我们按照生活经验考虑一下,糖水太甜了,我们应怎么办?
[加水稀释]
加沙稀释后,溶质的质量是?
溶剂的质量是?
溶液的质量是?
[不变、变大、变大]
以此,我们可以进行溶液稀释问题的计算
例 将100 g 25%的硝酸钾溶液用水稀释成溶质质量分数为10%的溶液。求稀释所需水的质量。
[解:设稀释后溶液的质量为x。因为溶液稀释前后溶质的质量不变,所以:
100 g×25%=x×10%
x==250 g
需要水的质量为:250 g-100 g=150 g
答:稀释需要水的质量为150 g。]
在线测试:
1.下列叙述是否正确?为什么?
(1)在100g水中溶解20g氯化钠,所得氯化钠溶液的溶质质量分数为20%。
[不正确,溶质质量分数为×100%= 16.7%]
(2)从100g溶质质量分数为20%的碳酸钠溶液中取出10g溶液,则取出的溶液的溶质质量分数为2%。
[正确,溶液是均一的,溶质的质量分数还是20%]
2.蒸干40g某氯化钠溶液得到8g氯化钠。求该溶液的溶质质量分数。
[20%]
3.食醋中约含3%~5%的醋酸,计算500g溶质质量分数为4%的食醋中,含有多少克醋酸?
[20g]
拓展学习:
溶液浓缩的计算
例:现有100g溶质质量分数为10%的食盐溶液,若使溶液的溶质质量分数变为20%,应蒸发掉多少克水?
[解:设蒸发掉水的质量为x。
×100% =20%
x =50g
答:蒸发掉水的质量为50g。]
溶液中溶质和溶剂质量的计算
在农业生产上,常用质量分数10%~20%的氯化钠溶液来选种。现要配制150kg质量分数为16%的氯化钠溶液,需要氯化钠和水的质量各是多少?
[解:氯化钠的质量=150kg×16%=24kg
水的质量=150kg-24kg=126kg
答:配制150kg质量分数为16%的氯化钠溶液需要
24kg氯化钠和126kg水。]
多识一点:白酒的“度数”
酒类商品上的酒精含量不是指质量分数,而是体积分数。
详见P66
体积分数也是一种表示溶液组成的方法。
课堂练习:
1.把一杯食盐水倒出一部分,没有改变的是( D )
A.溶质的质量 B.溶剂的质量
C.溶液的质量 D.溶质的质量分数
2.家用食醋是含醋酸质量分数为10%的水溶液,其中的“10%”的含义是( B )
A.100克醋酸中含醋为10克
B.100克醋酸的水溶液中含醋酸10克
C.100克水中含醋酸为10克
D.100克醋酸的水溶液中含水10克
3.把10克氯化钠放入40克水中,完全溶解后,溶液中氯化钠的质量分数为( B )
A.10% B.20% C.25% D.33.3%
4.下列溶液,溶质的质量分数最大的是( A )
A.20%的蔗糖溶液。
B.把40g蔗糖完全溶解在210g水中所配成的溶液。
C.其中含有27克蔗糖的150克蔗糖水。
D.把ag水加入ag 30%的蔗糖溶液中所配成的溶液。
课堂小结:
本节我们学习的主要内容是什么?
[可用溶质质量分数定量表示溶液的组成。
溶质质量分数=×100%]
【板书设计】
溶液组成的表示方法
溶质质量分数是溶质与溶液的质量之比。
溶质质量分数=×100%
与溶质质量分数有关的计算
【作业布置】
1.P68挑战自我1、2、3题
2.收集与溶液中溶质的质量分数有关的题目,加强对溶质的质量分数人理解
【教学反思】
通过本课题的教学,可以发现学生对于溶质质量分数的计算简单计算比较容易掌握,但溶质质量分数概念的灵活运用能力较差,分析问题和解决问题的能力有待提高,对于基础差的学生,审题过程中找不准每个已知量。在课堂教学中,每一道题的分析,关键是要让学生根据题意找准已知量,计算便能顺利过关。另一方面,本课题的内容对学生而然相对比较枯燥,只有配制一定溶质质量分数的溶液一个分组实验,其余均为概念的理解和比较单调的计算,如何激发学生的学习兴趣和如何调动学生的积极性就成为本课题教学成功与否的关键所在。在日后的教学中,可请学生先搜集有关食品等溶液的标签,通过收集查阅标签使学生感受到溶液生活实际中的应用价值,学有所用,使枯燥的计算与生活实际紧密相联,从而激发学生的学习兴趣。课题从简单的实验入手,结合实验进行一些简单数据计算,学生能很好理解溶质质量分数的概念,溶液的配制学生也比较容易掌握,但溶液配制的实验操作要进一步加强。溶液的稀释只要学生能紧紧抓住稀释前后溶质质量不变的原则,计算容易过关。值得关注的是,很多学生,包括一些成绩较好的学生,计算时往往忽视审题,没有弄清题意便随意动笔计算,容易出现类似的错误,例如:课本中溶液的稀释是计算加水的量,有了这道题先入为主的印象,学生看到有关稀释的计算,无论题目的要求是计算加水的量、溶液质量、溶质质量还是溶质的质量分数,很多学生都按计算加水的量作为计算结果。教学中,教师要引导学生认真审题,不要盲目随意计算。
鲁教版 (五四制)九年级全册2 溶液组成的定量表示获奖ppt课件: 这是一份鲁教版 (五四制)九年级全册2 溶液组成的定量表示获奖ppt课件,共19页。PPT课件主要包含了基础·主干落实,重点·案例探析,素养·分层评价,葡萄糖和氯化钠,09%,加快氯化钠的溶解,10%,167%,20%,2∶1等内容,欢迎下载使用。
鲁教版 (五四制)九年级全册2 溶液组成的定量表示课堂教学课件ppt: 这是一份鲁教版 (五四制)九年级全册2 溶液组成的定量表示课堂教学课件ppt,文件包含第三单元第二节溶液组成的定量表示第2课时课件pptx、第三单元第二节溶液组成的定量表示第2课时教案doc、第三单元第二节溶液组成的定量表示第2课时一课一练doc、第三单元第二节溶液组成的定量表示第2课时素材配制一定溶质质量分数溶液wmv等4份课件配套教学资源,其中PPT共17页, 欢迎下载使用。
化学九年级全册1 溶液的形成背景图课件ppt: 这是一份化学九年级全册1 溶液的形成背景图课件ppt,文件包含第三单元第一节溶液的形成第2课时课件pptx、第三单元第一节溶液的形成第2课时教案doc、第三单元第一节溶液的形成第2课时一课一练doc、第三单元第一节溶液的形成第2课时素材硝酸钾溶解加水wmv、第三单元第一节溶液的形成第2课时素材硝酸钾溶解加热wmv、第三单元第一节溶液的形成第2课时素材观察硝酸钾能否在一定量水中无限溶解wmv等6份课件配套教学资源,其中PPT共23页, 欢迎下载使用。













