



还剩41页未读,
继续阅读
成套系列资料,整套一键下载
- 第1章 第2节 反应热的计算课件PPT 课件 0 次下载
- 第1章 第1节 第1课时 反应热 焓变 试卷 试卷 0 次下载
- 第1章 第2节 反应热的计算 试卷 试卷 0 次下载
- 第2章 本章总结课件PPT 课件 0 次下载
- 第2章 第1节 第2课时 影响化学反应速率的因素 活化能课件PPT 课件 0 次下载
第1章 本章总结课件PPT
展开
这是一份第1章 本章总结课件PPT,共49页。
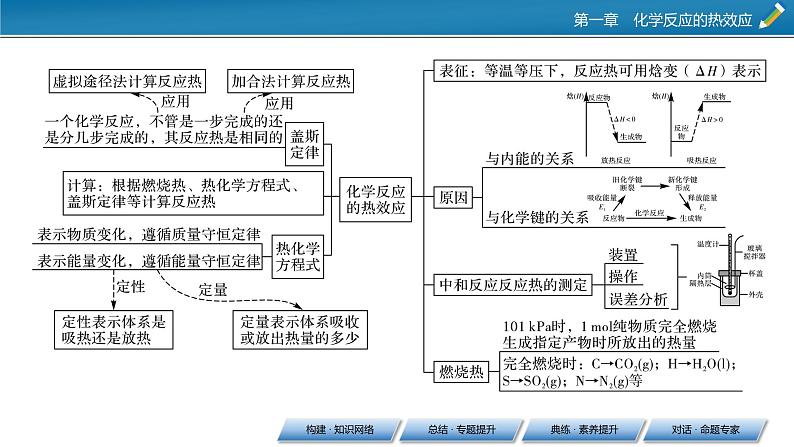
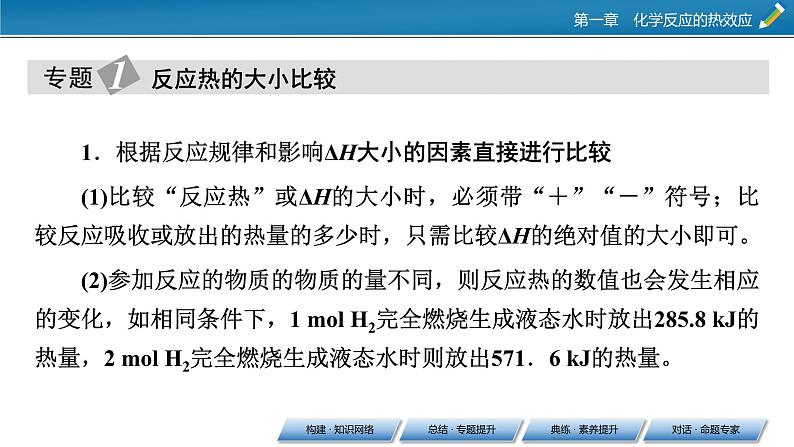
第一章 化学反应的热效应本章总结构建 · 知识网络总结 · 专题提升1.根据反应规律和影响ΔH大小的因素直接进行比较(1)比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较反应吸收或放出的热量的多少时,只需比较ΔH的绝对值的大小即可。(2)参加反应的物质的物质的量不同,则反应热的数值也会发生相应的变化,如相同条件下,1 mol H2完全燃烧生成液态水时放出285.8 kJ的热量,2 mol H2完全燃烧生成液态水时则放出571.6 kJ的热量。反应热的大小比较(3)同一反应中物质的聚集状态不同,反应热数值大小也不同。例如:S(g)+O2(g)===SO2(g) ΔH1=-Q1 kJ·mol-1,S(s)+O2(g)===SO2(g) ΔH2=-Q2 kJ·mol-1,可以理解成固态硫变成气态硫后再发生变化,而由固态到气态是需要吸收能量的,所以Q1>Q2、ΔH1<ΔH2。故当同一反应中由于物质聚集状态不同比较吸收或放出热量的多少时,对于放热反应而言,反应物为固态时放出的热量比气态、液态时少,当生成物为固态时放出的热量比气态、液态时多。3.根据反应物的性质比较等物质的量的不同物质与同一种物质反应时,物质性质不同其反应热不同。如等物质的量的不同金属(或非金属)与同一种物质反应,金属(或非金属)越活泼反应越容易进行,放出的热量越多,对应的ΔH越小。例如:Mg(s)+2HCl(aq)===MgCl2(aq)+H2(g) ΔH1,Ca(s)+2HCl(aq)===CaCl2(aq)+H2(g) ΔH2,ΔH1>ΔH2。③CaCO3(s)===CaO(s)+CO2(g) ΔH5CaO(s)+H2O(l)===Ca(OH)2(s) ΔH6ΔH5______ΔH6。【答案】 ①< ②> ③>【解析】对于①组,1 mol C(s)完全燃烧比不完全燃烧放出的热量多,即|ΔH1|>|ΔH2| ,但ΔH1、ΔH2均小于0,所以ΔH1<ΔH2;对于②组,ΔH4=2ΔH3<0,所以ΔH3>ΔH4;对于③组,石灰石的分解是吸热反应,而生石灰与水的化合反应是放热反应,即ΔH5>0、ΔH6<0,所以ΔH5>ΔH6。1.利用叠加法书写热化学方程式或计算反应热的一般步骤(1)若目标热化学方程式中的某种反应物在某个已知热化学方程式中作生成物(或目标方程式中的某种生成物在某个已知热化学方程式中作反应物),可把该已知热化学方程式的反应物和生成物颠倒,相应的ΔH改变符号。盖斯定律在计算ΔH中的应用(2)将每个已知热化学方程式两边同乘以某个合适的数,使已知热化学方程式中某种反应物或生成物的化学计量数与目标热化学方程式中的该反应物或生成物的化学计量数一致。热化学方程式中的ΔH也进行相应的换算。(3)将已知热化学方程式进行叠加,相应的热化学方程式中的ΔH也进行叠加。2.利用盖斯定律书写热化学方程式的思维模型先确定待求的热化学方程式⇒找出待求热化学方程式中各物质在已知热化学方程式中的位置⇒根据待求热化学方程式中各物质的化学计量数和位置对已知热化学方程式进行处理,得到变形后的新热化学方程式⇒将新得到的热化学方程式进行加减,反应热也需要相应加减⇒写出待求的热化学方程式。典练 · 素养提升素养解读 化学反应除了物质变化外,还同时伴随能量变化,如热能、电能、光能等。也就是说,化学反应中的能量变化是以物质变化为基础的,且能量变化的多少与参加反应的物质种类和多少密切相关。热能的利用可以追溯到人类的远古时代,且在现代社会生活中,热能同样还扮演着重要的角色。所以,研究化学反应中的热效应具有重要意义。通过化学反应的热效应的学习,可逐步培养宏观辨识与微观探析、变化观念与平衡思想、科学探究与创新意识等学科核心素养。通过中和反应反应热的实验探究,从实验原理、实验操作及实验注意事项等各方面具体认识化学能与热能的变化规律,从而培养“变化观念与平衡思想、科学探究与创新意识”等学科核心素养。通过化学键的断裂与形成,从微观角度认识化学反应中能量变化的根本原因;通过热化学方程式的书写,认识热化学方程式与普通化学方程式的不同点及表示的意义。培养证据推理与模型认知等学科核心素养。通过盖斯定律的学习,重新认识能量守恒定律的内涵和外延,利用盖斯定律可计算通过实验不易测量的反应热,并培养变化观念与平衡思想等学科核心素养。1.(科学探究与创新意识)将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见 ( )A.NH4HCO3和盐酸的反应是放热反应B.该反应中热能转化为产物内部的能量C.反应物的总能量高于反应产物的总能量D.反应的热化学方程式为NH4HCO3+HCl===NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1【答案】B【解析】根据醋酸逐渐凝固说明NH4HCO3与盐酸的反应是吸热反应,则A、C错误,B正确;热化学方程式中要标出各物质的聚集状态,D错误。2.(证据推理与模型认知)化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是 ( )【答案】A3.(证据推理与模型认知、宏观辨识与微观探析)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ· mol-1,2C(s)+O2(g)===2CO(g) ΔH=-220 kJ· mol-1。H—H键、O===O键和O—H键的键能分别为436 kJ· mol-1、496 kJ· mol-1和462 kJ· mol-1,则a为 ( )A.-332 B.-118C.+350 D.+130【答案】D【解析】根据盖斯定律,由第一个反应×2-第二个反应可得2H2O(g)===O2(g)+2H2(g) ΔH=(2a+220) kJ· mol-1。根据反应焓变与键能的关系计算,则有2a+220=4×462-(436×2+496),解得a=+130。【答案】B5.(宏观辨识与微观探析),已知,C(s)+O2(g)===CO2(g) ΔH1,CO2(g)+C(s)===2CO(g) ΔH2,2CO(g)+O2(g)===2CO2(g) ΔH3,4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4,3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5下列关于上述反应焓变的判断正确的是 ( )A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5【答案】C6.(科学态度与社会责任)“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将C与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1∶1。已知:1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol H2完全燃烧生成液态水放出285.8 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。(1)写出H2完全燃烧生成液态水的热化学方程式:______________;若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,该反应放出的热量________(填“>”“=”或“<”)890 kJ。 (2)忽略水煤气中的其他成分,相同状况下(生成CO2和液态水)若得到相等的热量,所需水煤气与甲烷的体积比约为__________;燃烧生成的CO2的质量比约为__________。 (3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是____________________________。【答案】(1)2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 < (2)3∶1 3∶2(3)燃烧放出的热量多,减少了CO2的排放量,有利于保护环境对话 · 命题专家 水煤气变换反应:CO(g)+H2O(g)===CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是 ( )A.水煤气变换反应的ΔH>0B.步骤③的化学方程式为CO·+OH·+H2O(g)===COOH·+H2O·C.步骤⑤只有非极性键H—H键形成D.该历程中最大能垒(活化能)E正=1.70 eV解题策略:先认真阅读题干和图像,特别是图像的横坐标和纵坐标分别代表的物理量或物质;再分析各反应历程的具体变化,包含物质(或微粒)变化和能量变化;最后,结合问题或选项有针对性地进行解题或逐项判断选项描述的正误。解析:由示意图可知,反应物的总能量大于生成物的总能量,该反应为放热反应,ΔH<0,A错误;步骤③为CO·、OH·、H2O(g)和H·反应生成COOH·、H2O·和H·,反应的化学方程式为:CO·+OH·+H2O(g)===COOH·+H2O·,B正确;步骤⑤除有非极性键H—H键形成外,还有C===O极性键和H—O极性键生成,C错误;步骤④的能垒最大,E正=1.86 eV—(-0.16 eV)=2.02 eV,D错误。答案:B解题策略:(1)解答有关用化学键键能求算反应热的题目:①弄清楚各物质的结构式,找出各物质中存在的化学键种类及条数;②依据计算(公式:ΔH=反应物的总键能-生成物的总键能或ΔH=断开化学键吸收的能量-形成化学键放出的能量);③注意反应热ΔH的“+”“-”号和单位等细节问题。答案:+120 kJ·mol-1解题策略:利用盖斯定律计算反应热(ΔH)的应用答题模板——叠加法。步骤1:“倒”——为了将方程式相加得到目标方程式,可将方程式颠倒过来,反应热的数值不变,但符号相反。步骤2:“乘”——为了将方程式相加得到目标方程式,可将方程式乘以某个倍数,反应热也要相乘。步骤3:“加”——上面的两个步骤做好了,只要将方程式相加即可得目标方程式,反应热也要相加。答案:(1)+53.1 (2)+247
第一章 化学反应的热效应本章总结构建 · 知识网络总结 · 专题提升1.根据反应规律和影响ΔH大小的因素直接进行比较(1)比较“反应热”或ΔH的大小时,必须带“+”“-”符号;比较反应吸收或放出的热量的多少时,只需比较ΔH的绝对值的大小即可。(2)参加反应的物质的物质的量不同,则反应热的数值也会发生相应的变化,如相同条件下,1 mol H2完全燃烧生成液态水时放出285.8 kJ的热量,2 mol H2完全燃烧生成液态水时则放出571.6 kJ的热量。反应热的大小比较(3)同一反应中物质的聚集状态不同,反应热数值大小也不同。例如:S(g)+O2(g)===SO2(g) ΔH1=-Q1 kJ·mol-1,S(s)+O2(g)===SO2(g) ΔH2=-Q2 kJ·mol-1,可以理解成固态硫变成气态硫后再发生变化,而由固态到气态是需要吸收能量的,所以Q1>Q2、ΔH1<ΔH2。故当同一反应中由于物质聚集状态不同比较吸收或放出热量的多少时,对于放热反应而言,反应物为固态时放出的热量比气态、液态时少,当生成物为固态时放出的热量比气态、液态时多。3.根据反应物的性质比较等物质的量的不同物质与同一种物质反应时,物质性质不同其反应热不同。如等物质的量的不同金属(或非金属)与同一种物质反应,金属(或非金属)越活泼反应越容易进行,放出的热量越多,对应的ΔH越小。例如:Mg(s)+2HCl(aq)===MgCl2(aq)+H2(g) ΔH1,Ca(s)+2HCl(aq)===CaCl2(aq)+H2(g) ΔH2,ΔH1>ΔH2。③CaCO3(s)===CaO(s)+CO2(g) ΔH5CaO(s)+H2O(l)===Ca(OH)2(s) ΔH6ΔH5______ΔH6。【答案】 ①< ②> ③>【解析】对于①组,1 mol C(s)完全燃烧比不完全燃烧放出的热量多,即|ΔH1|>|ΔH2| ,但ΔH1、ΔH2均小于0,所以ΔH1<ΔH2;对于②组,ΔH4=2ΔH3<0,所以ΔH3>ΔH4;对于③组,石灰石的分解是吸热反应,而生石灰与水的化合反应是放热反应,即ΔH5>0、ΔH6<0,所以ΔH5>ΔH6。1.利用叠加法书写热化学方程式或计算反应热的一般步骤(1)若目标热化学方程式中的某种反应物在某个已知热化学方程式中作生成物(或目标方程式中的某种生成物在某个已知热化学方程式中作反应物),可把该已知热化学方程式的反应物和生成物颠倒,相应的ΔH改变符号。盖斯定律在计算ΔH中的应用(2)将每个已知热化学方程式两边同乘以某个合适的数,使已知热化学方程式中某种反应物或生成物的化学计量数与目标热化学方程式中的该反应物或生成物的化学计量数一致。热化学方程式中的ΔH也进行相应的换算。(3)将已知热化学方程式进行叠加,相应的热化学方程式中的ΔH也进行叠加。2.利用盖斯定律书写热化学方程式的思维模型先确定待求的热化学方程式⇒找出待求热化学方程式中各物质在已知热化学方程式中的位置⇒根据待求热化学方程式中各物质的化学计量数和位置对已知热化学方程式进行处理,得到变形后的新热化学方程式⇒将新得到的热化学方程式进行加减,反应热也需要相应加减⇒写出待求的热化学方程式。典练 · 素养提升素养解读 化学反应除了物质变化外,还同时伴随能量变化,如热能、电能、光能等。也就是说,化学反应中的能量变化是以物质变化为基础的,且能量变化的多少与参加反应的物质种类和多少密切相关。热能的利用可以追溯到人类的远古时代,且在现代社会生活中,热能同样还扮演着重要的角色。所以,研究化学反应中的热效应具有重要意义。通过化学反应的热效应的学习,可逐步培养宏观辨识与微观探析、变化观念与平衡思想、科学探究与创新意识等学科核心素养。通过中和反应反应热的实验探究,从实验原理、实验操作及实验注意事项等各方面具体认识化学能与热能的变化规律,从而培养“变化观念与平衡思想、科学探究与创新意识”等学科核心素养。通过化学键的断裂与形成,从微观角度认识化学反应中能量变化的根本原因;通过热化学方程式的书写,认识热化学方程式与普通化学方程式的不同点及表示的意义。培养证据推理与模型认知等学科核心素养。通过盖斯定律的学习,重新认识能量守恒定律的内涵和外延,利用盖斯定律可计算通过实验不易测量的反应热,并培养变化观念与平衡思想等学科核心素养。1.(科学探究与创新意识)将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见 ( )A.NH4HCO3和盐酸的反应是放热反应B.该反应中热能转化为产物内部的能量C.反应物的总能量高于反应产物的总能量D.反应的热化学方程式为NH4HCO3+HCl===NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1【答案】B【解析】根据醋酸逐渐凝固说明NH4HCO3与盐酸的反应是吸热反应,则A、C错误,B正确;热化学方程式中要标出各物质的聚集状态,D错误。2.(证据推理与模型认知)化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是 ( )【答案】A3.(证据推理与模型认知、宏观辨识与微观探析)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ· mol-1,2C(s)+O2(g)===2CO(g) ΔH=-220 kJ· mol-1。H—H键、O===O键和O—H键的键能分别为436 kJ· mol-1、496 kJ· mol-1和462 kJ· mol-1,则a为 ( )A.-332 B.-118C.+350 D.+130【答案】D【解析】根据盖斯定律,由第一个反应×2-第二个反应可得2H2O(g)===O2(g)+2H2(g) ΔH=(2a+220) kJ· mol-1。根据反应焓变与键能的关系计算,则有2a+220=4×462-(436×2+496),解得a=+130。【答案】B5.(宏观辨识与微观探析),已知,C(s)+O2(g)===CO2(g) ΔH1,CO2(g)+C(s)===2CO(g) ΔH2,2CO(g)+O2(g)===2CO2(g) ΔH3,4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4,3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5下列关于上述反应焓变的判断正确的是 ( )A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5【答案】C6.(科学态度与社会责任)“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将C与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1∶1。已知:1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1 mol H2完全燃烧生成液态水放出285.8 kJ热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。(1)写出H2完全燃烧生成液态水的热化学方程式:______________;若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,该反应放出的热量________(填“>”“=”或“<”)890 kJ。 (2)忽略水煤气中的其他成分,相同状况下(生成CO2和液态水)若得到相等的热量,所需水煤气与甲烷的体积比约为__________;燃烧生成的CO2的质量比约为__________。 (3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是____________________________。【答案】(1)2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 < (2)3∶1 3∶2(3)燃烧放出的热量多,减少了CO2的排放量,有利于保护环境对话 · 命题专家 水煤气变换反应:CO(g)+H2O(g)===CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用·标注。下列说法正确的是 ( )A.水煤气变换反应的ΔH>0B.步骤③的化学方程式为CO·+OH·+H2O(g)===COOH·+H2O·C.步骤⑤只有非极性键H—H键形成D.该历程中最大能垒(活化能)E正=1.70 eV解题策略:先认真阅读题干和图像,特别是图像的横坐标和纵坐标分别代表的物理量或物质;再分析各反应历程的具体变化,包含物质(或微粒)变化和能量变化;最后,结合问题或选项有针对性地进行解题或逐项判断选项描述的正误。解析:由示意图可知,反应物的总能量大于生成物的总能量,该反应为放热反应,ΔH<0,A错误;步骤③为CO·、OH·、H2O(g)和H·反应生成COOH·、H2O·和H·,反应的化学方程式为:CO·+OH·+H2O(g)===COOH·+H2O·,B正确;步骤⑤除有非极性键H—H键形成外,还有C===O极性键和H—O极性键生成,C错误;步骤④的能垒最大,E正=1.86 eV—(-0.16 eV)=2.02 eV,D错误。答案:B解题策略:(1)解答有关用化学键键能求算反应热的题目:①弄清楚各物质的结构式,找出各物质中存在的化学键种类及条数;②依据计算(公式:ΔH=反应物的总键能-生成物的总键能或ΔH=断开化学键吸收的能量-形成化学键放出的能量);③注意反应热ΔH的“+”“-”号和单位等细节问题。答案:+120 kJ·mol-1解题策略:利用盖斯定律计算反应热(ΔH)的应用答题模板——叠加法。步骤1:“倒”——为了将方程式相加得到目标方程式,可将方程式颠倒过来,反应热的数值不变,但符号相反。步骤2:“乘”——为了将方程式相加得到目标方程式,可将方程式乘以某个倍数,反应热也要相乘。步骤3:“加”——上面的两个步骤做好了,只要将方程式相加即可得目标方程式,反应热也要相加。答案:(1)+53.1 (2)+247
相关资料
更多









