



还剩39页未读,
继续阅读
成套系列资料,整套一键下载
人教版(2019)高中化学选择性必修第一册 第一章《化学反应的热效应》单元复习课件
展开
这是一份人教版(2019)高中化学选择性必修第一册 第一章《化学反应的热效应》单元复习课件,共47页。
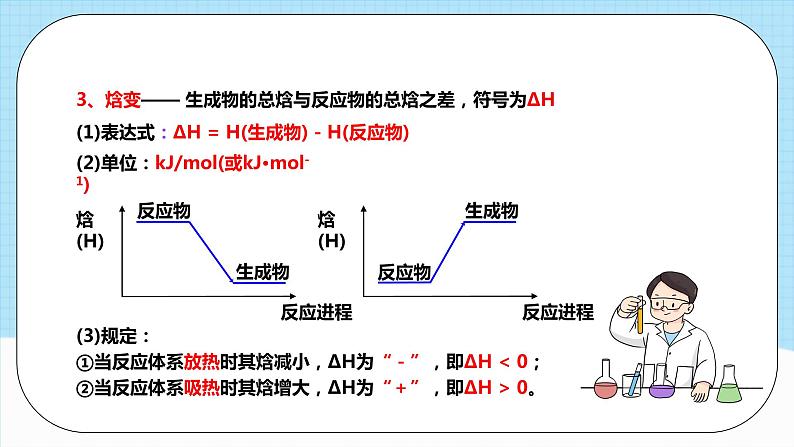
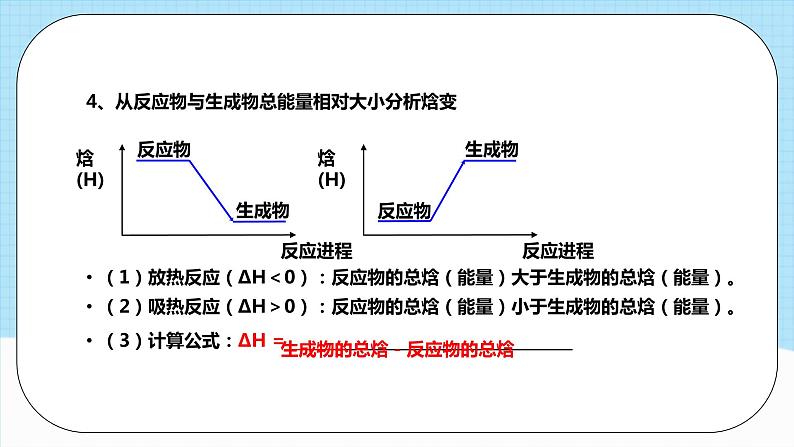
第一章单元复习模块一 反应热 焓变化学反应的特征:有物质变化,还伴随能量变化能量变化当能量变化以热能的形式表现时:【复习任务一】 反应热 焓变温故知新常见的放热反应与吸热反应①所有燃烧反应;②大多数化合反应;③酸碱中和反应;④金属与酸或水的置换反应;⑤物质的缓慢氧化;⑥铝热反应。①大多数分解反应③高温条件下C、H2、CO作还原剂的反应。②Ba(OH)2·8H2O与NH4Cl反应;【复习任务一】 反应热 焓变【注意】①不是分解反应都是吸热反应。如:H2O2的分解、KClO3的分解,属于放热反应。 ②要加热才能发生的反应不一定是吸热反应,比如铝热反应为放热反应。 (反应的吸放热与是否需要加热无关)为描述等压条件下的反应热,科学上引入了一个与内能有关的物理量—焓(符号为H)。1.内能(符号为U):体系内物质的各种能量的总和,受________、________和________________等的影响。2.焓(符号为H):与内能有关的物理量。3.焓变:在_______条件下进行的化学反应其反应热等于反应的焓变。温度压强物质的聚集状态等压【复习任务一】 反应热 焓变3、焓变—— 生成物的总焓与反应物的总焓之差,符号为∆H(1)表达式:ΔH = H(生成物) - H(反应物)(3)规定:①当反应体系放热时其焓减小,ΔH为“-”,即ΔH < 0;②当反应体系吸热时其焓增大,ΔH为“+”,即ΔH > 0。(2)单位:kJ/mol(或kJ·mol-1)4、从反应物与生成物总能量相对大小分析焓变 (1)放热反应(ΔH<0):反应物的总焓(能量)大于生成物的总焓(能量)。(2)吸热反应(ΔH>0):反应物的总焓(能量)小于生成物的总焓(能量)。(3)计算公式:ΔH = ___________________________生成物的总焓-反应物的总焓5、反应热的实质化学反应的实质:反应物中旧键的断裂(吸热),生成物中新键的形成(放热)。放热反应 ΔH<0吸热反应 ΔH>06、从反应物与生成物总键能相对大小分析焓变以1 mol H2(g)和1 mol Cl2(g)在在25℃和101kPa下反应生成2mol HCl(g)的能量变化为例。求H2(g)+Cl2(g)=2HCl(g)反应的反应热?断键吸收能量:436 KJ + 243 kJ = 679 kJ成键放出能量: 431 kJ + 431 kJ = 862 kJΔH = -183 kJ/mol计算公式:∆H=反应物的总键能(E吸) - 生成物的总键能(E放)计算反应热的三种方法:∆H=E(生成物的总能量)- E(反应物的总能量)∆H=E(反应物分子化学键断裂时所吸收的总能量)- E(生成物分子化学键形成时所释放的总能量)∆H=E(反应物的总键能)- E(生成物的总键能)归纳提升 【例题1】下列图象分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法中正确的是( )A.由图1知,石墨转变为金刚石是吸热反应B.由图2知,S(g)+O2(g)=SO2(g) ΔH1, S(s)+O2(g)=SO2(g)ΔH2 ,则ΔH1>ΔH2C.由图3知,白磷比红磷稳定D.由图4知,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0C课堂检测 【例题2】已知 2O(g)=O2(g) ∆H = - 496 kJ ∙mol -1,结合能量变化示意图。下列说法正确的是( )A.拆开 1 mol H2(g) 中的化学键需要吸收 932 kJ能量B.拆开 1 mol H2O(g) 中所有化学键需要吸收 926 kJ能量C.1 mol H2O(l) 转变为 1mol H2O(g)需要吸收 88 kJ能量D.2 mol H2(g) 和 1mol O2(g) 反应生成 2 mol H2O(l),共放热 1940 kJB 模块二 热化学方程式一.热化学方程式(1)定义: 热化学方程式表示_________________ 和______ 的关系的化学方程式。 参加反应物质的量 反应热H2(g)+I2(g)====2HI(g) △H=-14.9kJ/mol200℃101kPa物质变化能量变化(2)意义:热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。(3)实例:上述方程式表示的意义为1mol氢气与1mol碘蒸气完全反应生成2mol碘化氢气体,放出14.9 kJ的热量。【复习任务二】 热化学方程式温故知新「小结」热化学方程式化学计量数的意义:只能表示物质的量二、热化学方程式的书写方法①标明各物质的聚集状态 (固体s、液体l、气体g、溶液aq)②不需要标记“↓”和“↑”,③不用写“点燃”“加热”等引发条件 1、书写符合质量守恒定律的化学方程式2、注明反应物和生成物的聚集状态二、热化学方程式的书写方法①ΔH 只放右边,吸热用“+”,放热用“-”,单位是kJ/mol②ΔH 的值与系数相匹配。③系数仅仅表示实际参加反应的物质的量,不表示分子或原子个数; 故系数可以是整数、分数、小数、个数;25℃,101 kPa 下进行的化学反应,可以不注明。其他温度和压强要注明。3、注明反应时的温度和压强4、用△H表示化学反应放出或吸收的热量一写方程式二标状态三标条件四标 ΔH五标数值归纳总结“五查”法判断热化学方程式书写正误 ①看方程式是否配平; ②看各物质的聚集状态是否正确; ③看ΔH 变化的“+”、“-”是否正确; ④看反应热的单位是否为 kJ·mol-1; ⑤看反应热的数值与化学计量数是否相对应【例题3】1g氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是( ) A.2H2 +O2 = 2H2 O H = -571.6 kJ/mol B.2H2 (g)+O2 (g) =2H2 O(l) H = -571.6 kJ/mol C.H2 (g)+ 1/2O2 (g) = H2O(g) H =-285.8 kJ/mol D.2H2 (g)+O2 (g) = 2H2 O(g) H=-571.6 kJ/mol B课堂练习【例题4】将2 mol SO2(g)、1 mol O2(g)充入一密闭容器,被催化氧化为SO3(g),充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则该反应的热化学方程式应如何书写?【分析】2mol SO2、1mol O2充入恒容容器中,达平衡时,SO2的转化率为50%,则反应了的SO2的物质的量为1mol,放出热量98.3kJ,则每反应1molSO2,放出98.3kJ的热量。【答案】2SO2(g)+O2(g) ⇌2SO3(g) △H=-196.6 kJ•mol-1 或SO2(g)+O2(g) ⇌SO3(g),△H=-98.3 kJ•mol-1 模块三 中和热 燃烧热①测定中和热使用的若是强酸、强碱的稀溶液(即反应满足H+(aq) + OH-(aq) =H2O(l)),则生成1molH2O放出的热量为定57.3kJ。一、中和热(1)定义:在稀溶液中,酸与碱发生中和反应生成1mol 液态水和可溶性盐时所释放的热量。(2)注意事项:②测定中和热使用的若是弱酸、弱碱的稀溶液,由于弱酸、弱碱在电离时会吸热,所以生成1molH2O放热小于57.3kJ。③测定中和热使用的若是酸、碱的浓溶液,由于酸、碱的浓溶液在稀释时会放热,所以生成1molH2O放热大于57.3kJ。【复习任务三】 中和热 燃烧热温故知新二、燃烧热:1.概念: 101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量。①研究条件: ②反应物及其物质的量:③反应程度:④生成物:⑤燃烧热与物质的多少无关,只与物质的种类有关⑥符号: 单位:101kPa指定产物,没有特别说明,一般是在氧气中进行,且产物为稳定氧化物如:C→CO2,H→H2O(l),S→SO2等。【注意事项】纯物质 1mol(以燃烧1mol纯物质为标准来配平)完全燃烧△H<0kJ/mol例:语言表述——CH4的燃烧热为890.3 kJ/mol 符号表示——△H= -890.3 kJ/mol例:语言表述——H2的燃烧热为285.8 kJ/mol 符号表示——△H= -285.8 kJ/mol【注意事项】中文叙述燃烧热、中和热时可以不带“负号”, 但凡用ΔH表示时一定要有“负号”2、燃烧热表示的意义:中和热、燃烧热的异同点已知:H+(aq) + OH-(aq) = H2O(l) ΔH =﹣57.3 kJ·mol-1试比较下列反应中放出的热量与 57.3 kJ 的大小:(1)浓酸与浓碱反应生成 1 mol 水,Q1 _____57.3 kJ, ΔH1 _____ ΔH;(2)弱酸与弱碱反应生成 1 mol 水,Q2 _____57.3 kJ, ΔH2 _____ ΔH;(3)强酸与强碱反应生成 1 mol 水和难溶性盐,Q3 _____57.3 kJ, ΔH3 _____ ΔH。【例题5】中和热与57.3 kJ·mol-1的关系>>> < < < 课堂练习【例题6】已知下列两个热化学方程式: 2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ•mol-1 C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ•mol-1(1)H2的燃烧热为______________,C3H8的燃烧热为_____________(2)2 g H2和2 mol C3H8组成的混合气体完全燃烧放出的热量为____________ (3)现有H2和C3H8的混合气体5 mol,完全燃烧时放出热量3847 kJ,则混合气体中H2和C3H8的体积比为____________285.8 kJ•mol-1 2 220 kJ•mol-1 4725.8 kJ 3:1视频观看测量原理:用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热。Q:中和反应放出的热量 m:体系的质量C:体系的比热容 Δt:反应前后体系温度的差值Q = c · m ·Δt测量仪器:简易量热计(以盐酸和NaOH溶液反应为例)实验探究——中和反应反应热的测定实验讲解(1)测量哪些数据?(2)如何利用数据计算反应热?(3)如何提高实验的准确度?盐酸&NaOH的温度反应后体系的温度(最高温度)Q = ( m1+m2 ) ×c ×( t2 - t1 )∆ H = Q / n(H2O)实验探究——中和反应反应热的测定思考讨论【实验操作】(1)反应物温度的测量t1。①用量筒量取50mL 0.50mol/L盐酸, 打开杯盖, 倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量筒量取50mL 0.55mol/L NaOH溶液, 用温度计测量并记录NaOH溶液的温度(数据填入下表)。实验步骤实验探究——中和反应反应热的测定【实验操作】(2)反应后体系温度的测量t2。打开杯盖, 将量筒中的NaOH溶液迅速倒入量热计的内筒, 立即盖上杯盖, 插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将________温度记为反应后体系的温度。(3)重复上述步骤(1)至步骤(2)两次。实验探究——中和反应反应热的测定(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2-t1),将数据填入下表。(t2 - t1若异常要舍去)(2)取三次温度差的平均值作为计算依据。(3)根据温度差和比热容计算反应热。数据处理 为了计算简便,可以近似的认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:①50mL 盐酸的质量m1=50g, 50mL NaOH溶液质量m2=50g;②反应后生成的溶液的比热容c=4.18 J/(g .℃),50 mL 0.50 mol/L盐酸与 50 mL 0.55 mol/LNaOH溶液发生中和反应时放出的热量为:(m1+m2)·c·(t2-t1)=________0.418(t2-t1) kJ③生成1mol水时放出的热量为 。 HCl(aq) + NaOH (aq) = H2O(l) + NaCl (aq) 1 1 1 Q1 0.025mol 0.025mol 0.025mol Q = 0.418(t2-t1) kJ实验探究——中和反应反应热的测定中和反应反应热的测定实验(1)为了保证0.50mol· L-1的盐酸完全被NaOH中和,采用0.55mol·L-1NaOH溶液,使碱稍稍过量,因为过量的碱并不参加中和反应。(酸稍微过量也可以)(2)先后测量酸、碱及混合液的温度时,测定一种溶液后必须用水冲洗干净并用滤纸擦干。温度计的水银球部分要完全浸入溶液中,且要稳定一段时间再记下读数。(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。(4)操作时动作要快,尽量减少热量的散失。(5)实验时亦可选用浓度体积都不相同的酸碱溶液进行中和热的测定,但在计算时,应取二者中量少的一种,因为过量的酸/碱并不参加中和反应。(6)多次试验求平均值时,若有某一组的实验数据有明显偏差,应直接舍去。(7)隔热层的作用是保温隔热,减少热量损失。 注意事项【例题7】在测定中和热的实验中,下列说法正确的是( )A.使用环形玻璃搅拌器是为了加快反应速率,减小实验误差B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触C.用 0.5mol·L-1NaOH 溶液分别与 0.5mol·L-1 的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同D.在测定中和热实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等AAA课堂检测【例题8】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_____________。(2)如果不盖杯盖,所求得的中和反应反应热的绝对值将会__________(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验_________(填“相等”或“不相等”,下同);所求中和反应反应热与原实验_____,简述理由:_________。 【答案】 (1)环形玻璃搅拌器 (2)偏小 (3) 不相等 相等 中和反应反应热是指强酸与强碱的稀溶液发生中和反应 生成1 mol水时的反应热,与酸碱的用量无关 模块四 盖斯定律 1、盖斯定律: 一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。【复习任务四】 盖斯定律温故知新 2、盖斯定律: 如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是一样的。 ΔH1 + ΔH2 + ΔH3(图 1)(图2)ΔH = _____________________ ΔH =_______________________________ ΔH1+ΔH2 = ΔH3+ΔH4+ΔH5_【复习任务四】 盖斯定律3、盖斯定律在生产和科学研究中的意义有些反应,因为某些原因,导致反应热难以直接测定,如:(1)有些反应进行得很慢(2)有些反应不容易直接发生(3)有些反应的产品不纯(有副反应发生)但可以用盖斯定律间接求得。【复习任务四】 盖斯定律利用盖斯定律求反应热的步骤:(1)确定要求反应热的待求方程式(目标方程式)。(2)分析其反应物、生成物在条件方程式中的位置,明确根据已知方程式如何得到目标方程式(加减乘除)。(3)根据方程式的运算方式得出△H的计算方式 (△H必须带符号进行计算)。“同边相减,不同边相加”(消元)归纳总结【例题9】(1)已知:①2C(s)+O2(g)=2CO(g) △H1=-221.0 kJ·mol-1 ②2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1 则制备水煤气的反应③C(s)+H2O(g)=CO(g)+H2(g)的△H等于______________________________________________________________________________________________________(2)已知反应: ①H2(g) + O2(g) = H2O(g) ΔH1 ② N2(g) + O2(g) = NO2(g) ΔH2 ③ N2(g) + H2(g) =NH3(g) ΔH3则反应2NH3(g) + O2(g) =2NO2(g) + 3H2O(g)的ΔH=_____________________+131.3 kJ·mol-13ΔH1 + 2ΔH2 - 2ΔH3根据盖斯定律: (①-②):C(s)+H2O(g)=CO(g)+H2(g) ΔH=131.3kJ∙mol-1课堂练习【例题10】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:(2)Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1=+83 kJ·mol− 1CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2=−20 kJ·mol− 1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ·mol− 1则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= 。− 116kJ·mol− 1课程结束
第一章单元复习模块一 反应热 焓变化学反应的特征:有物质变化,还伴随能量变化能量变化当能量变化以热能的形式表现时:【复习任务一】 反应热 焓变温故知新常见的放热反应与吸热反应①所有燃烧反应;②大多数化合反应;③酸碱中和反应;④金属与酸或水的置换反应;⑤物质的缓慢氧化;⑥铝热反应。①大多数分解反应③高温条件下C、H2、CO作还原剂的反应。②Ba(OH)2·8H2O与NH4Cl反应;【复习任务一】 反应热 焓变【注意】①不是分解反应都是吸热反应。如:H2O2的分解、KClO3的分解,属于放热反应。 ②要加热才能发生的反应不一定是吸热反应,比如铝热反应为放热反应。 (反应的吸放热与是否需要加热无关)为描述等压条件下的反应热,科学上引入了一个与内能有关的物理量—焓(符号为H)。1.内能(符号为U):体系内物质的各种能量的总和,受________、________和________________等的影响。2.焓(符号为H):与内能有关的物理量。3.焓变:在_______条件下进行的化学反应其反应热等于反应的焓变。温度压强物质的聚集状态等压【复习任务一】 反应热 焓变3、焓变—— 生成物的总焓与反应物的总焓之差,符号为∆H(1)表达式:ΔH = H(生成物) - H(反应物)(3)规定:①当反应体系放热时其焓减小,ΔH为“-”,即ΔH < 0;②当反应体系吸热时其焓增大,ΔH为“+”,即ΔH > 0。(2)单位:kJ/mol(或kJ·mol-1)4、从反应物与生成物总能量相对大小分析焓变 (1)放热反应(ΔH<0):反应物的总焓(能量)大于生成物的总焓(能量)。(2)吸热反应(ΔH>0):反应物的总焓(能量)小于生成物的总焓(能量)。(3)计算公式:ΔH = ___________________________生成物的总焓-反应物的总焓5、反应热的实质化学反应的实质:反应物中旧键的断裂(吸热),生成物中新键的形成(放热)。放热反应 ΔH<0吸热反应 ΔH>06、从反应物与生成物总键能相对大小分析焓变以1 mol H2(g)和1 mol Cl2(g)在在25℃和101kPa下反应生成2mol HCl(g)的能量变化为例。求H2(g)+Cl2(g)=2HCl(g)反应的反应热?断键吸收能量:436 KJ + 243 kJ = 679 kJ成键放出能量: 431 kJ + 431 kJ = 862 kJΔH = -183 kJ/mol计算公式:∆H=反应物的总键能(E吸) - 生成物的总键能(E放)计算反应热的三种方法:∆H=E(生成物的总能量)- E(反应物的总能量)∆H=E(反应物分子化学键断裂时所吸收的总能量)- E(生成物分子化学键形成时所释放的总能量)∆H=E(反应物的总键能)- E(生成物的总键能)归纳提升 【例题1】下列图象分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法中正确的是( )A.由图1知,石墨转变为金刚石是吸热反应B.由图2知,S(g)+O2(g)=SO2(g) ΔH1, S(s)+O2(g)=SO2(g)ΔH2 ,则ΔH1>ΔH2C.由图3知,白磷比红磷稳定D.由图4知,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0C课堂检测 【例题2】已知 2O(g)=O2(g) ∆H = - 496 kJ ∙mol -1,结合能量变化示意图。下列说法正确的是( )A.拆开 1 mol H2(g) 中的化学键需要吸收 932 kJ能量B.拆开 1 mol H2O(g) 中所有化学键需要吸收 926 kJ能量C.1 mol H2O(l) 转变为 1mol H2O(g)需要吸收 88 kJ能量D.2 mol H2(g) 和 1mol O2(g) 反应生成 2 mol H2O(l),共放热 1940 kJB 模块二 热化学方程式一.热化学方程式(1)定义: 热化学方程式表示_________________ 和______ 的关系的化学方程式。 参加反应物质的量 反应热H2(g)+I2(g)====2HI(g) △H=-14.9kJ/mol200℃101kPa物质变化能量变化(2)意义:热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。(3)实例:上述方程式表示的意义为1mol氢气与1mol碘蒸气完全反应生成2mol碘化氢气体,放出14.9 kJ的热量。【复习任务二】 热化学方程式温故知新「小结」热化学方程式化学计量数的意义:只能表示物质的量二、热化学方程式的书写方法①标明各物质的聚集状态 (固体s、液体l、气体g、溶液aq)②不需要标记“↓”和“↑”,③不用写“点燃”“加热”等引发条件 1、书写符合质量守恒定律的化学方程式2、注明反应物和生成物的聚集状态二、热化学方程式的书写方法①ΔH 只放右边,吸热用“+”,放热用“-”,单位是kJ/mol②ΔH 的值与系数相匹配。③系数仅仅表示实际参加反应的物质的量,不表示分子或原子个数; 故系数可以是整数、分数、小数、个数;25℃,101 kPa 下进行的化学反应,可以不注明。其他温度和压强要注明。3、注明反应时的温度和压强4、用△H表示化学反应放出或吸收的热量一写方程式二标状态三标条件四标 ΔH五标数值归纳总结“五查”法判断热化学方程式书写正误 ①看方程式是否配平; ②看各物质的聚集状态是否正确; ③看ΔH 变化的“+”、“-”是否正确; ④看反应热的单位是否为 kJ·mol-1; ⑤看反应热的数值与化学计量数是否相对应【例题3】1g氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是( ) A.2H2 +O2 = 2H2 O H = -571.6 kJ/mol B.2H2 (g)+O2 (g) =2H2 O(l) H = -571.6 kJ/mol C.H2 (g)+ 1/2O2 (g) = H2O(g) H =-285.8 kJ/mol D.2H2 (g)+O2 (g) = 2H2 O(g) H=-571.6 kJ/mol B课堂练习【例题4】将2 mol SO2(g)、1 mol O2(g)充入一密闭容器,被催化氧化为SO3(g),充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则该反应的热化学方程式应如何书写?【分析】2mol SO2、1mol O2充入恒容容器中,达平衡时,SO2的转化率为50%,则反应了的SO2的物质的量为1mol,放出热量98.3kJ,则每反应1molSO2,放出98.3kJ的热量。【答案】2SO2(g)+O2(g) ⇌2SO3(g) △H=-196.6 kJ•mol-1 或SO2(g)+O2(g) ⇌SO3(g),△H=-98.3 kJ•mol-1 模块三 中和热 燃烧热①测定中和热使用的若是强酸、强碱的稀溶液(即反应满足H+(aq) + OH-(aq) =H2O(l)),则生成1molH2O放出的热量为定57.3kJ。一、中和热(1)定义:在稀溶液中,酸与碱发生中和反应生成1mol 液态水和可溶性盐时所释放的热量。(2)注意事项:②测定中和热使用的若是弱酸、弱碱的稀溶液,由于弱酸、弱碱在电离时会吸热,所以生成1molH2O放热小于57.3kJ。③测定中和热使用的若是酸、碱的浓溶液,由于酸、碱的浓溶液在稀释时会放热,所以生成1molH2O放热大于57.3kJ。【复习任务三】 中和热 燃烧热温故知新二、燃烧热:1.概念: 101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量。①研究条件: ②反应物及其物质的量:③反应程度:④生成物:⑤燃烧热与物质的多少无关,只与物质的种类有关⑥符号: 单位:101kPa指定产物,没有特别说明,一般是在氧气中进行,且产物为稳定氧化物如:C→CO2,H→H2O(l),S→SO2等。【注意事项】纯物质 1mol(以燃烧1mol纯物质为标准来配平)完全燃烧△H<0kJ/mol例:语言表述——CH4的燃烧热为890.3 kJ/mol 符号表示——△H= -890.3 kJ/mol例:语言表述——H2的燃烧热为285.8 kJ/mol 符号表示——△H= -285.8 kJ/mol【注意事项】中文叙述燃烧热、中和热时可以不带“负号”, 但凡用ΔH表示时一定要有“负号”2、燃烧热表示的意义:中和热、燃烧热的异同点已知:H+(aq) + OH-(aq) = H2O(l) ΔH =﹣57.3 kJ·mol-1试比较下列反应中放出的热量与 57.3 kJ 的大小:(1)浓酸与浓碱反应生成 1 mol 水,Q1 _____57.3 kJ, ΔH1 _____ ΔH;(2)弱酸与弱碱反应生成 1 mol 水,Q2 _____57.3 kJ, ΔH2 _____ ΔH;(3)强酸与强碱反应生成 1 mol 水和难溶性盐,Q3 _____57.3 kJ, ΔH3 _____ ΔH。【例题5】中和热与57.3 kJ·mol-1的关系>>> < < < 课堂练习【例题6】已知下列两个热化学方程式: 2H2(g)+O2(g) =2H2O(l) △H=-571.6 kJ•mol-1 C3H8(g)+5O2(g) =3CO2(g)+4 H2O(l) △H=-2 220 kJ•mol-1(1)H2的燃烧热为______________,C3H8的燃烧热为_____________(2)2 g H2和2 mol C3H8组成的混合气体完全燃烧放出的热量为____________ (3)现有H2和C3H8的混合气体5 mol,完全燃烧时放出热量3847 kJ,则混合气体中H2和C3H8的体积比为____________285.8 kJ•mol-1 2 220 kJ•mol-1 4725.8 kJ 3:1视频观看测量原理:用温度计测量反应前后体系的温度变化,根据有关物质的比热容等来计算反应热。Q:中和反应放出的热量 m:体系的质量C:体系的比热容 Δt:反应前后体系温度的差值Q = c · m ·Δt测量仪器:简易量热计(以盐酸和NaOH溶液反应为例)实验探究——中和反应反应热的测定实验讲解(1)测量哪些数据?(2)如何利用数据计算反应热?(3)如何提高实验的准确度?盐酸&NaOH的温度反应后体系的温度(最高温度)Q = ( m1+m2 ) ×c ×( t2 - t1 )∆ H = Q / n(H2O)实验探究——中和反应反应热的测定思考讨论【实验操作】(1)反应物温度的测量t1。①用量筒量取50mL 0.50mol/L盐酸, 打开杯盖, 倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。②用另一个量筒量取50mL 0.55mol/L NaOH溶液, 用温度计测量并记录NaOH溶液的温度(数据填入下表)。实验步骤实验探究——中和反应反应热的测定【实验操作】(2)反应后体系温度的测量t2。打开杯盖, 将量筒中的NaOH溶液迅速倒入量热计的内筒, 立即盖上杯盖, 插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将________温度记为反应后体系的温度。(3)重复上述步骤(1)至步骤(2)两次。实验探究——中和反应反应热的测定(1)取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)。计算温度差(t2-t1),将数据填入下表。(t2 - t1若异常要舍去)(2)取三次温度差的平均值作为计算依据。(3)根据温度差和比热容计算反应热。数据处理 为了计算简便,可以近似的认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:①50mL 盐酸的质量m1=50g, 50mL NaOH溶液质量m2=50g;②反应后生成的溶液的比热容c=4.18 J/(g .℃),50 mL 0.50 mol/L盐酸与 50 mL 0.55 mol/LNaOH溶液发生中和反应时放出的热量为:(m1+m2)·c·(t2-t1)=________0.418(t2-t1) kJ③生成1mol水时放出的热量为 。 HCl(aq) + NaOH (aq) = H2O(l) + NaCl (aq) 1 1 1 Q1 0.025mol 0.025mol 0.025mol Q = 0.418(t2-t1) kJ实验探究——中和反应反应热的测定中和反应反应热的测定实验(1)为了保证0.50mol· L-1的盐酸完全被NaOH中和,采用0.55mol·L-1NaOH溶液,使碱稍稍过量,因为过量的碱并不参加中和反应。(酸稍微过量也可以)(2)先后测量酸、碱及混合液的温度时,测定一种溶液后必须用水冲洗干净并用滤纸擦干。温度计的水银球部分要完全浸入溶液中,且要稳定一段时间再记下读数。(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。(4)操作时动作要快,尽量减少热量的散失。(5)实验时亦可选用浓度体积都不相同的酸碱溶液进行中和热的测定,但在计算时,应取二者中量少的一种,因为过量的酸/碱并不参加中和反应。(6)多次试验求平均值时,若有某一组的实验数据有明显偏差,应直接舍去。(7)隔热层的作用是保温隔热,减少热量损失。 注意事项【例题7】在测定中和热的实验中,下列说法正确的是( )A.使用环形玻璃搅拌器是为了加快反应速率,减小实验误差B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触C.用 0.5mol·L-1NaOH 溶液分别与 0.5mol·L-1 的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同D.在测定中和热实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等AAA课堂检测【例题8】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_____________。(2)如果不盖杯盖,所求得的中和反应反应热的绝对值将会__________(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验_________(填“相等”或“不相等”,下同);所求中和反应反应热与原实验_____,简述理由:_________。 【答案】 (1)环形玻璃搅拌器 (2)偏小 (3) 不相等 相等 中和反应反应热是指强酸与强碱的稀溶液发生中和反应 生成1 mol水时的反应热,与酸碱的用量无关 模块四 盖斯定律 1、盖斯定律: 一个化学反应,不管是一步完成还是分几步完成,其反应热是相同的。化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。【复习任务四】 盖斯定律温故知新 2、盖斯定律: 如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是一样的。 ΔH1 + ΔH2 + ΔH3(图 1)(图2)ΔH = _____________________ ΔH =_______________________________ ΔH1+ΔH2 = ΔH3+ΔH4+ΔH5_【复习任务四】 盖斯定律3、盖斯定律在生产和科学研究中的意义有些反应,因为某些原因,导致反应热难以直接测定,如:(1)有些反应进行得很慢(2)有些反应不容易直接发生(3)有些反应的产品不纯(有副反应发生)但可以用盖斯定律间接求得。【复习任务四】 盖斯定律利用盖斯定律求反应热的步骤:(1)确定要求反应热的待求方程式(目标方程式)。(2)分析其反应物、生成物在条件方程式中的位置,明确根据已知方程式如何得到目标方程式(加减乘除)。(3)根据方程式的运算方式得出△H的计算方式 (△H必须带符号进行计算)。“同边相减,不同边相加”(消元)归纳总结【例题9】(1)已知:①2C(s)+O2(g)=2CO(g) △H1=-221.0 kJ·mol-1 ②2H2(g)+O2(g)=2H2O(g) △H2=-483.6kJ·mol-1 则制备水煤气的反应③C(s)+H2O(g)=CO(g)+H2(g)的△H等于______________________________________________________________________________________________________(2)已知反应: ①H2(g) + O2(g) = H2O(g) ΔH1 ② N2(g) + O2(g) = NO2(g) ΔH2 ③ N2(g) + H2(g) =NH3(g) ΔH3则反应2NH3(g) + O2(g) =2NO2(g) + 3H2O(g)的ΔH=_____________________+131.3 kJ·mol-13ΔH1 + 2ΔH2 - 2ΔH3根据盖斯定律: (①-②):C(s)+H2O(g)=CO(g)+H2(g) ΔH=131.3kJ∙mol-1课堂练习【例题10】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:(2)Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1=+83 kJ·mol− 1CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2=−20 kJ·mol− 1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=−121 kJ·mol− 1则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= 。− 116kJ·mol− 1课程结束
相关资料
更多









