





高中化学鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应授课ppt课件
展开1.通过对稀硫酸与氢氧化钡溶液反应实质的研究,明确离子反应的意义,并认识到溶液中复分解型离子反应的条件。2.通过对溶液中电解质、非电解质,强弱电解质存在形式的分析,掌握离子方程式的书写方法及离子方程式正误的判断方法。3.通过离子反应实质的认知,理解常见离子的检验原理以及检验操作。4.通过粗盐的提纯实验,设计并实现粗盐的提纯、物质的除杂。
学习任务1 离子反应与离子方程式
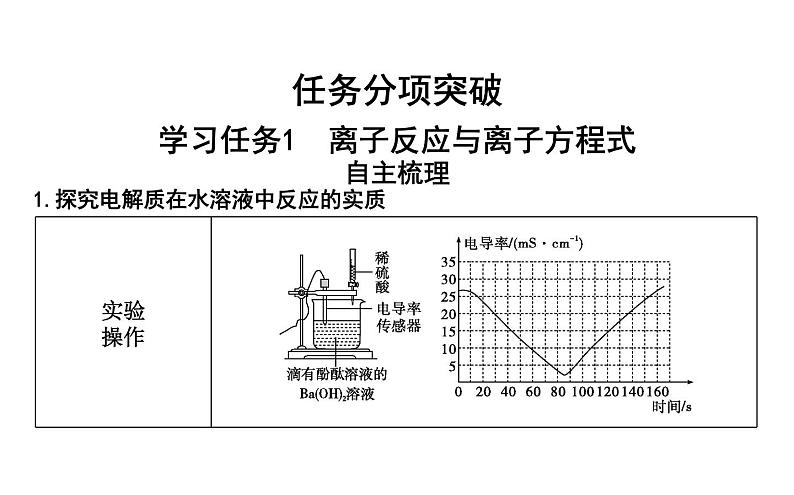
1.探究电解质在水溶液中反应的实质
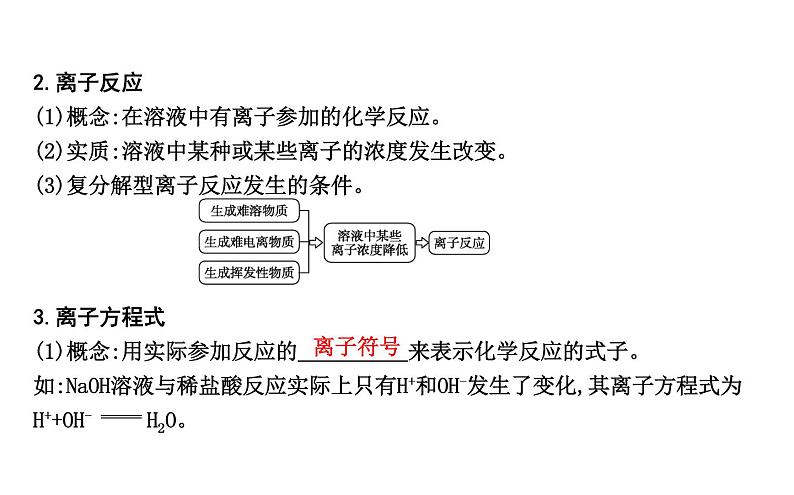
2.离子反应(1)概念:在溶液中有离子参加的化学反应。(2)实质:溶液中某种或某些离子的浓度发生改变。(3)复分解型离子反应发生的条件。
3.离子方程式(1)概念:用实际参加反应的 来表示化学反应的式子。如:NaOH溶液与稀盐酸反应实际上只有H+和OH-发生了变化,其离子方程式为H++OH- H2O。
②方法二:书写步骤(以氯化钡溶液和硫酸钠溶液反应为例)。
探究1 离子反应的判定离子反应是电解质电离后以离子的形式参与的化学反应,绝大多数的离子反应是在水溶液中进行的。从微观角度看离子反应可以发生在离子与离子之间、离子与分子之间、离子与原子之间,所以判断一个反应是否是离子反应就是判断该反应过程中是否有离子参与了反应。电解质除了在水溶液中发生电离以外,有些电解质在熔融状态也能发生电离(强碱、盐、活泼金属氧化物),那么这类物质在熔融态状态下的反应也是离子反应。
问题1:AgNO3溶液与NaCl溶液混合出现白色沉淀;Cl2用NaOH溶液吸收;光亮的铁片置于硫酸铜溶液中表面变红色。上述三个反应是离子反应吗?如果是,反应的微粒分别是什么?其共同点是什么?提示:三个反应都是离子反应。第一个反应是Ag+与Cl-之间的反应;第二个反应是Cl2分子与OH-之间的反应;第三个是Fe原子与Cu2+之间的反应。共同点是都有离子参与了反应。问题2:高炉炼铁是CO与Fe2O3反应得到金属铁;高温对熔融氯化钠通直流电得到了金属钠和氯气。这两个反应是离子反应吗?为什么?提示:高温下CO与Fe2O3反应得到金属铁的反应不是离子反应,因为CO与Fe2O3都是非电解质,没有离子参与;高温对熔融氯化钠通直流电,生成金属钠和氯气的反应是离子反应,因为熔融条件下氯化钠发生了电离,生成了Na+与Cl-,Na+与Cl-转变为金属钠和氯气,发生反应的是离子,所以是离子反应。问题3:通过前面的探究,你对确定是否是离子反应有哪些方面的认识?提示:离子反应必须有离子参与。主要有两种情况,一是电解质(酸、碱、盐)在水中发生的反应;二是电解质(强碱、盐和活泼金属氧化物)熔融条件下的反应。
探究2 离子方程式的书写与判断因为离子反应揭示了电解质在水溶液中反应的微观实质,引发了同学们的学习兴趣。同学们根据自己的理解,纷纷把学过的一些化学反应用离子方程式表达了出来。
提示:都不正确。CaCO3难溶于水,主要以固体存在于溶液中,不能拆为离子;AgNO3溶液与Cu反应的离子方程式电荷不守恒。
提示:这两种写法都是错误的。书写离子方程式首先确定是否是离子反应,氢气与氯气反应不是在水溶液中进行,没有离子参与,不是离子反应;Fe与稀盐酸反应生成的
是Fe2+,违背了化学事实。
提示:(1)× Cu(OH)2为难溶物,不能拆成Cu2+和2OH-的形式。
提示:(2)× Na2O为氧化物,在水溶液中会与水发生反应,不可拆成离子的形式。
离子方程式书写及正误判断的要点
1.在书写离子方程式或判断离子方程式正误时,必须遵循以电解质的主要存在形式表达物质。也就是说,虽然是电解质,但由于难溶解、难电离(弱电解质),主要以分子形式存在,就不能写成离子。2.具体书写和判断要从“两易”“两等”和“两查”入手
1.(2021·黑龙江望奎一中月考)下列反应属于离子反应的是( )A.实验室用锌与稀硫酸制取氢气 B.高温下碳酸钙的分解C.氢气在氯气中燃烧 D.N2和H2反应生成NH3
解析:Zn与稀硫酸反应实际是Zn与溶液中的H+反应生成H2,属于离子反应,A符合题意;碳酸钙高温分解不在溶液中进行,不属于离子反应,B不符合题意;H2在Cl2中燃烧生成HCl,不在溶液中进行,不属于离子反应,C不符合题意;N2与H2反应生成NH3,不在溶液中进行,不属于离子反应,D不符合题意。
2.(2021·辽宁学业考试)下列各组离子能在溶液中大量共存的是( )
离子能否大量共存的判断思路
(1)注意题干中的附加条件。
②酸性环境:“强酸性溶液”“使石蕊变红的溶液”一定含有H+。③碱性环境:“强碱性溶液”“使酚酞变红的溶液”一定含有OH-。
题点二 离子方程式3.(2021·黑龙江哈尔滨期末)下列反应可用离子方程式“H++OH- H2O”表示的是( )A.Na2CO3溶液与Ba(OH)2溶液混合B.NH4Cl溶液与Ca(OH)2溶液混合C.H2SO4溶液与KOH溶液混合D.NaHCO3溶液与NaOH溶液混合
判断离子方程式正误的准则
学习任务2 离子反应的应用
(2)实验用品。①试剂:粗食盐水,稀盐酸,稀硫酸,NaOH溶液,Ba(OH)2溶液,Na2CO3溶液,BaCl2溶液。②仪器:烧杯,漏斗,玻璃棒,表面皿,pH试纸,滤纸,试管,胶头滴管,铁架台。(3)实验方案设计。
探究1 离子的检验离子检验是利用了离子反应的原理。待检离子能发生特定的离子反应而呈现出特征现象(沉淀、气体、溶液颜色变化等),从而得出离子是否存在的结论。对下列关于离子的检验方案的问题作出你的判断。问题1:某同学向未知液中滴加AgNO3溶液,结果出现了白色沉淀,能不能得出溶液中存在Cl-的结论?
提示:不可行,加入稀盐酸引入了Cl-。应该先加稀硝酸酸化,再加AgNO3溶液,若出现白色沉淀,可确定存在Cl-。
探究2 物质的分离与提纯
提示:可选择Na2CO3、NaOH、BaCl2溶液,使杂质离子分别转化为CaCO3、Mg(OH)2、BaSO4沉淀而除去。问题5:为了把杂质离子去除干净,操作的原则是什么?提示:除杂试剂要加过量,然后考虑除去过量的试剂。
问题6:为了最后能得到纯净的氯化钠溶液,思考Na2CO3、BaCl2、NaOH溶液的加入顺序。提示:粗盐提纯试剂的加入顺序为(1)BaCl2溶液→NaOH溶液→Na2CO3溶液→稀盐酸;(2)NaOH溶液→BaCl2溶液→Na2CO3溶液→稀盐酸;(3)BaCl2溶液→Na2CO3溶液→NaOH溶液→稀盐酸。注意Na2CO3溶液一定要在BaCl2溶液后加入,NaOH溶液不做要求。
1.常见的离子检验方案
2.物质的分离和提纯原则(1)尽量不带入新杂质。为了将杂质离子除净,除杂试剂必须稍过量。(2)过量试剂必须便于后续操作除去。(3)有多种杂质时要考虑试剂的加入顺序,后加试剂要能除去前面的过量试剂。3.食盐精制的操作流程
A.先用盐酸酸化,再加BaCl2溶液B.先用硝酸酸化,再加BaCl2溶液C.加入用硝酸酸化的BaCl2溶液D.先用盐酸酸化,再加Ba(NO3)2溶液
2.下列离子检验的方法不正确的是( )
A.Na2CO3溶液B.NaOH溶液C.BaCl2溶液D.稀盐酸
题点二 物质的分离提纯
A.BaCl2、Na2CO3B.Na2CO3、BaCl2C.Ba(NO3)2、Na2CO3D.BaCl2、K2CO3
混合物的组成分析→沉淀剂的选择→合理安排加入沉淀剂的顺序→考虑过量沉淀剂如何除去→确定实验步骤及实验操作。
1.误认为电解质之间的反应就是离子反应,其实电解质只有在水中(或熔融后)才能发生离子反应。2.误认为强电解质都应写成离子,其实难溶盐在水中主要是以固体存在,不能拆写为离子形式。3.误认为Ca(OH)2是强碱,全部电离,书写离子方程式时拆写,其实由于Ca(OH)2是微溶化合物,石灰乳更多以未溶固体的形式存在,应写成Ca(OH)2。
5.误认为粗盐提纯时加入Na2CO3,可同时除去Ca2+、Mg2+。其实由于MgCO3微溶,应该用NaOH除去Mg2+。
随着我国工业化进程的加快,在经济、生活得到大幅度提高的同时,环境的污染问题越来越得到人们的重视。某化学小组根据某地一化工厂的工艺推断该工厂的废水中可能大量存在下表离子中的4种:
该小组的同学取适量该废水进行实验,以确定废水中存在的离子,其实验操作流程如图:(1)废水中一定含有的离子是 (填离子符号),确定不存在的几种离
子的依据是 。
该小组的同学取适量该废水进行实验,以确定废水中存在的离子,其实验操作流程如图:
(2)生成白色固体Ⅰ的离子方程式为 。
(3)上述实验中无法确定是否存在的离子有 (填离子符号),若要进一步确定存在的离子,可取适量该废水加入足量Ba(NO3)2溶液中,过滤后向滤液中加
入 (填化学式)溶液,产生白色沉淀,可确定 存在。
高中化学第4节 离子反应优质ppt课件: 这是一份高中化学第4节 离子反应优质ppt课件,共33页。PPT课件主要包含了学习目标,特征反应,氧化还原反应,消耗标准液的体积,物质的量浓度等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应备课ppt课件: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应备课ppt课件,共60页。PPT课件主要包含了分点突破1,离子反应,分点突破2,离子方程式,分点突破3,分点突破4,离子反应的应用等内容,欢迎下载使用。
鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应习题课件ppt: 这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应习题课件ppt,文件包含鲁科版高中化学必修第一册第2章元素与物质世界第2节电解质的电离离子反应第2课时离子反应课件ppt、鲁科版高中化学必修第一册第2章元素与物质世界第2节电解质的电离离子反应第2课时离子反应课后习题含答案doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。













