





2020-2021学年第2节 电解质的电离 离子反应评课课件ppt
展开1.准确理解电解质在水溶液中反应的实质2.掌握酸、碱、盐之间离子反应发生的条件3.掌握离子方程式的书写方法,并能书写简单的离子方程式4.明确离子方程式的意义
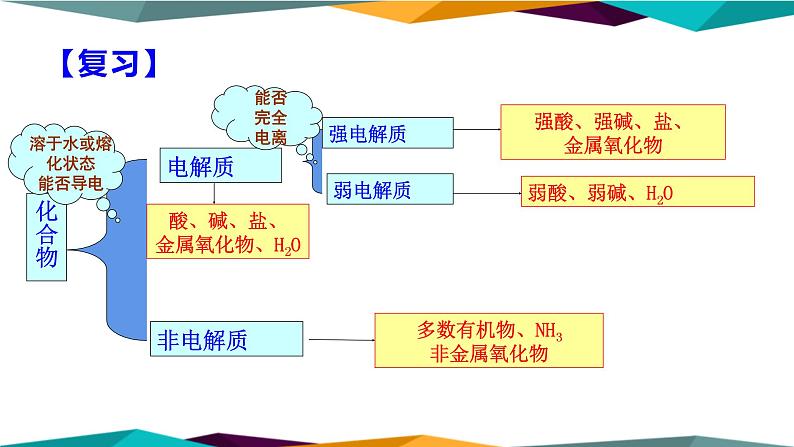
酸、碱、盐、金属氧化物、H2O
强酸、强碱、盐、金属氧化物
多数有机物、NH3非金属氧化物
溶于水或熔化状态能否导电
【自我诊断 】有以下10种物质:①铜,②稀硫酸,③氯化氢,④氨气,⑤氟化氢,⑥二氧化碳,⑦乙酸,⑧氯化钠,⑨碳酸钙,⑩氯气。结合下表中提示的信息,把符合条件的物质的序号填入相应的位置。
(1)属于电解质的是______________________; (2)属于非电解质的_____________________;(3)属于强电解质的是____________________;(4)属于弱电解质的是____________________;(5)既不是电解质也不是非电解质的是______ ;
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
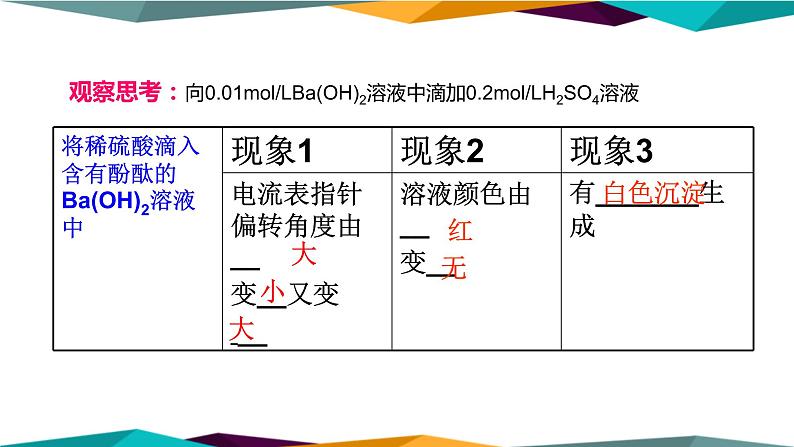
观察思考:向0.01ml/LBa(OH)2溶液中滴加0.2ml/LH2SO4溶液
②溶液的红色逐渐变浅,直至消失;
③指针不断偏向零,再滴加时,又不断偏大。
② 溶液中OH-离子浓度逐渐减小
①生成了BaSO4白色沉淀;
③溶液中离子浓度先减小,有离子参加了反应,硫酸过量后离子浓度又增加。
Ba(OH)2 + H2SO4 = BaSO4 +2 H2O
氢氧化钡与稀硫酸反应的实质是什么?
实质:稀硫酸与氢氧化钡溶液的反应,实质上是 H+与OH-发生反应、Ba2+与SO42-发生反应, 反应物中离子浓度减少,即离子间发生了反应。
离子反应:在溶液中有离子参加的化学反应叫做离子反应。
反应物中某些离子浓度的减小。
下列反应不属于离子反应的是 A 实验室用氯酸钾制取氧气 。 B 实验室用大理石和稀盐酸制取二氧化碳。 C 实验室用锌粒和稀硫酸制取氢气。 D 工业上用石灰石制取生石灰。
分析下列溶液的离子组成,判断混合后能否发生反应,能反应的分析反应的实质。
1、NaOH溶液与盐酸混合2、Na2CO3溶液和盐酸混合3、KCl溶液与AgNO3溶液混合4、NaOH溶液与K2SO4溶液混合
H+与OH-结合生成难电离的水
CO32-与 H+结合生成H2O和CO2气体
Cl-与Ag+结合生成AgCl沉淀;
酸、碱、盐在溶液中发生复分解反应的条件?溶液中离子间不能大量共存的条件?
1、生成难电离的物质:2、生成易挥发的物质(气体) :3、生成难溶物质(沉淀):
水、弱酸(CH3COOH HClO)、弱碱(NH3·H2O)等
BaSO4、AgCl、CaCO3 、 BaCO3 、Mg(OH)2、 Fe(OH)3、 Cu(OH)2、 Al(OH)3等
下列能发生离子反应的是A KCl 溶液与 NaOH溶液混合B AgNO3溶液与 NaCl溶液混合C Na2CO3溶液与Ca(OH)2溶液混合 D NaCl溶液与 Ca(NO3)2溶液混合
——用实际参加反应的离子符号表示离子反应的式子叫做离子方程式
①“写”,写正确的化学方程式②“拆”,把易溶于水且易电离的物质(强酸、强碱、可溶性的盐)写成离子形式,其他物质写化学式③“删”,删去两边没反应的离子④“查”,检查方程式两边各元素、原子个数和电荷数是否守恒,系数最简。
HCl、H2SO4、HNO3、HClO4、HBr、HI
除AgCl外绝大部分可溶
除BaSO4外(CaSO4、Ag2SO4微溶)绝大部分可溶
除钾、钠、铵的碳酸盐外绝大部分不可溶
NaOH KOH Ca(OH)2 Ba(OH)2
Ag++NO3- + H++Cl- ==AgCl↓+ H++NO3-
离子方程式的书写步骤:写、改、删、查
AgNO3溶液与HCl溶液反应
AgNO3 + HCl ==AgCl↓ + HNO3
Ag++Cl- ==AgCl↓
稀盐酸与氢氧化钡溶液反应a、写:写出反应的化学方程式:b、改:把强酸、强碱、易溶于水的盐改写为离子形式,其他物质用化学式表示:
Ba(OH)2+2HCl=BaCl2 +2H2O
Ba2++2OH-+2H++2Cl-=Ba2+ +2Cl-+2H2O
c、删:删去等号两边未反应的离子d、查:检查离子方程式两边各元素的原子个数及电荷总数是否相等,得到离子方程式:
H++OH- =H2O
Ba2++SO42-=BaSO4↓
1、 NaOH溶液与H2SO4溶液的反应 2、 KOH溶液与盐酸的反应
3、BaCl2溶液和Na2SO4溶液的反应 4、Ba(NO3)2溶液中加Na2SO4溶液的反应
6、碳酸钙与盐酸溶液反应 CaCO3+2H+=Ca2++H2O+CO2↑
5、 碳酸钠与盐酸溶液反应 CO32-+2H+=H2O+CO2↑
正确书写离子方程式应注意的问题:离子方程式正误的快速判断法
1.尊重客观事实。不能主观臆造2.看清存在的形式,拆分必须得当3.遵循两个守恒。左右两边配平
思考:离子方程式和化学方程式的联系和区别是什么?
1.都可以用来表示化学反应2.化学方程式只能表示一个具体的化学反应3.离子方程式不但可以表示一个反应,而且可以表示一类反应,并揭示这类反应的实质
2、检验某些离子的存在
取少量溶液于试管中,先加入几滴AgNO3 溶液,若产生白色沉淀,再滴加足量稀硝酸,沉淀不消失,证明含Cl-
取少量溶液于试管中,先加入足量的稀盐酸,无沉淀生成,再加入几滴BaCl2 溶液,若产生白色沉淀,证明含SO42-
1、离子反应、离子反应方程式的概念2、离子反应发生的条件:3、离子反应方程式书写:4、离子方程式的意义
揭示反应的实质;表示一类化学反应
高中化学鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应授课ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册<a href="/hx/tb_c4002542_t3/?tag_id=26" target="_blank">第2节 电解质的电离 离子反应授课ppt课件</a>,共26页。PPT课件主要包含了活动·探究,水是极弱的电解质等内容,欢迎下载使用。
化学必修 第一册第3节 化学中常用的物理量——物质的量多媒体教学ppt课件: 这是一份化学必修 第一册第3节 化学中常用的物理量——物质的量多媒体教学ppt课件,共19页。PPT课件主要包含了气体摩尔体积,是错是对,解释未说是标况下,概括·整合等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应教学ppt课件: 这是一份高中化学鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应教学ppt课件,共26页。PPT课件主要包含了活动·探究,水是极弱的电解质等内容,欢迎下载使用。














